Сахарный диабет является глобальной пандемией XXI века. По данным Международной диабетической федерации (IDF), в 2017 году количество пациентов с сахарным диабетом во всем мире составляет 424,9 млн. В России официально, по данным Федерального регистра, сахарным диабетом страдает 3%, а реально - более 6% населения (8,5 млн) [1]. Заболеваемость сахарным диабетом во всем мире является огромной проблемой общественного здравоохранения и носит характер пандемии. Макро- и микрососудистые осложнения, которые существенно ухудшают прогноз таких больных, обусловлены развивающейся и прогрессирующей дисфункцией эндотелия. Нарушение нормального функционирования эндотелия при сахарном диабете, что проявляется в нарушении его вазомоторной, антитромботической, противовоспалительной и адгезивной функций, может привести к развитию атеросклероза и нарушению мозгового кровообращения [2].
Большинство противодиабетических средств не оказывают эндотелиопротекторного действия. Поэтому весьма перспективной может быть группа препаратов с плейотропными эффектами, которые бы не только обладали гипогликемическим действием, но и улучшали вазодилатирующую и иные функции эндотелия при сахарном диабете. Таковыми могут являться агонисты рецептора GPR119, повышающие уровень циркулирующих инкретинов – ГПП-1 и ГИП. Агонисты рецепторов ГПП-1, действуя на рецепторы, локализованные на клетках эндотелия, активируют эндотелиальную NO-синтазу (eNOS) и повышают продукцию оксида азота, что улучшает вазодилатацию. Этот механизм действия связан с активацией сигнального пути АМРК – AMP-activated protein kinase [3]. В данном исследовании для оценки влияния соединения ZB-16 на вазодилатирующую функцию эндотелия мы выбрали модель комбинированной патологии: экспериментальный сахарный диабет и хроническое нарушение мозгового кровообращения, так как эти два состояния часто сопутствуют друг другу и нередко вытекают друг из друга [4].
Цель исследования
Изучение влияния агониста рецептора GPR119, соединения ZB-16 (Дипиарона), метформина и их комбинации на вазодилатирующую функцию эндотелия у животных с сахарным диабетом и хроническим нарушением мозгового кровообращения.
Материалы и методы исследования
Дизайн исследования представлен на рисунке 1.
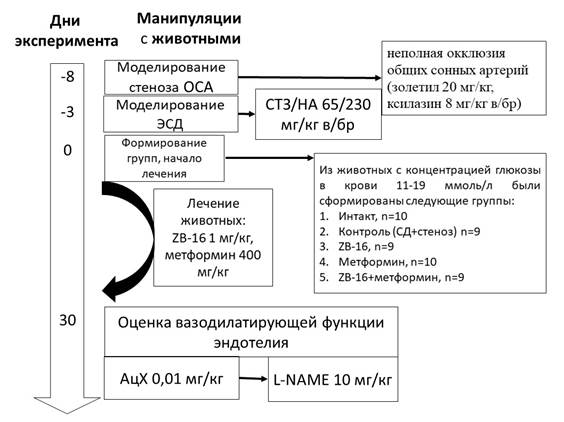
Рис. 1. Дизайн исследования. Примечание: ОСА – общие сонные артерии,
ЭСД – экспериментальный сахарный диабет, АцХ – ацетилхолин,
L-NAME- нитро-L-аргинин, n – число животных в группе
Исследование было выполнено на 84 беспородных крысах (ФГУП ПЛЖ «Рапполово», Ленинградская область, РФ) в возрасте 12 месяцев. Операционные процедуры проводились с использованием наркоза золетил 20 мг/кг и ксилазин 8 мг/кг внутрибрюшинно. Для подготовки операционного поля крыс фиксировали лейкопластырем за лапы в положении на спине на хирургическом столике. Волосяной покров с передней части шеи удалялся депиляционным кремом от нижней челюсти до грудины, поверхность кожи обрабатывалась раствором 70% спирта. Отступив 0,5 см от грудины, выполняли продольный разрез по срединной линии шеи длиной 2 см. Подкожно-жировой слой разрезался сосудистыми ножницами, края раны разводились в стороны посредством зажимов. Выделялся сонный треугольник, образованный сверху двубрюшной мышцей, латерально – грудино-ключично-сосцевидной мышцей и медиально – грудино-подъязычной мышцей. Далее выделялся сосудисто-нервный пучок, образованный общей сонной артерией и блуждающим нервом, который орошался 2% раствором лидокаина. Выделение общей сонной артерии производилось без прикосновения к блуждающему нерву. В качестве лигатуры использовался нерассасывающийся шовный материал. После выделения общих сонных артерий под них подводились лигатуры и нейлоновая нить диаметром 4-0, к которой привязывался сосуд. В последующем нить извлекалась, сосуд занимал свободное пространство под лигатурой, и просвет сосуда восстанавливался на величину, равную диаметру нейлоновой нити. Аналогичная операция выполнялась на другой общей сонной артерии.
Оценка скорости кровотока по общим сонным артериям проводилась лазерной доплерографией до и после операции стенозирования сразу после наложения лигатур с помощью полиграфа MP150, модуля для лазер-доплеровской флоуметрии LDF100C и программного обеспечения AcqKnowledge 4.2 (Biopac Systems, USA). Далее операционное поле обрабатывалось раствором хлоргексидина 0,05%, рану ушивали кисетным швом, который в свою очередь обрабатывался раствором йода. После операции крысы помещались в клетки с чистыми опилками по 5-6 особей. На пол клетки в чашке Петри помещался увлажненный корм, животные находились под наблюдением в течение 3 суток (72 часа).
Через 5 дней после стенозирования общих сонных артерий (это время необходимо для восстановления животных) моделировали экспериментальный никотинамид-стрептозотоцин-индуцированный сахарный диабет [5]. Раствор никотинамида вводили внутрибрюшинно однократно (230 мг/кг), и через 15 минут стрептозотоцин (65 мг/кг). Предварительно, за 12 часов (на ночь), животные лишались пищи со свободным доступом к воде. Стрептозотоцин разводили холодным цитратным буфером (1мМ, pH 4.5) в темной таре, для разведения никотинамида использовали раствор NaCl (0,9%).
Спустя 3 суток после введения стрептозотоцина (72 часа) измеряли уровень глюкозы в крови, взятой пункцией подъязычной вены, портативным глюкометром (Contour TC Bayer, Германия), и для эксперимента отбирали животных с уровнем гликемии после 6-часовой пищевой депривации от 11 до 19 ммоль/л. Далее крыс распределяли по группам в соответствии с принципом рандомизации, но с равным средним уровнем глюкозы крови в группе (±5%). Животные получали лечение на протяжении 30 дней, перорально. Исследуемое соединение ZВ-16 вводилось крысам один раз в сутки в дозе 1 мг/кг [6]. Препаратом сравнения был выбран метформин (400 мг/кг, per os), как лекарственное средство базисной терапии СД 2 типа [6; 7].
Оценка вазодилатирующей функции эндотелия проводилась через 30 дней после формирования экспериментальных групп (т.е. через 33 дня после моделирования сахарного диабета у животных с хроническим нарушением мозгового кровообращения) посредством измерения скорости мозгового кровотока в проекции средней мозговой артерии после внутривенного введения модификаторов синтеза эндогенного оксида азота - ацетилхолина (0,01 мг/кг) и нитро-L-аргинина в дозе 10 мг/кг [8]. Введение модификаторов синтеза оксида азота осуществлялось после возвращения мозгового кровотока к исходному уровню [8], после чего регистрировали изменение скорости мозгового кровотока и вычисляли его изменение (в %) относительно исходного уровня.
Анализ степени изменения уровня мозгового кровотока при введении ацетилхолина и нитро-L-аргинина позволяет оценить стимулированную и базальную продукцию оксида азота, а также установить степень нарушения вазодилатирующей функции эндотелия [9].
Статистическую обработку результатов исследования проводили посредством программ Microsoft Office Excel 2013 и Prism 6 с предварительной проверкой выборок на нормальность распределения с помощью критерия Шапиро-Уилка. В зависимости от типа данных использовали следующие методы статистического анализа: однофакторный дисперсионный анализ (One-Way ANOVA) либо ранговый однофакторный дисперсионный анализ Краскела-Уоллиса с последующим применением апостериорных критериев – t-критерия Стьюдента с поправкой Бонферрони или критерия Дана. Статистически значимыми расценивались различия при p<0,05 [10; 11].
Результаты исследования и их обсуждение
У животных с сахарным диабетом, стенозом, но в большей мере с комбинированной патологией после введения ацетилхолина регистрировалось минимальное увеличение скорости церебрального кровотока (+15±4%), а после введения нитро-L-аргинина – минимальное снижение (-18±2%), что было значительно меньше интактной группы, в которой изменение мозгового кровотока на введение модификаторов синтеза оксида азота составило +37±4% и -43±5% соответственно (рис. 2). Из чего следует, что у животных со стенозом и в большей степени с сахарным диабетом уменьшалась эндотелийзависимая вазодилатация, но у животных с комбинированной патологией она была еще более выраженной. Данный факт может свидетельствовать о значительном нарушении функционального состояния эндотелия у животных с сахарным диабетом, что очевидно связано со снижением базальной и стимулированной продукции оксида азота.
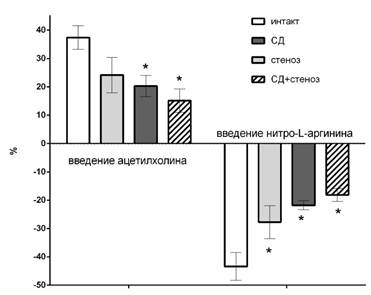
Рис. 2. Выраженность увеличения кровотока на внутривенное введение ацетилхолина и падение кровотока на введение нитро-L-аргинина; * - p<0,05 относительно группы интактных животных
У животных с экспериментальным сахарным диабетом и стенозом общих сонных артерий, которым в течение месяца вводили соединение ZB-16, метформин и особенно их комбинацию, отмечено большее повышение скорости мозгового кровотока на введение ацетилхолина (на 24±2%, 20±4% и 31±4% соответственно) и большее его снижение после введения нитро-L-аргинина (на 25±4%, 26±3% и 37±7% соответственно), что отличается от контрольной группы СД+стеноз на 56% и 39% (для группы «ZB-16»), на 34% и 42% (для группы «метформин») и на 101% и 106% (для группы «ZB-16+метформин») при введении ацетилхолина и нитро-L-аргинина соответственно (рис. 3).
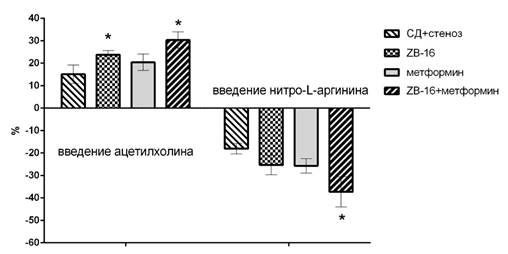
Рис. 3. Выраженность увеличения кровотока на внутривенное введение ацетилхолина и падение кровотока на введение нитро-L-аргинина у животных с сахарным диабетом и хроническим нарушением мозгового кровообращения, получавших противодиабетическую терапию в течение 4 недель; * - р<0,05 относительно группы СД+стеноз
Установлено, что при сахарном диабете ухудшается эндотелийзависимая (NO-опосредованная) вазодилатация: гипергликемия повышает продукцию активных форм кислорода и блокирует активацию эндотелиальной NO-синтазы [12]. В данном исследовании у животных с сахарным диабетом наблюдалось существенное нарушение эндотелийзависимой вазодилатации, причем при комбинировании двух патологий – сахарный диабет и хроническое нарушение мозгового кровообращения – было зафиксировано еще большее ее снижение. Необходимо отметить, что применение метформина в течение 30 дней, который является препаратом первой линии в лечении сахарного диабета 2 типа [7], лишь незначительно влияло на вазодилатирующую функцию эндотелия у животных этой группы. Применение агониста рецептора GPR119 – соединения ZB-16 (дипиарона) – как в монотерапии, но особенно в комбинации с метформином, существенно корректировало нарушенную вазодилатирующую функцию эндотелия у животных с сахарным диабетом и хроническим нарушением мозгового кровообращения. Эти данные согласуются с результатами других исследований [3; 13], в которых показано действие ГПП-1, продукция которого повышается при стимулировании GPR119, на эндотелиальную дисфункцию. Поэтому эндотелиопротективное действие агониста рецептора GPR119 – соединения ZB-16- можно объяснить стимуляцией продукции глюкагон-подобного пептида-1 (ГПП-1). Можно также предполагать, что гипогликемическое действие соединения ZB-16 играет небольшую роль в улучшении вазодилатирующей функции эндотелия. Так, метформин, оказывающий такое же или более выраженное гипогликемическое действие, незначительно увеличивает вазодилатирующую функцию эндотелия, уступая соединению ZB-16.
Заключение
У животных с сахарным диабетом, нарушением мозгового кровообращения и еще в большей степени при их сочетании наблюдается значительное уменьшение реакции на введение ацетилхолина и нитро-L-аргинина, что, очевидно, обусловлено снижением и стимулированной, и базальной продукции оксида азота. Агонист рецептора GPR119 – соединение ZB-16 – как в монотерапии, так и в комбинации с метформином значительно улучшает нарушенную вазодилатирующую функцию эндотелия у животных с хроническим нарушением мозгового кровообращения и экспериментальным сахарным диабетом.
Библиографическая ссылка
Куркин Д.В., Логвинова Е.О., Бакулин Д.А., Волотова Е.В., Тюренков И.Н. ЭНДОТЕЛИОПРОТЕКТОРНЫЕ СВОЙСТВА НОВОГО АГОНИСТА РЕЦЕПТОРА GPR119 (ДИПИАРОН) У ЖИВОТНЫХ С ХРОНИЧЕСКИМ НАРУШЕНИЕМ МОЗГОВОГО КРОВООБРАЩЕНИЯ И ЭКСПЕРИМЕНТАЛЬНЫМ САХАРНЫМ ДИАБЕТОМ // Современные проблемы науки и образования. 2018. № 4. ;URL: https://science-education.ru/ru/article/view?id=27935 (дата обращения: 14.11.2025).



