Одним из лидеров в структуре общих причин смертности являются сердечно-сосудистые заболевания, проблема лечения которых в настоящее время полностью не решена. Согласно докладу Всемирной организации здравоохранения, в 2030 году заболевания сердца и кровеносных сосудов могут стать фатальными для 30 миллионов человек [1, с. 34]. Ишемическая болезнь сердца (ИБС) обладает наибольшим приоритетом среди поражений системы кровообращения атеросклеротического генеза. Атеросклероз встречается в 95% случаях развития ИБС, он характеризуется обширным отложением липидов, солей кальция и фиброзных волокон в интиме коронарных артерий. Вторичная профилактика атеросклероза, и в частности ИБС, основана на применении медикаментозных средств, которые нормализуют уровень липидов в крови. Перспективным классом гиполипидемических средств являются статины, использование которых кардинально изменило подход к профилактике атеросклероза, оттеснив на задний план такие традиционные средства, как никотиновая кислота, ингибиторы абсорбции холестерина, фибраты, анионообменные смолы. Механизм действия статинов связан с подавлением активности ключевого фермента в биосинтезе общего холестерина (ОХ) – 3–гидрокси–3–метилглютарил коэнзим А редуктазы (ГМГ–КоА–редуктазы). Ингибируя синтез эндогенного ОХ, статины инициируют уменьшение фракции холестерина липопротеидов низкой плотности (ХС ЛПНП) из циркулирующей крови, способствуют снижению концентрации триглицеридов (ТГ) и повышению уровня холестерина липопротеидов высокой плотности (ХС ЛПВП) [2, с. 102]. За последние 20 лет было проведено множество многоцентровых клинических исследований, в ходе которых была подтверждена эффективность статинов для снижения сердечно-сосудистой и общей смертности вне зависимости от исходного уровня ОХ [3, с. 10]. Симвастатин – наиболее изученный и хорошо зарекомендовавший себя препарат данного класса. В ходе многочисленных рандомизированных клинических исследований была доказана его эффективность и безопасность. Абсорбция препарата после попадания в пищеварительную систему может достигать 85%. Далее он гидролизуется изоферментами печени (CYP3A4 и CYP3A5), в результате чего превращается в активный метаболит – β-гидроксикислоту и другие неактивные метаболиты [4]. Терапия симвастатином ведет к значительному снижению уровня ОХ, ХС ЛПНП, а также меньшему по значимости снижению уровня ТГ. Препарат хорошо переносится, в том числе и при длительном применении. Частота побочных эффектов не превышает 1-2%, среди которых превалируют диспепсические расстройства (метеоризм, тошнота, боли в животе). Тем не менее не у всех больных применение симвастатина оказывается одинаково эффективным и безопасным. Различия в фармакологическом ответе могут определяться возрастом индивидов, состоянием иммунной системы, образом жизни, принадлежностью к той или иной этнической или гендерной группе, индивидуальными особенностями метаболизма. Генетические факторы являются причиной неблагоприятных фармакологических ответов в 50-90% случаев [5, с. 2].
Исследования, посвященные генетическим полиморфизмам транспортеров, рецепторов и ферментов, встречаются довольно часто, ведь аллельные варианты генов способны оказывать негативное влияние на фармакокинетику и фармакодинамику лекарственного средства.
Organic anion transporting polypeptide 1B1 [OATP1B1 (OATP-C)] – это специализированный белок-переносчик, локализованный на синусоидальной мембране человеческих гепатоцитов (рис. 1). Его роль заключается в переносе амфифильных органических соединений.
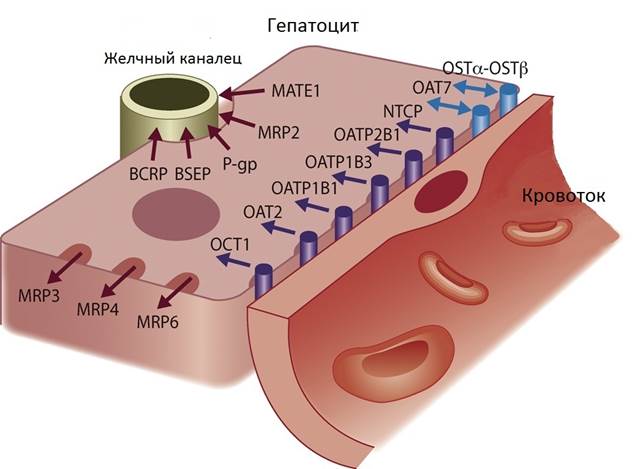
Рис. 1. Транспортеры, расположенные на синусоидальной и каналикулярной мембране гепатоцитов человека [5]
Одним из субстратов данного транспортера является симвастатин [6, с. 161]. OATP1B1 кодируется геном SLCO1B1, который состоит из 15 экзонов и картирован на хромосоме 12p12.2-p12.1 [7, c. 234]. Генетические полиморфизмы и гаплотипы SLCO1B1 могут оказывать клинически значимое влияние на транспортные характеристики OATP1B1. В базу данных dbSNP на настоящий момент внесено более 50 несинонимичных полиморфизмов [8]. О влиянии однонуклеотидных полиморфизмов (ОНП) некодирующей области на транспортную функцию OATP1B1 известно довольно мало. Niemi M. с соавторами предполагают, что полиморфизм g.-11187A>G связан со снижением активности OATP1B1 [9, с. 308]. В недавнем исследовании было показано, что площадь моксифлоксацина под кривой зависимости концентрации от времени (AUC) и максимальная концентрация, достигнутая в плазме крови (Cmax), были значительно увеличены дозой препарата и генотипом варианта g.-11187G>A. Медиана AUC и Cmax моксифлоксацина у 4 пациентов (8%) с генотипом SLCO1B1 g.-11187 AG были выше на 46% и 30% соответственно, чем у 45 пациентов с генотипом g.-11187 GG [10]. Также ОНП g.-11187A>G и *17 SLCO1B1-гаплотип (c.11187A-388G-521C) значительно увеличивают Cmax и AUC питавастатина. Отмечается, что в вариабельности фармакокинетики также большую роль играет пол. Таким образом, пациентам с гиперхолестеринемией, получающим питавастатин, необходим индивидуальный подход в фармакотерапии [11, с. 187].
Исследования, посвященные изучению влияния полиморфизмов промоторной области гена SLCO1B1 на эффективность лечения симвастатином, отсутствуют.
Целью данного исследования явилось выявление влияния ОНП g.-11187A>G гена SLCO1B1 на уровень ОХ, ХС ЛПНП и ТГ у больных ИБС при лечении симвастатином.
Материалы и методы исследования
В исследовании приняло участие 55 человек (25 мужчин и 30 женщин). Средний возраст мужчин составлял 65,8±5,9 года, женщин – 70,6±6,1 года. Нами также учитывался возраст и масса тела пациентов с различными генотипами. Средний возраст носителей генотипа g.-11187GG составлял 68±6,4 года, а средняя масса тела – 81,4±13,9 кг. В то же время средний возраст носителей генотипа g.-11187GA составлял 70,5±6,6 года, а масса тела 81±12,6 кг. Критерии включения для пациентов: возраст старше 60 лет, подтвержденный диагноз ИБС (стенокардия напряжения 1-2 функционального класса), наличие дислипидемии (IIa, IIв, III, IV типов), неэффективность гиполипидемической диеты в течение 3 месяцев. Критерии исключения пациентов из исследования: стабильная стенокардия 3-4 функционального класса; инфаркт миокарда, нестабильная стенокардия, тромбоэмболия лёгочной артерии менее чем за 6 месяцев до обследования, острое нарушение мозгового кровообращения, тяжёлые нарушения функции печени или почек, острые состояния и хронические заболевания в стадии обострения (ожирение более I степени, сахарный диабет 1-го или 2-го типа тяжёлой степени), порфирия, миопатия, гипотиреоз, фракция выброса левого желудочка > 60% по методике Simpson’а, повышенная активность ферментов аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) более 3 верхних пределов норм и злоупотребление алкоголем. Пациентам назначался симвастатин («СимваГЕКСАЛ®», Германия) в дозировке 40 мг/сутки. За день до начала приема симвастатина оценивался уровень ОХ, ТГ, холестерина липопротеидов низкой и высокой плотности. Повторная оценка перечисленных показателей проводилась через 2 месяца после начала приёма препарата [11, c. 48].
Эффективность снижения уровня ОХ, ХС ЛПНП и ТГ определяли путем вычисления разницы между значением этих показателей до и спустя 2 месяца после начала лечения соответствующим препаратом [11, c. 48].
Для генетического анализа использовался образец ДНК, выделенный из венозной крови пациента при помощи стандартного фенол-хлороформного метода. Для проведения последующих этапов молекулярно-генетических исследований использовался специальный набор для идентификации однонуклеотидных полиморфизмов (ООО НПФ «ЛИТЕХ»). Согласно инструкции последовательно проводили реакции амплификации, дефосфорилирования и мини-секвенирования для дальнейшей идентификации полиморфизмов на времяпролетном MALDI-TOF масс-спектрометре [11, c. 49].
В соответствии с Хельсинкской декларацией до начала всех этапов исследования было получено разрешение локального этического комитета при Федеральном государственном бюджетном образовательном учреждении высшего образования «Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого» Министерства здравоохранения Российской Федерации, а также добровольное информированное согласие пациентов на участие в исследовании [11, c. 49].
Статистическую значимость различий показателей до и на фоне терапии оценивали с помощью парного критерия Вилкоксона, а между показателями независимых выборок - по непараметрическому критерию Манна-Уитни. Описание выборки производили с помощью подсчета медианы (Ме) и интерквартильного размаха в виде 25 и 75 процентилей (Q1 и Q3), для возраста и массы тела, соответствующих критериям нормального распределения, использовались среднее (M) и его стандартное отклонение (SD). Соответствие частот генотипов равновесию Харди-Вайнберга оценивали по критерию хи-квадрат. Частоты генотипов при χ2 < 3,84 соответствуют равновесию Харди-Вайнберга [11, c. 49]. Статистически значимыми считали различия при р < 0,05.
Результаты исследования и их обсуждение
Генотип SLCO1B1 g.-11187GG выявлен у 83,6% участников исследования (N=46), а g.-11187GA – у 16,4% (N=9). По распределению Харди-Вайнберга ожидаемые частоты будут таковыми: g.-11187GG – 84,3%, g.-11187GA – 15% и g.-11187АA – 0,7%. Значение χ2 = 0,44, что свидетельствует о высокой степени соответствия полученных данных распределению Харди-Вайнберга (табл. 1). Таким образом, полиморфный вариант g.-11187A>G обладает низким уровнем полиморфизма, что согласуется с полученными частотами в других популяциях [12].
Таблица 1
Соответствие частот аллелей полиморфизма g.-11187A>G гена SLCO1B1 равновесию Харди-Вайнберга
|
Ген |
Генотип |
Наблюдаемая частота, % |
Ожидаемая частота, % |
Частота аллеля |
χ2 (df=2) |
P |
|
|
T |
C |
||||||
|
SLCO1B1 |
TT |
83,6 |
84,3 |
0,92 |
0,08 |
0,44 |
0,5 |
|
TC |
16,4 |
15 |
|||||
|
CC |
0 |
0,7 |
|||||
Примечание: df = 2- степень свободы для анализа частот генотипов, χ2 – хи-квадрат, P – уровень значимости различий (уровень соответствия равновесию Харди-Вайнберга).
Согласно полученным данным, при приеме препарата статистически значимо уменьшался уровень ОХ, ХС ЛПНП и ТГ в группе носителей нормальной гомозиготы (p<0,001 по критерию Вилкоксона), а также уровень ОХ, ХС ЛПНП у носителей гетерозиготы (p>0,05 по критерию Вилкоксона). В то же время не было обнаружено статистически значимого снижения уровня ТГ у носителей гетерозиготы.
Снижение уровня ОХ было менее выражено у носителей гетерозиготы, чем у носителей нормальной гомозиготы. При этом уровень ОХ снижался на 1,17 (0,19;1,95) ммоль/л у носителей g.-11187GA генотипа, а у носителей g.-11187GG генотипа - на 1,91 (0,96;2,47) ммоль/л (p < 0,05 по критерию Манна-Уитни). Таким образом, эффективность снижения уровня ОХ была выше на 38,7% у носителей нормального генотипа, чем у индивидов с гетерозиготным генотипом (рис. 2).
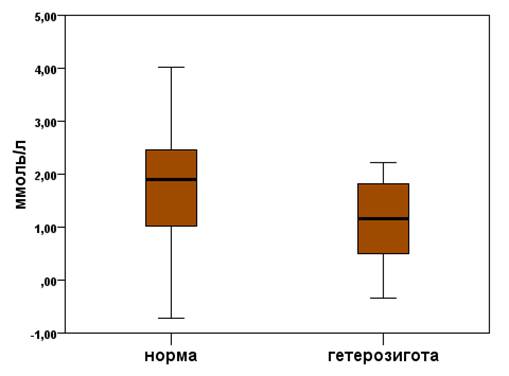
Рис. 2. Снижение уровня ОХ (ммоль/л) при лечении симвастатином в дозировке 40 мг/сутки в зависимости от генотипа SLCO1B1 (p<0,05)
Не было выявлено влияния полиморфизма гена SLCO1B1 на изменчивость уровня ТГ. Снижение уровня ХС ЛПНП было также более значительно у пациентов с генотипом g.-11187GG, чем у пациентов с генотипом g.-11187GA, но полученные результаты были статистически незначимы (табл. 2). Также стоит отметить, что в нашем исследовании не было обнаружено существенных различий в эффективности лечения между генотипами GG и GA в группах мужчин и женщин.
Таблица 2
Эффективность снижения ОХ, ХС ЛПНП и ТГ за 2 месяца лечения симвастатином в дозировке 40 мг/сутки в зависимости от генотипа SLCO1B1
|
Параметр |
Генотип SLCO1B1 |
P |
|
|
g.-11187GG |
g.-11187GA |
||
|
Me (Q1;Q3) |
Me (Q1;Q3) |
||
|
ОХ |
1,91 (0,96;2,47) |
1,17 (0,19;1,95) |
<0,05 |
|
ХС ЛПНП |
1,76 (0,86;2,26) |
1,32 (0,01;1,89) |
>0,05 |
|
ТГ |
0,22 (0,08;0,54) |
0,22 (0,11;1,2) |
>0,05 |
Примечание: P – уровень значимости различий, ОХ – снижение общего холестерина сыворотки крови в ммоль/л, ХС ЛПНП – снижение холестерина липопротеидов низкой плотности в ммоль/л, ТГ – снижение триглицеридов в ммоль/л, Ме – медиана, Q1 - 25 процентиль, Q3 – 75 процентиль.
Заключение
Данные исследования предполагают участие полиморфного варианта g.-11187A>G гена SLCO1B1 в изменчивости уровня ОХ при лечении симвастатином у пациентов, страдающих ИБС. У больных с гетерозиготным генотипом наблюдали менее выраженное снижение уровня ОХ по сравнению с индивидами с гомозиготным генотипом GG. Однако настоящее исследование имеет ряд ограничений, включая небольшой размер исследуемой группы, использование иных препаратов при лечении, поэтому необходимо дальнейшее изучение роли указанного полиморфизма в эффективности терапии симвастатином.
Библиографическая ссылка
Покровский А.А., Котловский М.Ю., Титова Н.М. ВЛИЯНИЕ ПОЛИМОРФИЗМА G.-11187A>G ГЕНА SLCO1B1 НА ТЕРАПИЮ СИМВАСТАТИНОМ У ПАЦИЕНТОВ С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА // Современные проблемы науки и образования. – 2021. – № 5. ;URL: https://science-education.ru/ru/article/view?id=31172 (дата обращения: 12.05.2024).



