Стремительное развитие технологий в магнитно-резонансной томографии позволило внедрить в практику новые методики количественной оценки морфологических особенностей сердца.
Время Т1-релаксации является фундаментальным свойством ткани спин-решеточного эха, которое можно измерить в миокарде с использованием последовательностей T1-картирования миокарда [1]. Это обычно представлено в виде карты сердца с цветовой кодировкой. Данные карты чаще всего получают из серии T1-взвешенных изображений, с выборкой кривых T1-релаксации после одного или нескольких начальных подготовительных импульсов [2].
Результаты исследований МРТ сердца демонстрируют, что нативное время T1-релаксации удлиняется с расширением интерстициальной ткани, вызванным отеком, инфарктом, инфильтрацией амилоида и фиброзом. И наоборот, время T1-релаксации укорачивается при накоплении жира и железа. Поэтому нативный сигнал Т1 миокарда левого желудочка интересующей области на карте Т1-картирования может служить в качестве простого неинвазивного фактора определения состояния миокарда [1; 3; 4].
МРТ-сигнал Т1-взвешенных изображений (Т1-ВИ) при отсроченном контрастировании с использованием парамагнитного контрастного вещества также составляет основу визуализации сердца. Отсроченное контрастирование позволяет визуализировать очаговый рубец и фиброз как при ишемических заболеваниях сердца, так и при неишемических кардиомиопатиях [3; 5].
При T1-картировании производится измерение времени T1-релаксациии при нативном исследовании, а также после введения парамагнитного контрастного вещества, изолированно или через коэффициент разделения к измерению фракции внеклеточного объема (ECV) [5]. Эти данные позволяют раньше диагностировать и количественно оценить очаговое, а также диффузное поражение миокарда [2].
Физические основы методики T1-картирования
Методика T1-картирования состоит из импульса преднасыщения намагниченности T1, получения (считывания) одного изображения после интервальной задержки, а также повторения данных действий для получения кривой восстановления продольной намагниченности. Затем исходные изображения реконструируются путем постобработки в единую T1-карту с использованием теоретической модели ожидаемой интенсивности сигнала и с помощью различных обработок, таких как компенсация дыхательного движения [5].
Основная концепция, лежащая в основе использования T1-картирования для характеристики ткани миокарда, заключается в том, что T1-время релаксации миокарда обладает дискретными тканевыми нормальными диапазонами, указанными в миллисекундах.
Следовательно, любое отклонение T1 миокарда от нормального диапазона должно характеризовать измененный миокард в вокселе.
T1-карта представляет собой двумерное (обычно ярко окрашенное) изображение среза, в котором каждый пиксель изображения отображает время T1-релаксации (мс) с дальнейшим использованием цветовой шкалы для облегчения визуальной оценки (рис. 1) [6; 7].
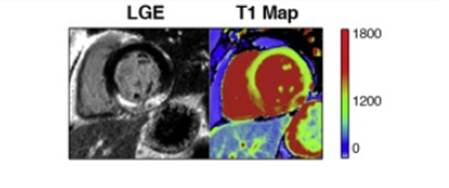
Рис. 1. Цветовая Т1-карта (правое изображение)
Для получения совместно зарегистрированных изображений для подбора кривой и количественного определения T1-релаксации с пространственным разрешением необходима регистрация сигнала в идентичные периоды сердечного цикла. Поэтому при объединении необработанных изображений могут возникать артефакты из-за вариабельности RR-интервала при нарушениях ритма, неправильной синхронизации, чрезмерного движения диафрагмы во время выполнения дыхательных команд. Для того чтобы избежать ошибок регистрации и артефактов, разработаны автоматические алгоритмы регистрации, которые могут корректировать положение исходных изображений, а также даются рекомендации по сбору данных для минимизации других потенциальных источников ошибок в последовательностях и планировании сканирования [8; 9].
Например, необходимо стремиться минимизировать эффекты частичного объема за счет оптимальной ориентации среза относительно ткани, которая ортогональна плоскости изображения, чтобы свести к минимуму наклон. Должна быть обеспечена правильная регулировка шиммирования, а также центральной частоты, чтобы минимизировать артефакты искажения [10].
Типичный протокол сканирования представлен в совместном заключении SCMR (Society for Cardiovascular Magnetic Resonance) от 2013 года [11]. При T1-картировании используются различные подходы с определенными названиями. При первоначальной последовательности Look-Locker, разработанной в 1970-х годах используется несколько импульсов восстановления инверсии с различными временами инверсии, с последующей генерацией 20 различных T1-ВИ [12].
Инвертирующий импульс инвертировал суммарную намагниченность на 180°, после чего следовали несколько импульсов считывания, чередовавшихся с периодами восстановления продольной намагниченности. Однако, поскольку кривая релаксации неоднократно «возмущалась» радиочастотными импульсами считывающего изображения, была оценена «мнимая» T1- (T1*), и это потребовало дополнительной коррекции для измерения времени релаксации [13].
Первоначальный Look-Locker был непрактичным для создания T1-карт, поскольку сбор данных, продолжавшийся 20 минут, охватывал несколько фаз сердечного цикла [12]. Использование нового однократного считывания сбалансированного установившегося состояния свободной прецессии (SSFP) во время диастолы [14] позволило улучшить соотношение сигнал/шум и эффективность, внутреннюю компенсацию потока [5] и, следовательно, разработку первого модифицированного метода Look-Locker с инверсией восстановления (Modified Look-Locker Inversion Recovery – MOLLI) [7], который заключается в одной задержке дыхания на 17 ударов сердца [15].
Новые варианты методики MOLLI манипулируют предимпульсами и паузами между ними. Например, исходные MOLLI использовали протокол 3 (36) 3 (36) 5, где число вне скобок указывает на количество изображений, полученных после импульса преднасыщения, а число в скобках указывает на продолжительность паузы, определяемой либо числом импульсов восстановления, либо числом секунд. Считывание в сбалансированном режиме в состоянии устоявшейся свободной прецессии (b-SSFP) MOLLI также оценивает «мнимый» T1 (T1*), на который влияют высокочастотные импульсы изображения, поэтому для его корректировки и получения более точной оценки T1 все еще требуется коррекция Look-Locker. Подсчет периодов покоя в секундах вместо количества импульсов восстановления делает последовательности более независимыми от частоты пульса [14]. На рисунке 2 изображены получаемые изображения при модификации MOLLI с указанием морфологических структур, используемых для подсчета данных.
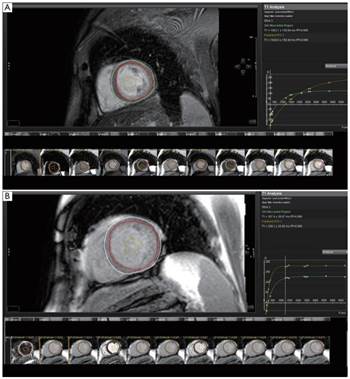
Рис. 2. Последовательность MOLLI: преконтрастные изображения (A) и постконтрастные изображения (B). T1-карты срединных отделов левого желудочка в короткой оси с эпикардом (белый кружок), эндокард (большой красный кружок) и пул крови (маленький красный кружок). Экспоненциальная кривая восстановления интенсивности сигналов в разное время инверсии (TI) определяет значения T1 миокарда (зеленая линия) и пула крови (красная линия), которые затем можно использовать (с гематокритом) для определения внеклеточного объема
Другой подход, укороченный (short) MOLLI [16] (ShMOLLI), использует схему 5 (16) 1 (16) 1 для получения изображений за 9 ударов сердца, что делает его более подходящим для пациентов с одышкой [14; 17]. Однако результирующий набор данных является более разреженным, а паузы в одно сокращение сердца недостаточны для обеспечения совместимости с теоретической моделью, используемой в последующей оценке T1, для больших значений T1 [5]. Следовательно, укороченный MOLLI (ShMOLLI) использует алгоритм условной «подгонки», который включает последние два захвата изображения в процедуру подбора кривой только когда T1 стремится к меньшему значению [5]. Применяется такая же коррекция Look-Locker, что и для MOLLI.
Восстановление насыщения с помощью одного снимка (Saturation Recovery Single SHot Acquisition - SASHA) использует принцип восстановления насыщения вместо инверсии. Дефазирование всего объема изображения приводит к истощению всей намагниченности, уменьшая необходимость в любых периодах восстановления/релаксации. Поскольку после каждой подготовки намагничивания получается только одно изображение, коррекция Look-Locker не требуется, и T1 можно оценить непосредственно из подгонки кривой по пикселям [5].
В отличие от MOLLI, восстановление насыщения с помощью одного снимка (SAturation Recovery Single SHot - SASHA) не демонстрирует зависимости от ЧСС [15], но может быть менее точным из-за уменьшенного динамического диапазона (90° против 180°). Восстановление насыщения с помощью одного снимка (SASHA) получает 10 изображений за 10 ударов сердца, причем исходное изображение не имеет подготовки к насыщению [16]. Последовательность восстановления инверсии, не зависящей от частоты сердечных сокращений (SAturation Pulse Prepared Heart-Rate Independent Inversion REcovery Sequence SAPPHIRE), использует гибридную комбинацию импульсов инверсии и насыщения, которая увеличивает динамический диапазон (гибрид MOLLI и SASHA, пытаясь получить лучшее из обоих методов).
Определение объема внеклеточной жидкости (ECV extracellular volume)
В миокарде рассматривают две составляющие: «внутриклеточный объем» (ICV, 1 - ECV), в котором преобладают миоциты, но присутствуют и другие клетки (фибробласты, циркулирующие эритроциты и т. д.); и «внеклеточный объем» (ECV), в котором преобладает жидкость, связанная с внеклеточным матриксом, включающая внутрикапиллярный объем плазмы [11]. Нормальное значение объема внеклеточной жидкости для здорового миокарда составляет около 25,3 ± 3,5% [18]. Это намного больше, чем, например, в скелетных мышцах, где фракция внеклеточного объема может составлять 10% - миокард имеет намного больше коллагена. Определение объема внеклеточной жидкости производится по уравнению 1.
Различные патологические процессы могут изменять фракцию внеклеточного объема (ECV) и объема внутриклеточной жидкости (ICV). Фракция внеклеточного объема может увеличиваться при фиброзе, отеке или отложении другого белка (амилоида) или их комбинации. Однако повышенная плотность капилляров или вазодилатация также могут увеличивать объем внеклеточной жидкости, хотя и в меньшей степени [18]. Следовательно, изолированные возникающие изменения объема внеклеточной жидкости требуют интерпретации.
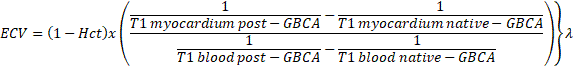
Уравнение 1. Определение объема внеклеточной жидкости. ECV – объем внеклеточной жидкости; Hct – гематокрит; GBCA – постконтрастные изображения; native – нативное изображение; myocardium – миокард; blood – кровь.
Принципы определения нормальных диапазонов значения T1 и фракции внеклеточного объема миокарда
Определение нормальных диапазонов важно для интерпретации измеренных значений нативного T1 и фракции внеклеточного объема миокарда. Нормальные диапазоны T1 и фракции внеклеточного объема миокарда зависят от напряженности магнитного поля, последовательности картирования, параметров протокола и стратегии оценки.
Следовательно, в настоящее время считается оптимальным определять характерные для данной локализации нативные нормальные значения T1 и фракции внеклеточного объема минимум от 15, а в идеале от 50 или более здоровых добровольцев [19], а также сообщать индивидуальные значения нативного T1 и фракции внеклеточного объема миокарда вместе с нормальными диапазонами и z-показателями для лучшей сопоставимости и интерпретации значений.
Нормальные расчётные данные нативного T1 и фракции внеклеточного объема демонстрируют незначительную зависимость от сегментов миокарда левого желудочка.
Величины апикального нативного T1 и фракции внеклеточного объема имеют тенденцию к незначительному увеличению по сравнению со значениями в базальной и срединной областях желудочков [20]; это можно сразу понять по увеличению среднего парциального объема в апикальной области, так что, в частности, оправдана оценка репрезентативных нормальных значений на изображениях срединной (и базальной) части желудочка по короткой оси.
Обычно чуть более выраженное уменьшение нормального времени нативного T1 и в меньшей степени фракции внеклеточного объема от перегородки до боковой стенки левого желудочка [20] интерпретируется как чисто искусственный вне-резонансный эффект [10; 21]. Эти градиенты, однако, предполагают, что сравнения с нормальными оценками нативного T1 и фракции внеклеточного объема предпочтительно проводить на основе сопоставления ROI (region of interest – область интереса) обследуемых участков.
Когда это присутствует, зависимость нормальных нативных значений T1 и фракции внеклеточного объема от возраста и пола является незначительной. Однако было выявлено, что значения T1 и фракции внеклеточного объема у женщин имеют тенденцию превышать соответствующие значения у мужчин. Исследование наличия гендерной зависимости возрастных изменений нормальных оценок нативного T1 и фракции внеклеточного объема привело к противоречивым результатам [22].
Поскольку миокард содержит кровь, изменения существенно варьирующего времени нативного T1 крови должны изменять естественное время T1 миокарда. В различных исследованиях сообщается о корреляции между кровью и временем нативного T1 миокарда у здоровых людей [20]. Наклоны соответствующих линий регрессии могут быть использованы для нормализации значений нативного Т1 миокарда к общему времени Т1 крови, что приводит к сокращению разброса нормальных диапазонов нативного Т1 миокарда [20].
Заключение
Понимание физических основ картирования, принципов построения Т1-карт, видов методик сбора данных, их особенностей при МРТ сердца, а также знание нормальных значений времени Т1 и фракции внеклеточного объема жидкости позволяют включать данные исследования в клиническую практику при обследовании пациентов с патологией сердца. Т1-картирование является неинвазивной методикой, применение которой позволяет точно оценить количественные параметры морфологических особенностей миокарда, а также проводить количественную оценку тканевых характеристик в динамике развития патологических состояний миокарда.
Список сокращений
МРТ – Магнитно-резонансная томография
MOLLI – Modified Look-Locker Inversion Recovery MOLLI / Модифицированный метод Look-Locker с инверсией восстановления
ShMOLLI – Short Modified Look-Locker Inversion Recovery / Укороченный модифицированный метод Look-Locker с инверсией восстановления
SASHA – Saturation Recovery Single SHot Acquisition / Восстановление насыщения с помощью одного снимка
SAPPHIRE – SAturation Pulse Prepared Heart-Rate Independent Inversion REcovery Sequence / Последовательность восстановления инверсии, не зависящей от частоты сердечных сокращений
Hct – гематокрит
GBCA – Gadolinium-Based Contrast Agent / Контрастное вещество на основе гадолиния
ECV – Extracellular Volume / Внеклеточный объем
SSFP - Steady-State Free Precession / Свободная прецессия в установившемся состоянии
Библиографическая ссылка
Баев М.С., Труфанов Г.Е., Рыжков А.В., Анпилогова К.С. Т1-КАРТИРОВАНИЕ МИОКАРДА: ФИЗИЧЕСКИЕ ОСНОВЫ И ОБЩИЕ ВОПРОСЫ ПРИМЕНЕНИЯ // Современные проблемы науки и образования. – 2021. – № 6. ;URL: https://science-education.ru/ru/article/view?id=31235 (дата обращения: 13.05.2024).



