Лечение гнойно-воспалительного процесса по сей день остается одной из важных и актуальных проблем в практическом здравоохранении. В структуре хирургической патологии гнойные раны составляют от 15 до 62% среди всех заболеваний [1; 2]. Связано это с появлением резистентности патогенных микроорганизмов к уже имеющимся препаратам ввиду их частого бесконтрольного применения [3; 4]. Хирургическая обработка ран и медикаментозная терапия являются взаимодополняющими методами, поэтому тактика ведения пациентов, основанная на применении местных перевязочных средств, до сих пор является практически безальтернативным методом лечения [5; 6].
Применение местных раневых покрытий (мазей, пленок, губок) не вызывает трудностей в использовании как в стационаре, так и на амбулаторном этапе лечения. Большинство препаратов, применяемых в местной терапии гнойных ран, имеет жировую основу, а значит, они гидрофобны и не способны смешиваться с экссудатом [7].
Таким образом, необходим поиск оптимальной основы для иммобилизации лекарственных препаратов для того, чтобы полученная комбинация могла обладать высокой сорбционной активностью и легко удаляться, не травмируя подлежащие ткани [8]. Такими основами могут послужить полиэтиленоксид и метилцеллюлоза, обладающие гидрофильными свойствами [7].
Цель работы – выявление особенностей течения раневого процесса при использовании гидрофильных препаратов с гексэтидином.
Материалы и методы исследования. C целью определения спектра антимикробной активности к таким микроорганизмам, как Candida albicans ATCC 885-653, Escherichia coli ATCC 25922, Bacillus cereus ATCC 10702, Bacillus Subtilis ATCC 6633, Staphylococcus aureus ATCC 6538-P и Proteus vulgaris, до экспериментального исследования на животных, был проведен этап исследования in vitro.
Второй этап работы, выполненный in vivo, включал в себя экспериментальное исследование на 108 лабораторных крысах, находящихся в стандартных условиях вивария (эксперимент был выполнен на базе лаборатории экспериментальной хирургии и онкологии НИИ экспериментальной медицины КГМУ). По методике П.И. Толстых [9], у каждого экспериментального животного была сформирована модель гнойной раны площадью 150 мм2 (проведение эксперимента с лабораторными животными одобрено региональным этическим комитетом КГМУ, протокол № 7 от 30 ноября 2018 г.). Животные были распределены на 3 равные группы, по 36 крыс в каждой, в зависимости от проводимого лечения: 1) сравнения (ГС) – официнальный препарат диоксометилтетрагидропиримидиновая мазь с хлорамфениколом («Левомеколь», АО «Нижфарм»); 2) первая – гексэтидин (Г) 0,5 г, иммобилизованный на полиэтиленоксиде (ПЭОГ) 99,5 г; 3) вторая – Г 0,5 г, иммобилизованный на метилцеллюлозе (МЦГ) 2 г, вода очищенная 97,5 г. Состав экспериментальных мазей разработан коллективом авторов кафедры оперативной хирургии и топографической анатомии им. профессора А.Д. Мясникова и кафедры фармацевтической технологии Курского государственного медицинского университета. В каждой группе проводились ежедневные перевязки с исследуемым составом в течение 14 дней.
Используя метод стандартных дисков на плотной питательной среде, оценили антимикробную активность. Планиметрическое исследование, позволяющее определить уменьшение площади раны, выраженное в процентах (ПУП), и скорость ее заживления (СЗ), было проведено по методике Л.Н. Поповой [9].
С целью изучения степени обсемененности раны, посредством подсчета выросших колоний, проводили посев суспензированного участка раны на питательную среду (в основе данной манипуляции лежал газонный метод посева).
Для морфологического исследования иссекали участок раневой поверхности размером 1,0 х 1,5 см, фиксировали в формалине и заливали в парафин по стандартной методике. Далее изготавливали гистологические срезы толщиной 7-8 мкм, которые окрашивали гематоксилином и эозином (Г+Э), по методу Ван Гизона. Полученные микропрепараты изучали с использованием микроскопа Levenhuk C320. Все необходимые показатели фиксировали на шести сроках наблюдения (на 1, 3, 5, 8, 10, 15-е сутки эксперимента), основываясь на литературных данных.
Результаты были обработаны статистически с помощью программ Microsoft Excel и Statistica 13: вычисляли медиану, 25 и 75 перцентили (Ме (25;75)). Достоверность оценивали с использованием Kruskal-Wallis test с последующим сравнением средних рангов по группам. Различия считали статистически достоверными при p<0,05.
Результаты исследования и их обсуждение. Проведенное на первом этапе изучение зон задержки роста (табл. 1) позволило сделать заключение о сопоставимости по спектру антимикробной активности разработанных экспериментальных комбинаций с официнальным препаратом. Экспериментальные препараты включали в себя антисептик, при этом они проявили себя не хуже, чем официнальный препарат, содержащий в своем составе антибиотик. Несмотря на то что в отношении некоторых патогенных штаммов их активность была достоверно меньше, в отношении золотистого стафилококка, как наиболее часто вызывающего гнойно-воспалительный процесс, МЦГ не уступила группе сравнения. При этом обе группы показали высокие результаты в отношении всех исследуемых микроорганизмов.
Таблица 1
Зона задержки роста в мм, n=6, Ме (25; 75)
|
Патогенный микроорганизм |
ГС |
ПЭОГ |
МЦГ |
|
Candida albicans |
9,5 (9; 10,8) |
21 (20,3; 21,8) # |
15,5 (15; 16) |
|
Escherichia coli |
23,5 (23; 23,8) |
20,5 (19,3; 21) |
15,5 (14,3; 16,8) # |
|
Bacillus cereus |
21 (21; 21,8) |
19 (18,3; 19,8) |
16,5 (15,3; 19,3) # |
|
Bacillus Subtilis |
20,5 (19,3; 21,8) |
20 (19,3; 20,8) |
18,5 (17,3; 19,8) |
|
Staphylococcus aureus |
21,5 (20,3; 22,8) |
15 (15; 15,8) # |
18,5 (18; 19) |
|
Proteus vulgaris |
23 (22,3; 23,8) |
18,5 (18; 19) # |
20,5 (19,3; 22,5) |
Примечание: # – p<0,05 при сравнении ГС с ПЭОГ и МЦГ. При сравнении групп ПЭОГ и МЦГ между собой статистически значимых различий не выявлено.
Результаты планиметрических исследований представлены на рисунках 1 и 2. Анализируя полученные данные, можно заключить, что в группе МЦГ наблюдались достоверные отличия от показателей группы сравнения на всех сроках лечения, более того, во второй фазе раневого процесса данная комбинация показала наибольшую активность. Комбинация ПЭОГ, в свою очередь, вызвала увеличение площади моделируемой раны к 3-м суткам, при этом к 15-м суткам не наблюдалось достоверных отличий от МЦГ, что говорит о высокой СЗ во вторую фазу. Максимальная СЗ разработанных нами комбинаций пришлась на 8-10-е сутки.
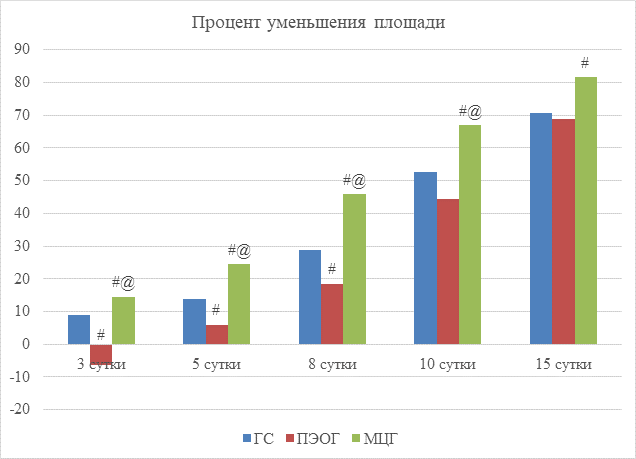
Рис. 1. Процент уменьшения площади раны
Примечание: # – p<0,05 при сравнении ГС с ПЭОГ и МЦГ; @ – p<0,05 при сравнении ПЭОГ и МЦГ
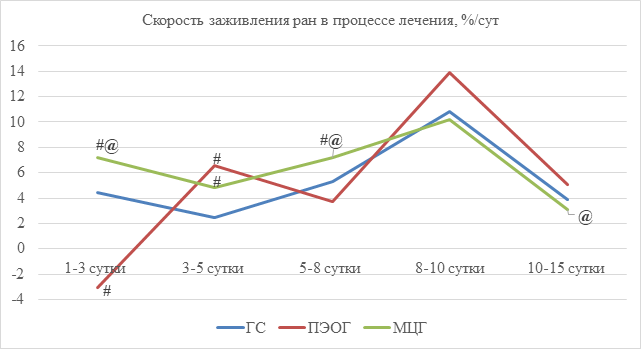
Рис. 2. Скорость заживления ран в процессе лечения, %/сут.
Примечание: # – p<0,05 при сравнении ГС с ПЭОГ и МЦГ; @ – p<0,05 при сравнении ПЭОГ и МЦГ
Из таблицы 2 следует, что обсемененность ран на первые сутки у всех экспериментальных животных составила около 6,2 х 107КОЕ/г, в последующем во всех группах в процессе лечения происходило снижение обсемененности ран. В группе ПЭОГ не наблюдалось достоверных отличий от группы сравнения до 15 суток, где показатель обсемененность в разработанной комбинации был в 9,2 раза больше по сравнению с официнальным препаратом. При сравнении ПЭОГ и МЦГ на 3, 5 и 8-е сутки обсеменённость раны была достоверно меньше в МЦГ в 69, 63 и 93 раза соответственно, чем в ПЭОГ.
Таблица 2
Динамика микробной обсемененности ран КОЕ/г, n=6, Ме (25; 75)
|
Срок наблюдения |
ГС |
ПЭОГ |
МЦГ |
|
Первые сутки |
6,2 (6; 6,5) х107 |
6,4 (6,1; 6,5) х107 |
6,4 (6,2; 6,6) х107 |
|
Третьи сутки |
2,1 (1,9; 2,2) х107 |
4,9 (4,7; 5,1) х106 |
1,2 (1,1; 1,2) х107 |
|
Пятые сутки |
2,1 (1,9; 2,1) х106 |
2,9 (2,6; 3,1) х106 |
4,2 (4,1; 4,2) х104 @ |
|
Восьмые сутки |
1,8 (1,6; 1,8) х105 |
2,6 (2,5; 2,7) х106 |
4,1 (3,9; 4,2) х104 @ |
|
Десятые сутки |
4,5 (4,3; 4,7) х104 |
2,6 (2,2; 2,9) х106 |
2,8 (2,6; 3) х104 @ |
|
Пятнадцатые сутки |
2,5 (2,4; 2,6) х103 |
2,3 (2,1; 2,4) х104 # |
1,1 (1; 1,2) х103 |
Примечание: # – p<0,05 при сравнении ГС с ПЭОГ и МЦГ; @ – p<0,05 при сравнении ПЭОГ и МЦГ.
При анализе микрофотографий срезов гнойной раны (рис. 3) было выявлено, что в группе сравнения в области рубцовой, вновь образованной ткани преобладает волокнистый компонент, при этом волокна тонкие и недостаточно зрелые. При сравнении ПЭОГ и МЦГ, во второй группе почти вся рана покрыта эпидермисом, а также визуализируются новообразованные капилляры, в отличие от группы ПЭОГ, в которой поверх эпидермиса располагаются лейкоциты в стадии распада и не наблюдается процесс неоваскулогенеза.
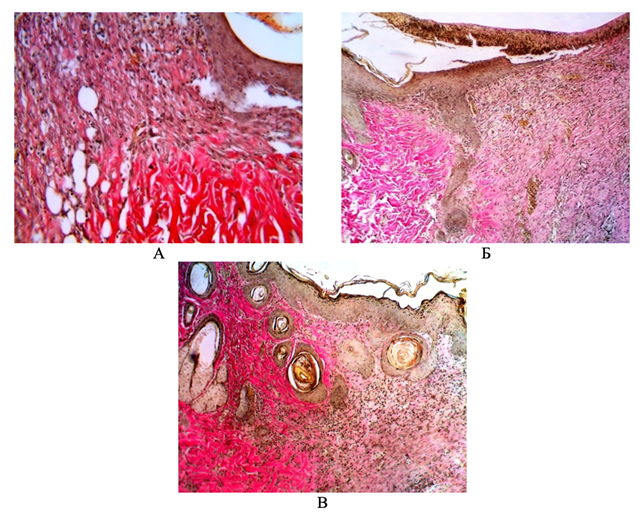
Рис. 3. Микрофотография среза кожи в области раневого дефекта на 10-е сутки эксперимента у животных: А – группы сравнения, Б – ПЭОГ, В – МЦГ.
Окрашено Г+Э, по методу Ван Гизона. Ув. Х200
Заключение
Исходя из полученных данных в ходе экспериментального исследования in vitro, можно утверждать, что разработанные нами комбинации с антисептиком гексэтидином обладают широким спектром антибактериальной и противогрибковой активности в отношении наиболее распространенных патогенных микроорганизмов, не уступающие по своей силе официнальному препарату, содержащему в своем составе антибиотик.
Однако в эксперименте in vivo гексэтидин, иммобилизованный на метилцеллюлозе, при планиметрическом исследовании показал наиболее стабильные результаты на всех наблюдаемых сроках по сравнению со второй группой (ПЭОГ), в которой наблюдалось увеличение площади ран в первую фазу течения раневого процесса. При этом к 15-м суткам не наблюдалось достоверных различий между экспериментальными группами. Комбинацию МЦГ можно рекомендовать для лечения при гнойных ранах как в первой, так и во второй фазе. Данные морфологического исследования подтверждают эффективность лечения гнойной раны при использовании гексэтидина, иммобилизованного на метилцеллюлозе, о чём говорит раннее появление грануляций, эпителизация раневой поверхности, а также ускорение процесса неоваскулогенеза, в отличие от ПЭОГ и группы сравнения.
Таким образом, результаты настоящего исследования позволяют рекомендовать комбинации с гексэтидином для дальнейшего изучения в доклинических и клинических исследованиях в аспекте улучшения результатов местного лечения гнойных ран.
Библиографическая ссылка
Зотов Д.С., Григорьян А.Ю., Затолокина М.А., Жиляева Л.В., Панкрушева Т.А., Чекмарева М.С., Григорьев Н.Н., Бондарев Г.А. ОБОСНОВАНИЕ ВЫБОРА ГИДРОФИЛЬНОЙ ОСНОВЫ ДЛЯ ИММОБИЛИЗАЦИИ ГЕКСЭТИДИНА ДЛЯ ЛЕЧЕНИЯ ГНОЙНЫХ РАН // Современные проблемы науки и образования. – 2022. – № 3. ;URL: https://science-education.ru/ru/article/view?id=31710 (дата обращения: 11.05.2024).



