По мере того как пациенты продолжают жить дольше после инфаркта миокарда, распространенность постинфарктной сердечной недостаточности имеет тенденцию к росту.Современная кардиология располагает значительным арсеналом средств оценки раннего и отдаленного прогноза после перенесенного инфаркта миокарда, которая оценивается по показателям нагрузочных тестов, суточного мониторирования, ЭКГ, эхокардиографии, вариабельности сердечного ритма, дисперсии Q-T и других методов. Неблагоприятное ремоделирование левого желудочка (ЛЖ) начинается у некоторых пациентов с инфарктом миокарда (ИМ) даже после чрескожного коронарного вмешательства (ЧКВ), и, согласно предыдущим исследованиям, частота составляет около 30–35% [1, 2, 3]. Однако имеются исследования, в которых гипертрофия левого желудочка (ЛЖ) рассматривается как сложный процесс, который предсказывает неблагоприятные сердечно-сосудистые исходы и не обязательно может рассматриваться как адаптивный ответ на системную гипертензию. Кроме того, данные недавних исследований свидетельствуют о том, что переход от концентрической гипертрофии ЛЖ к дилатации и систолической дисфункции не является распространенным явлением, особенно при отсутствии ишемической болезни сердца [4]. Согласно современным представлениям, ремоделирование сердца включает молекулярные, клеточные и интерстициальные изменения, возникающие в миокарде, которые отражаются в изменении линейно-объемных размеров сердца [5]. В течении инфаркта миокарда эксперты международных кардиологических сообществ выделяют три периода: развивающийся ИМ (6 часов после появления симптоматики), ИМ (от 6 часов до 7 суток), рубцующийся ИМ (от 7 до 28 суток), заживший ИМ (начинается с 29-х суток) [6]. Постинфарктное ремоделирование делится на раннюю и позднюю фазы [7, 8]. При этом ремоделирование сопровождается изменениями структуры и геометрии ЛЖ [9]. Растяжение инфарктной зоны, как правило, заканчивается с формированием зоны рубца, продолжительность данной фазы составляет около 5–6 недель [10]. В большинстве исследований выявлена связь между выраженностью ремоделирования ЛЖ и пиковым уровнем повышения креатининфосфокиназы-МВ, изначальным конечно-диастолическим объемом и индексом нарушения локальной сократимости в зоне некроза [11]. Методы лечения, которые предотвращают неблагоприятное ремоделирование ЛЖ и стимулируют обратное ремоделирование в постинфарктном периоде, включают раннюю реваскуляризацию, фармакотерапию, направленную на нейрогормональную блокаду, и аппаратную терапию, направленную на устранение дисинхронии желудочков [12]. У пациентов с инфарктом миокарда гибель части функционирующего миокарда ЛЖ запускает патологические изменения сердца, выражающиеся в изменении его размеров, геометрии и функции [13–15]. У одних пациентов исход ремоделирования заключался в стабилизации размеров и функций ЛЖ, что связано с благоприятным сердечным прогнозом. У другой группы пациентов ремоделирование переходит в дальнейшее прогрессирование, что выражается в гемодинамически значимом увеличении ЛЖ и снижении его сократительной способности [16].
Цель исследования: оценить структурно-функциональное состояние миокарда у пациентов, перенесших инфаркт, с учетом предшествующей терапии по профилактике сердечно-сосудистых заболеваний в гендерном аспекте.
Материалы и методы исследования. Исследованы 103 пациента с инфарктом миокарда, перенесших коронарную реваскуляризацию, их них 61 мужчина и 42 женщины. Для решения поставленной цели все пациенты разделенны на 2 группы: больные 1-й группы, не получавшие терапию по профилактике сердечно-сосудистых заболеваний согласно рекомендациям МЗ РФ (стабильная стенокардия) до инфаркта миокарда (мужчины n=41, женщины n=22), и пациенты 2-й группы, регулярно получавшие данную терапию (мужчины n=20, женщины n=20). Терапия, направленная на профилактику сердечно-сосудистых заболеваний (таких как артериальная гипертензия, стабильная стенокардия), включала в себя регулярный прием: бета-блокаторов, ингибиторов АПФ, статинов, а также антиагрегантов. Клиническая характеристика пациентов, перенесших инфаркт миокарда, представлена в таблице 1.
Таблица 1
Клиническая характеристика пациентов
|
Параметры |
Мужчины |
Женщины |
||
|
1-я группа (n=41) |
2-я группа (n=20) |
1-я группа (n=22) |
2-я группа (n=20) |
|
|
Возраст, лет |
58±1,24 |
61±3,45 |
62±3,56 |
59±4,2 |
|
Сопутствующая патология: Сахарный диабет: |
n=4 (10%) |
n=6 (30%) |
n=4 (18%) |
n=9 (45%) |
|
Артериальная гипертензия: |
n=5 (12%) |
n=17 (85%)* |
n=3 (13%) |
n=19 (95%)* |
Примечание: * – различия между группами статистически значимы (p<0,05).
Следует отметить, что пациенты, нерегулярно получавшие терапию по профилактике сердечно-сосудистых заболеваний до развития инфаркта миокарда, на амбулаторном этапе не наблюдались (контроль артериального давления не проводили либо проводили нерегулярно; уровень сахара крови не определялся либо определялся нерегулярно), что не исключает в данной группе большего количества пациентов с диагнозами «артериальная гипертензия (АГ)» или «сахарный диабет». Все пациенты на момент возникновения сердечно-сосудистого события имели 1-ю стадию хронической сердечной недостаточности.
Ультразвуковое исследование сердца проводилось на 30–40-е сутки (36±4,7) после проведенного коронарного стентирования, на аппарате «Accuvix A 30» (Корея), по стандартной методике с использованием рекомендаций Американского эхокардиологического общества [17]. Все показатели рассчитывались в B-режиме: толщина межжелудочковой перегородки в диастолу (ТМЖПд), толщина нижнебоковой стенки левого желудочка в диастолу (ТЗСЛЖд) (толщина стенки в месте гипокинезии или акинезии измерялась в трех местах и выводилась средняя цифра), конечный диастолический (КДР ЛЖ) и систолический (КСР ЛЖ) размеры левого желудочка, масса миокарда левого желудочка (ММЛЖ), а также индекс массы миокарда левого желудочка (ИММЛЖ) в зависимости от площади поверхности тела (ППТ). Рассчитывались конечный диастолический объем левого желудочка (КДО ЛЖ), объем левого предсердия (ЛП), а также индекс объема левого предсердия (ЛП) в зависимости от площади поверхности тела (ППТ); фракция выброса (ФВ) рассчитывалась по методу Симпсона, определялось время изоволюметрического расслабления левого желудочка (IVRT), время замедления кровотока раннего диастолического наполнения левого желудочка (DT). Модуль упругости левого желудочка (МУЛЖ) [18] рассчитывался по формуле:
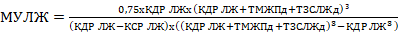 .
.
Статистически значимых различий по эхокардиографическим показателям на момент возникновения инфаркта миокарда выявлено не было.
Из исследования исключались пациенты с постинфарктным кардиосклерозом, повторной реваскуляризацией коронарных артерий, аневризмой ЛЖ, постоянной формой мерцательной аритмии, пороками сердца и морбидным ожирением 3-й степени.
Статистическая обработка полученных данных проводилась с применением программ «Statistica» с использованием непараметрического критерия Манна–Уитни. Результаты представлены как Me (Q25; Q75), где Ме – медиана, Q25;Q75 – доверительный интервал. Производилось вычисление парного и непарного критериев Стьюдента для оценки достоверности соответственно внутри- и межгрупповых различий. Данные показатели представлены в виде M+/–SD. Критический уровень значимости p принимался равным 0,05.
Результаты исследования и их обсуждение
Данные эхокардиографического обследования пациентов представлены в таблицах 2 и 3.
Таблица 2
Эхокардиографические показатели ремоделирования сердца у мужчин, перенесших коронарную реваскуляризацию после инфаркта миокарда
|
Показатели, ед. |
Мужчины 1-й группы (n=41) |
Мужчины 2-й группы (n=20) |
|
КДР ЛЖ, см |
4,6 (4,2;4,9) |
5,0 (4,4;5,3)* |
|
КСР ЛЖ, см |
3,6 (3,15;3,9) |
4,1 (3,6;4,5)* |
|
ТМЖПд, см |
1,2 (1,1;1,3) |
1,3 (1,1;1,5) |
|
ТЗСЛЖд, см |
1,2 (1,1;1,3) |
1,3 (1,1;1,3) |
|
ММЛЖ, г |
222 (182,5;255,5) |
262 (206;321)* |
|
Индекс ММЛЖ, г/м2 |
115 (95;131) |
132 (106;152)* |
|
КДО ЛЖ, мл |
86,3 (72;94) |
92 (74;115)* |
|
Индекс КДО ЛЖ, мл/м2 |
41 (36,5;48,5) |
46 (40;56)* |
|
ФВ ЛЖ, % |
55 (39;58) |
41 (35;48)* |
|
Переднезадний размер ЛП, см |
3,4 (3,2;3,9) |
3,7 (3,4;4,1) |
|
Индекс переднезаднего размера ЛП, см |
1,7 (1,6;1,9) |
1,9 (1,7;2) |
|
Объем ЛП, мл |
42 (31,5;52) |
46 (40;67)* |
|
Индекс объема ЛП, мл/м2 |
21 (16,8;25) |
24 (21;30)* |
|
IVRT, мс |
92 (91,3;94,4) |
93,3 (92,5;94,6) |
|
DT, мс |
116,3 (112,5;119,3) |
118,1 (115,8;119) |
|
Модуль упругости ЛЖ |
6,4 (6,3;6,6) |
6,5 (6,3;6,6) |
Примечание: * – различия между группами статистически значимы (p<0,05).
Так, по данным внутрисердечных показателей можно утверждать, что мужчины, получавшие терапию по профилактике сердечно-сосудистых заболеваний до ИМ, имеют статически значимо более выраженные структурные изменения в сердце, которые характеризуются увеличением линейных (КДР ЛЖ, КСР ЛЖ) и объемных показателей левых отделов (КДО ЛЖ, индекс КДО ЛЖ, объем ЛП, индекс объема ЛП), а также имеют статистически значимое увеличение показателя массы миокарды (ММЛЖ, индекс ММЛЖ) и более низкое значение систолической функции ЛЖ (ФВ).
Таблица 3
Эхокардиографические показатели ремоделирования сердца у женщин, перенесших коронарную реваскуляризацию после инфаркта миокарда
|
Показатели, ед. |
Женщины 1-й группы (n=22) |
Женщины 2-й группы (n=20) |
|
КДР ЛЖ, см |
4,4 (4,3;4,7) |
4,3 (4,2;4,9) |
|
КСР ЛЖ, см |
3,4 (3,3;3,8) |
3,5 (3,3;3,8) |
|
ТМЖПд, см |
1,1 (1,1;1,2) |
1,3 (1,2;1,4)* |
|
ТЗСЛЖд, см |
1,2 (1,1;1,3) |
1,3 (1,2;1,4)* |
|
ММЛЖ, г |
215 (206;256) |
234 (204;290)* |
|
Индекс ММЛЖ, г/м2 |
108 (101;121) |
124 (113;152)* |
|
КДО ЛЖ, мл |
72 (65;95) |
75 (66;82) |
|
Индекс КДО ЛЖ, мл/м2 |
40 (38;49) |
39 (36;42) |
|
ФВ ЛЖ, % |
56 (54;58) |
56 (47;58) |
|
Переднезадний размер ЛП, см |
3,5 (3,1;3,7) |
3,4 (3,3;3,7) |
|
Индекс переднезаднего размера ЛП, см |
1,9 (1,8;2,1) |
1,8 (1,7;2) |
|
Объем ЛП, мл |
44 (37;52) |
43 (41;50) |
|
Индекс объема ЛП, мл/м2 |
24 (21;28) |
24 (22;26) |
|
IVRT, мс |
90,6 (89,5;92,3) |
91 (90,2;92;8) |
|
DT, мс |
116,4 (112;118,3) |
114,1 (111,8;117,3) |
|
Модуль упругости ЛЖ |
5,9 (5,7;6,2) |
5,7 (5,5;5,9) |
Примечание: * – различия между группами статистически значимы (p<0,05).
Сравнительная оценка структурных параметров у женщин выявила статистически значимое увеличение только по показателям массы миокарда ЛЖ (ММЛЖ, индекс ММЛЖ) в группе больных, получавших терапию по профилактике ССЗ.
Была проведена сравнительная корреляция по структурным показателям между сравниваемыми группами. Данные представлены в таблицах 4 и 5.
Таблица 4
Эхокардиографические показатели ремоделирования сердца у женщин и мужчин, не получавших терапию по профилактике сердечно-сосудистых заболеваний и перенесших коронарную реваскуляризацию после инфаркта миокарда
|
Показатели, ед. |
Мужчины 1-й группы (n=41) |
Женщины 1-й группы (n=22) |
|
КДР ЛЖ, см |
4,5 (4,1;4,9) |
4,45 (4,3;4,7) |
|
КСР ЛЖ, см |
3,5 (3,1;3,9) |
3,45 (3,3;3,8) |
|
ТМЖПд, см |
1,2 (1,1;1,3) |
1,15 (1;1,3) |
|
ТЗСЛЖд, см |
1,2 (1,1;1,3) |
1,2 (1,1;1,3) |
|
ММЛЖ, г |
205 (180;241,5) |
198,5 (182;224) |
|
Индекс ММЛЖ, г/м2 |
109 (93,5;123) |
112 (101;125) |
|
КДО ЛЖ, мл |
78,5 (70,5;88) |
71,5 (64;95) |
|
Индекс КДО, мл/м2 |
40 (35,5;47) |
39 (34;49) |
|
ФВ ЛЖ, % |
56 (46;58) |
55,5 (53;58) |
|
Переднезадний размер ЛП, см |
3,4 (3,2;3,9) |
3,4 (3,1;3,7) |
|
Индекс переднезаднего размера ЛП, см |
1,7 (1,6;1,9) |
1,9 (1,8;2,1) |
|
Объем ЛП, мл |
42 (30,5;52) |
43,5 (37;52) |
|
Индекс объема ЛП, мл/м2 |
21 (16;24,5) |
24 (21;28) |
|
IVRT, мс |
76,8 (74,1;79,3) |
78,2 (75,1;79,9) |
|
DT, мс |
120,6 (114,1;123,7) |
117,7 (115,8;123,6) |
|
Модуль упругости ЛЖ |
6,12 (5,94;6,35) |
6,1 (6,02;6,3) |
Примечание: * – различия между группами статистически значимы (p<0,05).
Статистически значимых различий при сравнении групп мужчин и женщин, не получавших терапию, выявлено не было.
Таблица 5
Эхокардиографические показатели ремоделирования сердца у женщин и мужчин, получавших терапию по профилактике сердечно-сосудистых заболеваний и перенесших коронарную реваскуляризацию после инфаркта миокарда
|
Показатели, ед |
Мужчины 2-й группы (n=20) |
Женщины 2-й группы (n=20) |
|
КДР ЛЖ, см |
4,9 (4,4;5,3) |
4,3 (4,15;4,8)* |
|
КСР ЛЖ, см |
4,1 (3,6;4,5) |
3,5 (3,25;3,7)* |
|
ТМЖПд, см |
1,3 (1,1;1,5) |
1,35 (1,2;1,45) |
|
ТЗСЛЖд, см |
1,3 (1,1;1,3) |
1,3 (1,3;1,4) |
|
ММЛЖ, г |
262 (206;321) |
229 (204;282) |
|
Индекс ММЛЖ, г/м2 |
132 (106;152) |
122 (114;154) |
|
КДО ЛЖ, мл |
92 (74;115) |
71 (65;79)* |
|
Индекс КДО ЛЖ, мл/м2 |
46 (40;56) |
38,5 (35,5;41)* |
|
ФВ ЛЖ, % |
41 (35;48) |
57 (51;58)* |
|
Переднезадний размер ЛП, см |
3,7 (3,4;4,1) |
3,4 (3,25;3,65) |
|
Индекс переднезаднего размера ЛП, см |
1,9 (1,7;2) |
1,8 (1,7;2) |
|
Объем ЛП, мл |
46 (40;67) |
43 (41;48) |
|
Индекс объема ЛП, мл/м2 |
24 (21;30) |
23,5 (22;25,5) |
|
IVRT, мс |
85,4 (79,2;9) |
79 (77,4;85,6) |
|
DT, мс |
112,2 (110,9;116,7) |
114 (110,5;118,4) |
|
Модуль упругости ЛЖ |
6,2 (6,1;6,4) |
6,0 (5,8;6,3) |
Примечание: * – различия между группами статистически значимы (p<0,05).
При межгрупповом сравнении мужчин и женщин, получавших лечение, были выявлены статистически значимое увеличение объемных параметров (КДО, индекс КДО) и снижение ФВ в группе мужчин. Изменения в показателях IVRT, DT и модуля упругости левого желудочка выявлены не были.
Анализируя полученные результаты, можно утверждать, что у мужчин 2-й группы, в отличие от мужчин 1-й группы, на фоне статистически значимого снижения ФВ в раннем постинфарктном периоде развивается более выраженное утолщение стенок ЛЖ, что, вероятно, связано с появлением компенсаторной гипертрофии ЛЖ и, как следствие, увеличением показателей ММЛЖ, что, в свою очередь, указывает на более глубокие нарушения в нейрогуморальной регуляции у мужчин, имеющих более длительный анамнез ИБС и АГ, что подтверждается ранее полученными данными [19].
Сравнительная оценка эхокардиографических межгрупповых параметров у женщин выявила увеличение только по показателям ММЛЖ во 2-й группе на фоне сохраненной ФВ, что также не исключает появления компенсаторной гипертрофии у пациентов, имеющих длительный анамнез ИБС и АГ, что соответствует ранее полученным данным в исследовании [20].
Выявленные статистически значимые различия между мужчинами и женщинами 2-й группы, вероятно, связаны с более агрессивным течением ИБС и АГ у мужчин, о чем свидетельствуют статистически значимое снижение ФВ и, как следствие, увеличение объемных показателей левых отделов сердца, в отличие от женщин, у которых наблюдается «задержка среднего возраста» ввиду эстрогеновой защиты коронарных сосудов в перименопаузальном периоде, что подтверждают ранее проведенные исследования [20].
Таким образом, длительно применяемая терапия до впервые возникшего инфаркта миокарда не исключает неблагоприятного ремоделирования ЛЖ в постинфарктном периоде.
Полученные результаты требуют проведения дальнейших исследований на большей выборке пациентов с целью определения механизмов гендерных различий по характеру структурного ремоделирования миокарда на догоспитальном этапе. При разработке индивидуальных программ физической реабилитации пациентов, перенесших инфаркт миокарда, необходимо проведение ультразвукового исследования сердца для оценки структурно-функционального состояния миокарда.
Исследование соответствует положениям Хельсинкской декларации, у всех пациентов было получено информированное согласие.
Выводы
Постинфарктное ремоделирование миокарда у пациентов, перенесших коронарное стентирование, характеризуется структурными изменениями, имеющими гендерные особенности. Более выраженные изменения структурных показателей имеют пациенты, получавшие профилактическую терапию до впервые возникшего инфаркта миокарда.
1. Мужчины, получавшие лечение по профилактике сердечно-сосудистых заболеваний, в отличие от не получавших профилактическую терапию, имеют статистически значимо более высокие объемные показатели левых отделов сердца, а также у них отмечается увеличение толщины стенок левого желудочка на фоне снижения систолической функции.
2. У женщин, получавших лечение по профилактике сердечно-сосудистых заболеваний, в отличие от не получавших терапию, выявлено статистически значимое увеличение толщины стенок и массы миокарда на фоне сохраненной систолической функции.
3. При сравнении мужчин и женщин, получавших лечение до инфаркта миокарда, статистически значимые различия по эхокардиографическим показателям сердца выявлены у мужчин, они характеризуется более высокими значениями объемных показателей ЛЖ на фоне снижения систолической функции.
4. Оценка гендерных различий по модулю упругости, отражающему упруго-эластические свойства ЛЖ, статистически значимых различий не выявила.
Библиографическая ссылка
Мельникова М.А., Рузов В.И., Гимаев Р.Х., Миннабетдинова Р.Р., Ибрахим А.М., Хайруллин Р.Р., Фролова М.В. ГЕНДЕРНАЯ ОЦЕНКА СТРУКТУРНО-ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ МИОКАРДА У ПАЦИЕНТОВ, ПЕРЕНЕСШИХ ИНФАРКТ // Современные проблемы науки и образования. – 2022. – № 4. ;URL: https://science-education.ru/ru/article/view?id=31894 (дата обращения: 13.05.2024).



