Распространенность пищевой аллергии и пищевой непереносимости у детей во всем мире достигает 20%, и наиболее подвержены данным патологическим состояниям дети первых трех лет жизни, особенно дети первого года жизни [1]. Основным клиническим проявлением гастроинтестинальной формы пищевой аллергии и пищевой непереносимости является синдромом нарушенного кишечного всасывания (СНКВ). СНКВ представляет собой патологическое состояние, характеризующееся неспособностью тонкого кишечника поглощать определенные питательные вещества [2]. Вследствие этого у детей нарушено всасывание белков, жиров, углеводов, железа, витамина D и других микроэлементов. При отсутствии адекватной коррекции такого состояния дети склонны к развитию недостаточности питания, недостаточности и дефицита витамина D, других патологических состояний [3]. Дефицит витамина D встречается у пациентов с СНКВ намного чаще, чем в общей популяции, что указывает на присутствие специфических причинных факторов заболевания [4]. Также существуют данные, свидетельствующие о том, что распространенность недостаточности витамина D среди населения увеличивается параллельно с распространенностью пищевой аллергии [5]. Роль недостаточности витамина D в развитии пищевой аллергии была подчеркнута в популяционном исследовании, проведенном на младенцах в Мельбурне [5].
Витамин D является условно необходимым питательным веществом, которое может быть получено в результате синтеза в эпидермисе под влиянием УФО из 7-дегидрохолестерина или с пищей. Попадая в организм, он метаболизируется в печени и почках под влиянием ферментов цитохрома Р450 с образованием эндокринного гормона 1,25-дигидроксивитамина D (1,25(OH)2D), который контролирует экспрессию генов в тканях-мишенях путем связывания с активируемым лигандом фактором транскрипции, рецептором витамина D (VDR). VDR является членом семейства ядерных рецепторов, который влияет на геномную и негеномную регуляцию клеток-мишеней, обеспечивая разнообразные биологические функции не только в костно-мышечной системе, но и в других органах и тканях [6]. В составе VDR имеются гормонсвязывающие и ДНК-связывающие домены. 1,25-дигидроксивитамин D выступает для VDR в качестве лиганда, после соединения с которым VDR связываются с ретиноид-X-рецептором, который расположен внутри клетки. Получившийся комплекс соединяется со специфическими областями, которые называются «элементы ответа на витамин D» (VDRE) и расположены в промоторном регионе клеток-мишеней. Образовавшийся комплекс действует как фактор транскрипции, способствующий экспрессии генов.
Продукция белка VDR кодируется геном VDR, который является геном-кандидатом многих заболеваний. Ген VDR был открыт в 1988 г., он расположен на коротком плече 12-й хромосомы и содержит 8 экзонов, кодирующих белок (экзоны 2–9), и 6 нетранслируемых экзонов (экзоны 1a-1f). Для гена VDR описано большое количество однонуклеотидных полиморфизмов, обусловленных нуклеотидной заменой, но наиболее значимыми и изученными из них являются несинонимичный полиморфизм FokI (rs2228570) и синонимичные полиморфизмы TaqI (rs731236), BsmI (rs1544410) и ApaI (rs7975232). Наличие мутаций в гене VDR приводит к образованию белка с измененной активностью, что может обусловливать развитие патологических состояний в органах и тканях [7]. Полиморфизм BsmI расположен в интроне 8, рядом с областью 3'UTR, и образуется в результате замены нуклеотидов гуанин (G) на аденин (A). Этот полиморфизм влияет на стабильность матричной РНК (мРНК) гена VDR.
Роль витамина D в регуляции кальциево-фосфатного гомеостаза и в контроле метаболизма костной ткани хорошо известна. Содержание витамина D оказывает значительное влияние на состояние скелета во всех возрастах, а его дефицит приводит к рахиту в детском возрасте, а также к остеомаляции в старшем возрасте. За последние два десятилетия были накоплены данные о влиянии витамина D не только на здоровье скелета, но и на различные органы и ткани благодаря тому, что VDR экспрессируется в нескольких органах, кроме костей и почек, таких как кишечник, тромбоциты, поджелудочная железа, клетки иммунной системы и др.
Первой и наиболее чувствительной тканью-мишенью витамина D является кишечник. Классическая роль витамина D в кишечнике заключается в контроле метаболизма кальция посредством регуляции всасывания кальция в кишечнике. Однако исследования ясно показывают, что другие функции кишечника регулируются молекулярным действием 1,25(OH) 2D, которые опосредованы через VDR. Это включает усиление барьерной функции кишечника, регуляцию стволовых клеток кишечника, подавление канцерогенеза толстой кишки и ингибирование воспаления кишечника [8]. Витамин D может оказывать влияние практически на каждую клетку кишечника, связываясь с VDR и способствуя транскрипции соответствующих генов [9]. Доказано, что агонисты рецепторов витамина D влияют на функцию клеток Th1 и Th2, подавляя синтез аллерген-специфического IgE, ингибируя созревание дендритных клеток, индуцируя толерогенные дендритные клетки и в конечном итоге способствуя индукции регуляторных CD4 + CD25+. Витамин D поддерживает целостность эпителия, укрепляя межклеточные соединения, и обеспечивает соответствующий уровень антимикробных пептидов в слизи [10].
В настоящее время в литературе обнаруживаются несколько противоречивые данные о роли полиморфизмов гена VDR в развитии заболеваний кишечника. Например, исследование, проведенное D.J. Hughes, не продемонстрировало статистически значимой связи между наличием полиморфизмов гена VDR и риском развития воспалительного заболевания кишечника [11]. В то же время в современной литературе нет данных, которые указывали бы на связь между полиморфизмами гена рецептора витамина D и риском развития пищевой аллергии и пищевой непереносимости.
Целью настоящего исследования явилось изучение обеспеченности витамином D и распределения генотипов полиморфизма BsmI гена VDR у детей с СНКВ. Задачи, которые стояли перед авторами во время исследования: оценить уровень витамина D и распределение аллелей и генотипов полиморфизма BsmI гена VDR у пациентов с СНКВ.
Материалы и методы исследования. Было проведено клинико-лабораторное обследование двух групп детей. Первую группу составили 15 детей раннего возраста с СНКВ. Причинами возникновения СНКВ явились гастроинтестинальная форма пищевой аллергии и вторичная лактазная недостаточность вследствие перенесенной кишечной инфекции. В группу контроля вошли 10 здоровых детей, сопоставимых по возрасту и полу и имеющих неотягощенный аллергологический анамнез. Законные представители пациентов дали письменное добровольное согласие на участие в исследовании. При организации исследования были учтены требования Хельсинкской декларации Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г., а также «Правила клинической практики в Российской Федерации», утвержденные приказом Министерства здравоохранения РФ от 19.06.2003 г. № 266.
Количественный уровень 25-OH витамин D сыворотке крови пациентов определяли методом иммуноферментного анализа с использованием реактивов фирмы Euroimmun (Германия) С целью выявления полиморфизма Bsml гена VDR использовали метод полимеразной цепной реакции при помощи реактивов фирмы «Литех» (Москва) в амплификаторе «Терцик» («ДНК-технология», Россия). Детекция продуктов амплификации была осуществлена в 3%-ном агарозном геле; с помощью набора «ДНК экспресс-кровь» фирмы «Литех» (Москва) проводили выделение ДНК из венозной крови пациентов. Для статистической обработки полученных данных применялись методы непараметрической статистики: критерий Манна–Уитни и метод ранговой корреляции Спирмена. Для определения значимости различий в частоте аллелей и генотипов использовали критерий χ2.
Результаты исследования и их обсуждение. После тщательного сбора анамнеза заболевания было выяснено, что в большинстве случаев (93,3%) начало заболевания совпало с введением в рацион питания детей детских молочных смесей на основе белка коровьего молока. При анализе клинических проявлений установлено, что в 100% случаев у детей наблюдался учащенный разжиженный стул, на втором месте по частоте встречаемости отмечались кишечные колики и метеоризм, несколько реже наблюдались срыгивания и рвота (рис. 1).
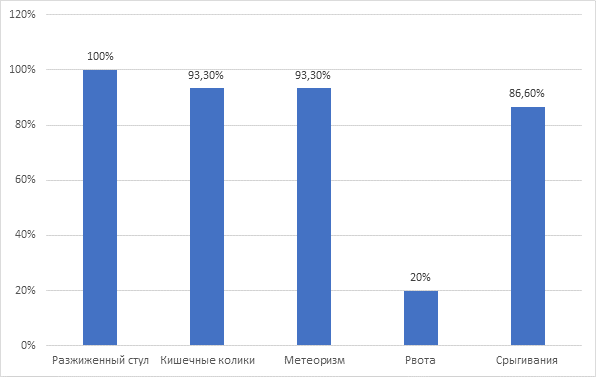
Рис. 1. Распределение клинических проявлений заболевания у пациентов с СНКВ
Всем детям несколько раз проводилось копрологическое исследование для изучения функций желудочно-кишечного тракта. По результатам лабораторного исследования кала были обнаружено, что наиболее часто у детей встречались амилорея и йодофильная флора, несколько реже – переваримая клетчатка, смешанная стеаторея и стеаторея II типа (рис. 2).
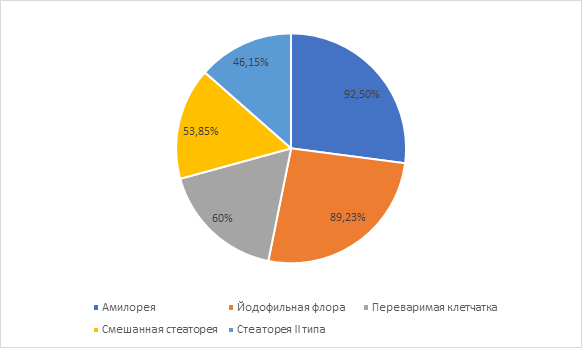
Рис. 2. Распространенность копрологических изменений у пациентов с СНКВ
При анализе содержания 25-OH витамин D в сыворотке крови обследуемых детей было обнаружено, что содержание 25-OH витамин D у пациентов основной группы было в 1,44 раза ниже, чем у пациентов контрольной группы (табл. 1).
Таблица 1
Содержание 25-OH витамин D в крови обследуемых детей
|
|
Основная группа |
Контрольная группа |
p |
|
Уровень 25-OH витамин D |
25,1±1,49 нг/мл |
36,1±2,53 нг/мл |
<0,05 |
Был проведен анализ распределения частот генотипов и аллелей полиморфизма BsmI гена VDR у детей обеих групп. Частота встречаемости дикого аллеля G у детей контрольной группы составила 62,6%, в то время как аллель А встречался в 1,67 раза меньше. Распределение генотипов полиморфизма BsmI гена VDR (G/G – 44%, G/A – 42 %, A/A – 14%) подчинялось равновесию Харди–Вайнберга.
Дикий аллель G у детей основной группы встречался с частотой 64,2%, однако мутантный аллель А встречался в 1,79 раза меньше. Гомозиготные генотипы G/G, A/A у детей основной группы встречались в 0,7 и 0,91 раза меньше по сравнению с детьми из контрольной группы, тогда как частота встречаемости гетерозиготного генотипа G/A была статистически более значима (p<0,05) и превышала аналогичный генотип у здоровых детей в 1,34 раза. Распределение частот аллелей и генотипов представлено в таблице 2.
Таблица 2
Распределение частот аллелей и генотипов у пациентов с СНКВ и здоровых детей
|
Генотип, % |
Аллель G |
Аллель A |
|||
|
G/G |
G/A |
A/A |
% |
% |
|
|
Основная группа |
31 |
56,2* |
12,8 |
64,2 |
35,8 |
|
Контрольная группа |
43,8 |
42,1 |
14,1 |
62,6 |
37,4 |
* – достоверность различий, p<0,05
Согласно Национальной программе «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции» (2021), содержание 25-OH витамин D у детей основной группы в данном исследовании является недостаточным. В исследовании, проведенном группой ученых из США, был описан потенциальный механизм, который предполагает негативное влияние дефицита витамина D на целостность кишечного барьера, что приводит к увеличению проницаемости из-за колонизации патогенной микробной флорой и последующему неадекватному воздействию пищевых аллергенов на иммунную систему, провоцируя развитие аллергической сенсибилизации и пищевой аллергии [12]. Витамин D также участвует в регуляции целостности кишечного барьера на основе тесного взаимодействия с плотными контактами, что способствует высвобождению зонулина, повышая экспрессию белков плотных контактов и, таким образом, подавляя увеличение проницаемости слизистой оболочки кишечника [13]. Таким образом, снижение антимикробных факторов и отсутствие эффективных плотных контактов из-за дефицита витамина D могут привести к неадекватному воздействию и стимуляции иммунной системы, провоцируя развитие аллергической сенсибилизации, экземы и пищевой аллергии [14].
Полиморфизм BsmI расположен рядом с 3'-нетранслируемой областью (UTR) гена VDR в интроне между экзонами 8 и 9. Область 3'-UTR гена VDR участвует в регуляции экспрессии генов, отвечая за стабильность и уровень экспрессии мРНК. Полиморфизм BsmI вызывает развитие молчащей мутации, приводящей к повышенной стабильности мРНК гена VDR. Установлено, что в китайской этнической группе частота полиморфного аллеля G была значительно увеличена у пациентов с язвенным колитом, в то время как повышенная частота генотипа G/A изучаемого полиморфизма связана с язвенным колитом по сравнению со здоровым контролем [15]. В то же время три других полиморфизма гена VDR не были связаны с предрасположенностью к развитию воспалительного заболевания кишечника.
Заключение
Таким образом, настоящее исследование продемонстрировало низкий уровень витамина D у детей с синдромом мальабсорбции и высокую представленность гетерозиготного генотипа G/A полиморфизма BsmI гена VDR, на основании чего можно относить таких детей к группе риска по развитию недостаточности витамина D. Низкое содержание витамина D у детей с пищевой аллергией и пищевой непереносимостью требует его коррекции для улучшения состояния пациентов и нормализации состояния кишечного барьера.
Библиографическая ссылка
Шуматова Т.А., Коваленко Д.В., Приходченко Н.Г. ВИТАМИН D И ЕГО ГЕНЕТИЧЕСКАЯ РЕГУЛЯЦИЯ У ПАЦИЕНТОВ С СИНДРОМОМ НАРУШЕННОГО КИШЕЧНОГО ВСАСЫВАНИЯ // Современные проблемы науки и образования. – 2023. – № 5. ;URL: https://science-education.ru/ru/article/view?id=32926 (дата обращения: 10.05.2024).



