Ежегодно в мире выполняются более 8000 трансплантаций печени. Лекарственно индуцированное поражение печени заняло лидирующее место среди всех интоксикационных причин поражения печени [1, 2]. По данным ВОЗ, примерноодна треть всех жителей Земли заражена тем или иным вирусом гепатита, что ежегодно приводит к смерти около 1 млн человек. В последние годы в большинстве регионов России среди больных острым гепатитом С преобладают лица в возрасте от 15 до 29 лет (70–80%), в то время как дети составляют 3,3–3,6%. Повсеместно распространяется метаболический синдром, при этом неалкогольная жировая болезнь печени (НАЖБП) как один из его компонентов может стать одной из основных причин цирроза и развития рака печени [3]. Если посмотреть на общую распространенность НАЖБП, то она составляет 20–40%. В это же время в группе лиц, страдающих ожирением или сахарным диабетом 2-го типа, распространенность НАЖБП резко увеличивается – до 70–90% [4,5]. Таким образом, метаболический синдром, сами по себе ожирение и сахарный диабет 2-го типа могут рассматриваться как факторы риска НАЖБП [6].
Цель литературного обзора: определить значимость ультразвуковой эластографии сдвиговой волной для диагностики диффузных заболеваний печени.
В настоящее время биопсия печени остается золотым стандартом диагностики паренхиматозных изменений печени [7], потому что она наиболее точно позволяет оценить степень фиброза [8, 9]. Но необходимо помнить, что это инвазивная процедура, которая может привести к ряду осложнений. К основным осложнениям, развивающимся после биопсии печени, следует отнести кровотечение в брюшную полость, декомпенсацию основного заболевания, подкапсульную гематому, болевой синдром после биопсии, вторичную инфекцию после манипуляции, повреждение рядом расположенных органов [10].
Биопсия печени и эластография. Эластография печени по сравнению с биопсией является неинвазивным методом диагностики, обеспечивает высокую комплаентность пациентов, хорошую воспроизводимость [11, 12, 13]. При биопсии печени возможны ошибки при отборе проб, возникновение осложнений при проведении, а гистологический анализ имеет высокую вариабельность при изучении [14].
Сама «эластография», как и «фибросканирование», разрабатывалась на основе получаемых ультразвуковых данных от тех же пациентов, которым для верификации степени фиброза выполнялась пункционная биопсия [15, 16]. Сопоставление эластографических показателей с классификацией фиброза по морфологической шкале METAVIR представлено в таблице 1.
Таблица 1
Сопоставление эластографических показателей с классификацией фиброза по морфологической шкале METAVIR
|
Классификация METAVIR |
Среднее значение плотности печени, кРа |
Интервал средних значений, кРа |
|
|
F0 |
Фиброз отсутствует |
< 5,2 |
<3,9 |
|
F1 |
Звездчатое расширение портальных трактов без образования септ |
5,2 |
3,9–6,5 |
|
F2 |
Расширение портальных трактов с единичными порто-портальными септами (>1 септы) |
6,4 |
4,8–8,0 |
|
F3 |
Многочисленные порто- центральные септы |
8,5 |
6,3–10,7 |
|
F4 |
Цирроз |
10,8 |
8,1–13,5 |
Эластографию можно разделить на несколько видов в зависимости от особенностей аппарата и способа определения жесткости органа: компрессионная эластография; транзиентная эластография (Fibroscan); эластография сдвиговых волн (точечная – ElastPQ); эластография сдвиговых волн (двумерная – ElastQ); магнитно-резонансная эластография.
Рекомендации по эластографии печени доступны в Европейской федерации общества ультразвука в медицине и биологии (EFSUMB) [17], Всемирной федерации ультразвука в медицине и биологии (WFUMB) [18, 19] и Консенсусе Общества радиологов по ультразвуку [20].
При эластографии сдвиговой волной акустический импульс генерируется датчиком и передается от датчика в область интереса, где измеряется скорость распространения результирующей поперечной волны.Модуль упругости ткани рассчитывается с помощью уравнения:E= 3pc2, гдеE– эластичность ткани,C– скорость сдвиговой волны, аρ– плотность ткани в кг/м3.Таким образом, скорость сдвиговой волны является количественным методом определения абсолютной эластичности ткани.Эластография сдвиговой волной включает в себя несколько различных методов измерения скоростей сдвиговой волны: транзиентную эластографию (TE) (Fibroscan), точечную эластографию сдвиговой волной (ElastPQ) и двумерную эластографию сдвиговой волной (ElastQ)[21]. Среди них эластография сдвиговой волной является относительно новым методом визуализации, который позволяет количественно оценить жесткость тканей. Для получения достоверных результатов, чтобы избежать ложно повышенных показателей жесткости печени, пациентам необходимо голодать минимум 2 часа и отдыхать 10 минут перед обследованием [22].Исследования проводятся в положении пациентов лежа на спине, с вытянутой правой рукой над головой, чтобы увеличить межреберье. Измерения жесткости правой доли печени проводятся из межреберного доступа.При использовании метода транзиентной эластографии не выделяется область, представляющая интерес, поскольку отсутствует визуализация печени, а показания получаются из воспринимаемой правильной области печени.При ультразвуковых методах, при которых визуализируется печень, операторы должны поместить область интереса в правую долю печени, избегая любых теней ребер, крупных кровеносных сосудов и желчных протоков [23]. Кроме того, как для ElastPQ, так и для ElastQ датчик должен быть перпендикулярен капсуле печени. Использование медианы из 10 измерений в качестве значения жесткости было рекомендовано в качестве стандартной практики при использовании метода транзиентной эластографии и впоследствии было принято в качестве требуемого количества измерений в клинической практике большинством исследований точечной эластографии сдвиговой волной и стало принятым необходимым количеством измерений, подтвержденным в указанных ранее рекомендациях EFSUMB и WFUMB [19, 24].В то же время есть данные, свидетельствующие о том, что меньшее количество измерений может быть приемлемым при использовании ElastPQ [25]. Литература по измерению жесткости печени у здоровых добровольцев обобщена Dong et al. [26].Среди более крупных исследований среднее/медианное значение жесткости печени с использованием метода транзиентной эластографии колеблется от 4,1 до 5,5 кПа с рассчитанным максимальным верхним 95%-ным центилем 8,7 кПа [27, 28].Также обществом радиологов в ультразвуке в консенсусе, утвержденном на итоговой конференции в 2016 году, предложены точные значения показателей жесткости в kPa, соответствующие стадиям классификации фиброза по Metavir для каждого типа эластографии с учетом производителя аппарата, данные представлены в таблице 2 [29].
Таблица 2
Сопоставление эластографических показателей в зависимости от типа проводимой эластографии (Consensus Conference on Ultrasound Elastography for Liver Fibrosis)
|
Аппарат / Device |
Без выраженного фиброза No significant fibrosis |
Выраженный фиброз /цирроз Advanced fibrosis/cirrhosis |
|
Metavir ≤ 1 Чаще без необходимости дальнейшего наблюдения |
Metavir 4 и ряд случаев 3 Клинически выраженный фиброз |
|
|
TE (Fibroscan) |
<1,5 m/s (7 kPa) |
>2,2 m/s (15 kPa) |
|
ElastPQ (Siemens) |
1,2 m/s (Siemens suggests <1,34 m/s, <5,6 kPa) |
>2,2 m/s (15 kPa) |
|
ElastPQ (Philips) |
< 1,37 m/s (5,7 kPa) |
>2,2 m/s (15 kPa) |
|
2D-SWE (SuperSonic Imagine) |
<1,5 m/s (7 kPa) |
>2,2 m/s (15 kPa) |
|
Magnetic Resonance Elastography (GE, Siemens, Philips) |
<3,0 kPa |
>5,0 kPa |
Эффективность диагностики фиброза. Ряд метаанализов показали хорошую или превосходную диагностическую точность с использованием TE при определении значительного и тяжелого фиброза печени, когда результаты коррелировали с патологической классификацией фиброза печени с площадью под кривой рабочей характеристики приемника (AUROC) 0,82–0,88 для значительного фиброза и 0,91–0,93 для тяжелого фиброза [30, 31].Аналогичные значения AUROC для значительного фиброза и тяжелого фиброза с использованием ElastPQ (0,88 – значительный фиброз; 0,91 – тяжелый фиброз) [32] и двумерной эластографии сдвиговой волной AUROC (0,91 – значительный фиброз; 0,95 – тяжелый фиброз) [33].Как ElastPQ, так и ElastQ методы постоянно демонстрируют более высокий технический процент успеха по сравнению с TE. Есть данные о более высокой точности диагностики при ElastQ по сравнению с TE для всех этиологий заболеваний печени [34, 35].
Стадия фиброза. Более поздние стадии фиброза обусловливают более высокие скорости сдвиговой волны, и это было продемонстрировано в многочисленных исследованиях, но индивидуальные значения порога для разных стадий фиброза также могут варьироваться в зависимости от этиологии заболевания и в значительной степени – от производителя аппарата, поскольку измерения абсолютных скоростей сдвиговой волны не могут передаваться между различными аппаратами [12, 36, 37].Эта проблема связана с техникой измерения и расчета, поскольку каждый производитель обрабатывает полученные данные по-разному. WFUMB рекомендовала применять «правило 5» при интерпретации значений жесткости печени и ведении пациентов;измерение <5 кПа является нормальным, значение от 5 до 10 кПа исключает компенсированное прогрессирующее хроническое заболевание печени при отсутствии известных клинических признаков, значения от 10 до 15 кПа исключают прогрессирующее компенсированное хроническое заболевание печени, значения от 15 до 20 кПа указывают на компенсированное прогрессирующее хроническое заболевание печени, а значение, превышающее 20 кПа, соответствует клинически значимой портальной гипертензии [19].
На примере двумерной эластографии сдвиговой волной в режиме реального времени (ElastQ) можно достоверно определить различные степени фиброза. Для визуальной демонстрации разницы в эластографической картине при циррозе печени разных степеней нами выполнялись исследования на аппарате Philips EPIQ7 датчиком 3–5 МГц, согласно рекомендациям по проведению эластографии сдвиговой волной для ультразвуковых аппаратов компании «Филипс». При проведении исследования у здорового пациента регистрируются нормальные значения эластичности печени, EQI = 4–5 kPa, что соответствует стадии фиброза F0.
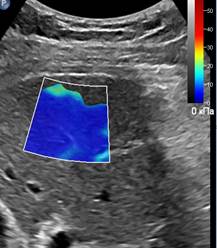
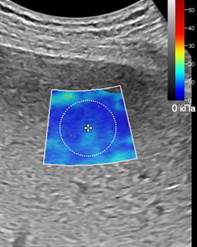
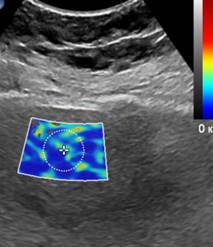
При перипортальном фиброзе на эхограмме в В-режиме определяются умеренное повышение эхогенности и утолщение стенок ствола и ветвей воротной вены, в режиме эластографии сдвиговой волны регистрируется изменение цветовой гаммы в области стенок воротной вены и вокруг них, при количественном определении эластичности в наших исследованиях чаще соответствует стадии F1-F2, но данное измерение не является достоверным, так как в окно интереса, кроме стенки сосуда, с одной стороны попадает просвет сосуда, с другой – паренхима печени в стадии F0 (рис. 1А). У пациентов с фиброзом печени в стадии F2 на рисунке 1Б показана эхограмма с эластичностью EQI =7,65 kPa, а на рисунке 1В представлена эхограмма пациента с фиброзом печени в стадии F3. Как можно видеть, с ростом степени фиброза изменяется и цветовое окрашивание окна поиска, с появлением включений более интенсивной плотности.
А Б В
Рис. 1. (собственные наблюдения). Эхограммы эластографии печени: А – у пациента с перипортальным фиброзом (стадия F1); Б – у пациента с фиброзом печени в стадии F2; В – – у пациента с фиброзом печени в стадии F3
На рисунке 2 представлена эхограмма пациента с циррозом печени, который имел клинико-лабораторное подтверждение данного диагноза.
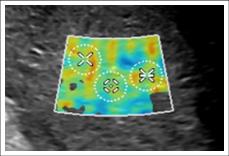
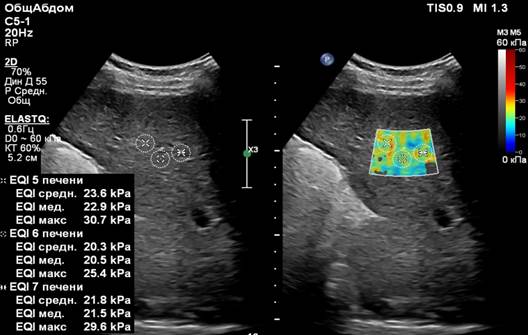
Рис. 2. (собственные наблюдения). Фиброз печени в стадии F4 (цирроз)
Как видно из представленных клинический случаев, в диагностическом плане (с точки зрения наличия фиброза и его степени) эластография абсолютно применима и очень удобна. Однако вызывает сомнения верность полученных данных, поскольку результат напрямую зависит от аппарата, на котором проводится исследование, и от грамотности специалиста, выполняющего данное исследование.
Оценка портальной гипертензии. Золотым стандартом оценки наличия и тяжести портальной гипертензии является инвазивный ангиографический метод; измерение градиента венозного давления (HVPG) с пороговым значением HVPG ≥10 мм рт. ст. указывает на клинически значимую портальную гипертензию, а HVPG ≥12 мм рт. ст. указывает на возможность кровотечения из варикозно-расширенных вен [38].Метаанализ продемонстрировал убедительные доказательства, подтверждающие использование показателя жесткости печени в качестве биомаркера клинически значимой портальной гипертензии, хотя оптимальное пороговое значение, рассчитанное по результатам различных исследований, варьируется от 15 до 25 кПа [39].Дальнейший метаанализ показал, что при значениях ElastQ 14 кПа или менее возможно исключить клинически значимую портальную гипертензию у пациентов с циррозом печени со значением AUROC 0,88 и значением чувствительности 91%.Однако это не предсказывает тяжелую портальную гипертензию с наличием варикозно-расширенных вен, требующих лечения [40].Имеющиеся данные свидетельствуют о том, что показатели жесткости печени демонстрируют хорошую корреляцию с HVPG до 12 мм рт. ст., но не могут заменить инвазивную оценку для определения тяжести и прогрессирования портальной гипертензии, в первую очередь потому, что значения эластографии сдвиговой волной в меньшей степени зависят от внутрипеченочной резистентности при развитии фиброза [41].
Противовирусная терапия. На сегодняшний день доказана гистологическая частичная регрессия фиброза. Роль и сроки проведения эластографии печени в оценке регрессии фиброза печени еще предстоит установить.Есть сообщения о резком снижении оцененных значений жесткости печени сразу после противовирусного лечения [42].
Например, терапевтический результат энтекавира при хроническом гепатите В может быть оценен с использованием ElastQ для определения изменения жесткости печени в течение длительного периода для улучшения ведения лечения и прогноза [43].
Ограничения для проведения эластографии. Существует ряд факторов, которые могут повлиять на эффективность оценки жесткости печени с помощью эластографии сдвиговой волной, таких как количество измерений, объем печени, состояние пациента (избыточный вес или ожирение либо другие осложнения), а также стадия фиброза и опыт врача, проводящего ультразвуковое исследование [44].
Ограничения для эластографии выявлены при работе со всеми методиками. Так, транзиентная эластография имеет следующий ряд недостатков:
- ограниченная глубина проникновения;
- отсутствие анатомической ориентации – неспособность выбрать область для региона интереса – при необходимости избегания таких структур, как сосуды печени и желчные протоки;
- невозможность прохождения сдвиговой волны через жидкие структуры, находящиеся в луче;
- трудность получения информации у пациентов с ожирением.
Эти ограничения могут привести к неудачной оценке плотности печени у пациентов с ожирением, с асцитом, а также с повышенным центральным венозным давлением [45]. Повышение трансаминаз, внепеченочный холестаз, застойная сердечная недостаточность и прием пищи также влияют на показатели транзиентной эластографии, представляя их как ложноположительные [46].
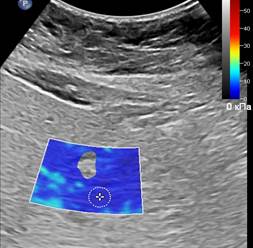
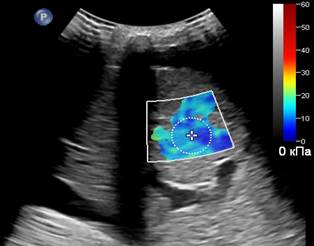
Проведению эластографии сдвиговой волной также могут препятствовать избыточная масса пациента, которая сопровождается жировой инфильтрацией печени (рис. 3А), и явления асцита (рис. 3Б), при этом отмечается неполное окрашивание цветового эластографического окна.
А Б
Рис. 3. (собственные наблюдения). Ситуации с ограничением в применении эластографии: А – Эхограмма пациента с ожирением II степени; Б – Эхограмма пациента с асцитом
Двумерная эластография сдвиговой волной, в свою очередь, имеет неоспоримое преимущество перед транзиентной и точечной эластографией, так как демонстрирует в реальном времени количественную карту плотности паренхимы печени. Область интереса для измерения жесткости печени можно регулировать по размеру и располагать так, чтобы избежать артефактов, возникающих вблизи крупных пульсирующих сосудов. Отмечается хорошая воспроизводимость одним и разными специалистами [47]. В то же время неполное окрашивание цветового эластографического окна может отмечаться и у пациентов с нормальной массой тела при циррозе печени (рис. 4). Возможно, данное явление связано с большим количеством фиброзной, неоднородной ткани, утолщенной и усиленной эхогенностью капсулы, которые больше отражают и рассеивают ультразвуковые волны.
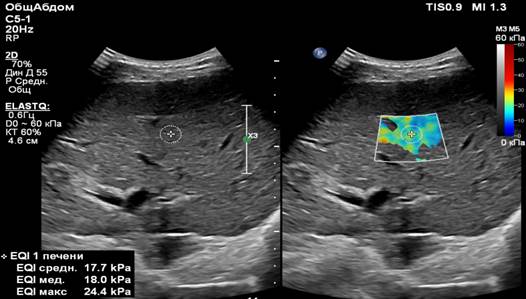
Рис. 4. (собственные наблюдения). Эхограмма пациента с циррозом печени при массе тела 72,0 кг
Заключение
Для выявления и постановки фиброза, а также для оценки ответа на лечение необходим надежный неинвазивный метод. На сегодняшний день этим методом является ультразвуковая эластография печени сдвиговой волной, позволяющая определить плотность печени, оценить ее структуру, проанализировать паренхиму на большем протяжении. Особенно важно использовать этот метод у пациентов с геморрагическим синдромом на фоне того же цирроза и гиперспленизма, чтобы избежать риска кровотечения при инвазивных методах диагностики.
Ультразвуковая эластография является неинвазивным и точным методом оценки тяжести диффузного заболевания печени.В настоящее время она дает превосходную точность диагностики как цирроза, так и незначительного фиброза печени.Высокая прогностическая ценность эластографии сдвиговой волны имеет большое значение в процессе принятия решений при ведении пациентов с хроническим заболеванием печени.
Врачам-клиницистам необходимо интерпретировать измерения жесткости печени в сочетании с другими клинико-лабораторными данными пациента.
Библиографическая ссылка
Мирончев А.О., Суменко В.В. ЭЛАСТОГРАФИЯ КАК НЕОБХОДИМОЕ ИССЛЕДОВАНИЕ У ПАЦИЕНТОВ С ПАТОЛОГИЕЙ ПЕЧЕНИ // Современные проблемы науки и образования. – 2023. – № 5. ;URL: https://science-education.ru/ru/article/view?id=32936 (дата обращения: 10.05.2024).



