Низкоинтенсивное лазерное излучение (НИЛИ) – это нетепловая доставка фотонов в видимом или ближнем инфракрасном диапазоне (405-1000 нм) с низкой мощностью (1–500 мВт), которая вызывает благоприятный биологический ответ в клетках и тканях. НИЛИ стимулирует повышенное окисление цитохром-С-оксидазы и увеличение скорости переноса электронов в митохондриях, что приводит к увеличению производства АТФ и оказывает многие положительные влияния на ткани. Отсутствие значимых побочных эффектов и минимальное число противопоказаний делает лазерное излучение перспективным методом терапии во многих областях медицины. В последнее время появились работы, в которых НИЛИ используется для стимуляции мезенхимных стволовых клеток (МСК), локализующихся в красном костном мозге или жировой ткани [1]. Высокая скорость пролиферации, способность к дифференцировке в разные клеточные линии, а также возможность получения клеток для трансплантации из собственных тканей организма делает перспективным использование МСК в практической медицине. Исследования in vivo и in vitro продемонстрировали положительное влияние НИЛИ на выживаемость МСК, полученных из жировой ткани, и секрецию ими факторов роста. Установлено также кардиопротекторное действие НИЛИ [2]. Однако благотворное влияние МСК на работоспособность миокарда имеет некоторые ограничения, связанные с доставкой выделенных и культивированных МСК в сердце, низкими показателями их приживления в поврежденных участках миокарда [3]. Поэтому в настоящее время осуществляется поиск оптимальных методов введения или доставки МСК в миокард. Одним из них является облучение лазером тканей, богатых МСК, с целью усиления их миграционной способности. Zaynab H. с соавторами [4] опубликовали данные о том, что при облучении красного костного мозга с помощью НИЛИ, имеющего длину волны 804 нм и дозу 1 Дж/см2, происходит усиление пролиферации МСК и осуществляется их миграция в сердце. По сравнению с красным костным мозгом именно жировая ткань обладает более многочисленным резервом МСК, их легче получить с меньшим количеством осложнений [5]. Однако в доступной литературе авторы не нашли информации о влиянии облучения сальника с помощью НИЛИ на усиление миграции МСК в сердце.
Цель исследования – изучить в сравнительном аспекте изменения гистологического строения сердца и сальника, установить особенности экспрессии в них маркеров, характерных для пролиферирующих и мезенхимных стволовых клеток, для оценки возможной миграции МСК из сальника в сердце при облучении экспериментальных крыс низкоинтенсивным инфракрасным лазером, применяемым десятикратно на область передней брюшной стенки с помощью аппарата «Узор А-2К» с лучевой нагрузкой 0,5-1,0 Дж/см2 и длиной волны 890 нм.
Материалы и методы исследования
Исследование проведено на беспородных белых крысах (самцах, средняя масса тела 379,00±15,45 г). Методом слепой выборки животные были разделены на группы: основную - группу 1, крысы которой (n=8) получали низкоинтенсивное инфракрасное лазерное облучение длиной волны 890 нм с помощью аппарата «Узор А-2К» на область передней брюшной стенки в дозе 0,5-1,0 Дж/см2, с экспозицией 5 минут, десятикратно; контрольную – группу 2 (n=8), животные которой подвергались таким же подготовительным мероприятиям, что и в группе 1, но не были облучены.
Для выведения из эксперимента животных по одному помещали в стеклянный сосуд, содержащий кусочек ваты, пропитанный этиловым эфиром в дозе, в 3 раза превышающей наркотическую. После засыпания животного с целью эвтаназии применяли цервикальную дислокацию. Все процедуры эвтаназии проводили с соблюдением этических принципов «Европейской Конвенции по защите позвоночных животных, используемых для экспериментов или в других научных целях» (Страсбург, 18 марта 1986 г.). Для проведения эксперимента было получено разрешение Локального этического комитета ФГБОУ ВО «Пермский ГМУ им. академика Е.А. Вагнера» Минздрава России, протокол № 3 от 11 марта 2019 года.
У животных забирали сальник и сердце в области верхушки, фиксировали в забуференном нейтральном формалине, заливали в парафин, препараты окрашивали гематоксилином и эозином. Для проведения иммуногистохимических реакций c целью выявления в тканях мезенхимных стволовых клеток применяли кроличьи моноклональные противокрысиные антитела системы Diagnostic Biosystems, с помощью которых определяли экспрессию в клетках сальника и сердца CD73, CD90, CD105, CD34 и CD45. Использовали антитела к СD73 (ab175396), CD90 (ab92574), CD105 (ab231673), CD 34 (ab81289) и СD45 (ab10558), для определения пролиферирующих клеток выявляли экспрессию Ki-67(ab15580). Окрашивание проводили согласно протоколу с использованием системы детекции HRP/DAB DetectionSistem. Для определения специфичности окрашивания применяли отрицательный контроль, для проведения которого при окрашивании срезов первичное антитело заменяли раствором фосфатного буфера. После окрашивания гистологических препаратов в левом желудочке сердца осуществляли подсчет клеток, экспрессирующих соответствующие антигены, в 4 зонах: в стенке кровеносных сосудов (зона 1), в субэпикардиальной зоне миокарда (зона 2), в субэндокардиальной зоне миокарда (зона 3) и в средней части миокарда (зона 4). В сальнике подсчет клеток проводили в стенке и вокруг кровеносных сосудов (зона 1) и в участках локализации фибробластоподобных клеток (ФПК) (зона 2). В каждой зоне сальника и сердца при увеличении микроскопа на 1000 подсчет осуществляли в 10 полях зрения с вычислением процентного содержания положительно окрашенных клеток. Микроскопирование и фотографирование препаратов проводили с помощью микроскопа «Ломо Микмед-6» и цифровой фотокамеры ToupCam.
Статистическая обработка полученных данных проводилась на ПК с использованием встроенного пакета анализа табличного процессора Excel® 2016 MSO и пакета прикладных электронных таблиц (ППЭТ) Stat2015. При совпадении показателей средней арифметической (М) и медианы (Ме) для оценки показателей использовались методы параметрической статистики. Для определения достоверного различия дисперсий признаков применялся критерий Фишера (F), при оценке статистической достоверности различий использовали двухвыборочный критерий Стьюдента (t); при отсутствии нормального распределения применялся U-критерий Манна - Уитни (U). Вычисляли средние показатели (M) и ошибку репрезентативности средней арифметической (m). Различия между группами считали статистически значимыми при p<0,05.
Результаты исследования и их обсуждение
В сальнике животных экспериментальной группы под действием НИЛИ наблюдали расширение сосудов микроциркуляторного русла, появление периваскулярных полиморфноклеточных и лимфомакрофагальных инфильтратов разных размеров (рис. 1A). Адипоциты, расположенные в участках воспаления, имели признаки липолиза, часть клеток подвергалась деформации и разрушению (адипоцитолиз) (рис. 1B).
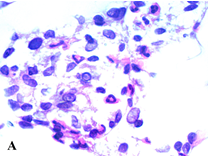
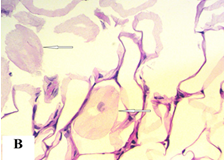
Рис. 1. Сальник животных экспериментальной группы (группа 1): A – воспалительный инфильтрат; B – адипоциты в состоянии липолиза (указаны стрелками). Окраска гематоксилином и эозином. Увеличение х1000
В зонах адипоцитолиза располагались клетки многоугольной или веретеновидной формы, имеющие фенотип фибробластов (фибробластоподобные – ФПК). ФПК формировали пласты, вокруг которых отмечалось развитие соединительной ткани.
Известно, что основным фотоакцептором НИЛИ в клетках млекопитающих является цитохром–С-оксидаза митохондрий, поглощающая свет в диапазоне от 630 до 900 нм. Под влиянием НИЛИ происходит повышение окисления цитохром–С-оксидазы, ускорение переноса электронов и увеличение синтеза АТФ в клетках. Некоторые молекулы, например мембранные хромофоры, после поглощения фотона света переходят на некоторое время в возбужденное состояние, взаимодействуют с кислородом, что приводит к образованию реакционноспособного синглетного кислорода. Изменение метаболизма митохондрий и активация дыхательной цепи путем светового воздействия увеличивает также производство супероксид-анионов и перекиси водорода [6]. Образование активных форм кислорода при воздействии НИЛИ вызывает повреждение клеточных мембран адипоцитов и выход из цитоплазмы эндогенных молекул, в том числе жирных кислот и провоспалительных цитокинов [7]. Жирные кислоты и другие молекулы, выделяемые во внеклеточное пространство, действуют как молекулярный фрагмент, ассоциированный с повреждениями (DAMP – damage associated molecular pattern), активируя макрофаги жировой ткани через toll - подобный рецептор 4 типа. Активация макрофагов вызывает продукцию ими фактора некроза опухоли альфа (ФНО-α) и других провоспалительных молекул, что способствует развитию локального воспаления и разрушению части адипоцитов. Таким образом, в нашем эксперименте в сальнике экспериментальных животных с помощью НИЛИ, имеющего длину волны 890 нм и лучевую нагрузку 0,5-1 Дж/см2, был получен липолитический эффект, который сопровождался развитием местного воспаления. Исходом воспалительного процесса в сальнике стало появление очагов скопления ФПК и формирование соединительной ткани. Согласно данным литературы, НИЛИ оказывает прямое стимулирующее действие на пролиферацию и миграцию фибробластов, а также на их трансформацию в коллаген-синтезирующие миофибробласты [8].
В сердце животных экспериментальной группы установлено полнокровие вен и неравномерное расширение капилляров. В периваскулярных участках миокарда были выявлены лимфоидные инфильтраты с примесью гранулоцитов, появление клеток с фенотипом ФПК и нарушение правильной организации кардиомиоцитов в функциональные волокна (рис. 2А). При подсчете числа клеток в поле зрения микроскопа в зоне 4 было установлено увеличение количества адипоцитов с 16,4±8,2 до 39,9±20,8 (t=3,277, р<0,01) (рис. 2В).
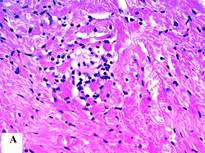
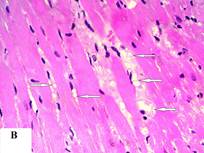
Рис. 2. Сердце животных основной группы (группа 1): А – лимфоидный инфильтрат в миокарде; В - липоматоз стромы миокарда (адипоциты указаны стрелками). Окраска гематоксилином и эозином. Увеличение х400
Морфологические изменения в сердце экспериментальных крыс могут быть связаны с кратковременным увеличением под действием НИЛИ продукции провоспалительных цитокинов [9], что вызывает изменение проницаемости кровеносных сосудов и усиление миграции лейкоцитов в строму миокарда. Развитие адипоцитолиза и липолиза в адипоцитах сальника под действием лазерного облучения приводит к увеличению содержания в крови животных группы 1 свободных жирных кислот (СЖК) [10]. Повышение проницаемости кровеносных сосудов сердца может способствовать поступлению СЖК в ткани и их проникновению в цитоплазму стромальных клеток и ФПК, так как преадипоциты, имеющие фенотип ФПК, экспрессируют гликопротеин CD36/FAT и внутриклеточные ацил-КоА-синтетазы, которые увеличивают поглощение жирных кислот за счет прямого транспорта через плазматическую мембрану [11]. Накопление СЖК в клетке приводит к развитию окислительного стресса и митохондриальной дисфункции, вызывает активацию факторов транскрипции: связывающего стеролрегулирующего элемента (SREBP-1c) и рецептора, активируемого пероксисомными пролифераторами γ (PPARγ), которые запускают механизм липогенеза в клетках и способствуют, таким образом, увеличению числа адипоцитов в строме миокарда [12].
Иммуногистохимическое исследование показало, что в сальнике животных группы 1 в участках локализации ФПК происходило увеличение количества клеток, экспрессирующих маркеры, характерные для МСК – CD73, CD90, CD105. В этих же зонах установлено статистически значимое увеличение количества пролиферирующих клеток, экспрессирующих Ki-67 (табл. 1). Экспрессия соответствующих маркеров наблюдалась в клетках с фенотипом перицитов и адвентициальных клеток. В то же время сами ФПК не экспрессировали данные антигены. Содержание в сальнике клеток, экспрессирующих СD34 и CD45, соответствовало контролю. Установленная в сальнике у крыс группы 1 одинаковая динамика клеток, экспрессирующих СD73, CD90, CD105, при отсутствии изменений в содержании клеток, положительно окрашивающихся на CD45 и CD34, позволяет рассматривать эти клетки как МСК.
Таблица 1
Динамика процентного содержания клеток, экспрессирующих маркеры CD34, CD45, CD73, CD90, CD105, Ki-67, в сальнике животных групп 1 и 2 (M±2m)
|
|
Группа 2 |
Группа 1 |
|||||
|
Зона 1 |
M±2m (%)
|
Me
|
M±2m (%) |
Me |
Критерий Фишера F |
Критерий Стьюдента t |
Критерий Манна - Уитни U |
|
CD34 |
10,62±2,4 |
10,7 |
13,34±2,74 |
13,9 |
- |
- |
- |
|
CD45 |
21,64±2,12 |
20,8 |
21,58±2.23 |
20,8 |
- |
- |
- |
|
CD73 |
18,74±4,41 |
17,2 |
39,06±3,5↑ |
40,4 |
- |
7,0527, р=0.0001 |
0.00, р=0,0090 |
|
CD90 |
5,48±2,14 |
5.8 |
7,80±1.50 |
7.8 |
- |
- |
- |
|
CD105 |
20,48±4.87 |
20,7 |
23,78±4,82 |
22,4 |
- |
- |
- |
|
Ki-67 |
4,02±0,64 |
3,9 |
4.76±1,55 |
4.9 |
- |
- |
- |
|
|
Группа 2 |
|
Группа 1 |
||||
|
Зона2 |
M±2m (%) |
Me |
M±2m (%) |
Me |
Кр. Фишера F |
Кр. Стьюдента t |
Кр. Манна - Уитни U |
|
CD34 |
16,98±2,81 |
16,3 |
20,50±3.80 |
20,6 |
- |
- |
- |
|
CD45 |
33,90±4.53 |
34,8 |
38,42±4,01 |
38,0 |
- |
- |
- |
|
CD73 |
32,20±8,27 |
29,2 |
50,58±5,11↑ |
52.5 |
- |
3,7042,р=0,0060 |
1.00,р=0,0163 |
|
CD90 |
7.70±1.88 |
7,6 |
17,3±9,22 ↑ |
16,4 |
24,128,р=0,009 |
- |
3,00,р=0,0472 |
|
CD105 |
28,76±1.92 |
29,1 |
38,88±7,38↑ |
40,4 |
14,814,р=0,023 |
- |
2,50,р=0.0367 |
|
Ki-67 |
4,38±0,48 |
4.4 |
7,1±2.38 ↑ |
7,7 |
24,503,р=0.009 |
- |
- |
Примечание: ↑ - увеличение числа клеток относительно контроля; р<0,05.
Увеличение содержания МСК в сальнике под действием лазерного облучения может быть вызвано двумя факторами. Первым из них является развитие в сальнике воспаления. Вторым фактором становится непосредственное стимулирующее действие лазерного облучения на пролиферативную активность и дифференцировку МСК. Было обнаружено, что облучение инфракрасным светом активирует сигнальные каскады, которые способствуют клеточной пролиферации [13].
В сердце животных основной группы 1 в отдельных зонах установлено уменьшение содержания клеток, экспрессирующих некоторые маркеры, характерные для МСК (CD73, CD90, CD105). Однако эти изменения в основном не имели статистически значимой достоверности (табл. 2). Экспрессия Ki-67 (за исключением зоны 3), CD45 и CD34 в клетках миокарда находилась на контрольном уровне.
Таблица 2
Динамика процентного содержания клеток, экспрессирующих CD34, CD45, CD73, CD90, CD105 и Ki-67 в сердце животных групп 1 и 2 (M±2m)
|
|
Группа 2 |
Группа 1 |
||||||
|
Зона1| |
M±2m (%)
|
Me
|
M±2m (%) |
Me |
Кр. Фишера F |
Кр. Стьюдента t |
Кр. Манна - Уитни U |
|
|
CD34 |
5,66±1,74 |
5,6 |
4.06±1,37 |
4,4 |
- |
- |
- |
|
|
CD45 |
6,94±1.74 |
6,8 |
6.06±1,22 |
6,2 |
- |
- |
- |
|
|
CD73 |
34,94±2,28 |
35,2 |
26,28±2,43↓ |
26,2 |
- |
5,0880,р=0,0009 |
0,00,р=0,0090 |
|
|
CD90 |
5,94±0,67 |
5,8 |
5,04±0,95 |
5,2 |
- |
- |
- |
|
|
CD105 |
26,00±2,43 |
25,0 |
20,36±3,61↓ |
20,6 |
- |
2,5395,р=0,0347 |
3,00,р=0.0472 |
|
|
Ki-67 |
2,18±0,92 |
2,0 |
1,86±0,77 |
1,8 |
- |
- |
- |
|
|
|
Группа 2 |
|
Группа 1 |
|||||
|
Зона 2 |
M±2m (%) |
Me |
M±2m (%) |
Me |
Кр. Фишера F |
Кр. Стьюдента t |
Кр. Манна - Уитни U |
|
|
CD34 |
9,18±1.53 |
8,6 |
8,18±1,09 |
8,6 |
|
- |
- |
|
|
CD45 |
17,76±2.79 |
18,2 |
17,62±2,20 |
18,7 |
- |
- |
- |
|
|
CD73 |
39,50±8,53 |
38,9 |
35,72±4.04 |
34,1 |
- |
- |
- |
|
|
CD90 |
9.78±1,67 |
9,7 |
7.68±0,72 |
7,9 |
- |
- |
- |
|
|
CD105 |
41,92±8.69 |
40,3 |
31,38±3,07 |
31,2 |
- |
- |
- |
|
|
Ki-67 |
2,16±0,60 |
2,0 |
1,88±0,75 |
1,8 |
- |
- |
- |
|
|
|
Группа 2 |
Группа 1 |
||||||
|
Зона 3 |
M±2m (%) |
Me |
M±2m (%) |
Me |
Кр. Фишера F |
Кр. Стьюдента t |
Кр. Манна - Уитни U |
|
|
CD34 |
8,28±1,23 |
7,9 |
6.14±2,51 |
6,6 |
- |
- |
- |
|
|
CD45 |
12,12±2,59 |
11,8 |
12,36±2,36 |
11,8 |
- |
- |
- |
|
|
CD73 |
41,98±5,18 |
40,8 |
41,86±3,42 |
41,8 |
- |
- |
- |
|
|
CD90 |
8,80±2,38 |
9,8 |
5,30±0,85 ↓ |
5,3 |
- |
2,7141,р=0,0265 |
- |
|
|
CD105 |
33,70±9,23 |
31,9 |
29,20±6,05 |
28,6 |
- |
- |
- |
|
|
Ki-67 |
3,32±1,26 |
3,8 |
2,42±0,38 ↓ |
2,5 |
11,053,р=0,03 |
- |
- |
|
|
|
Группа 2 |
Группа 1
|
||||||
|
Зона 4 |
M±2m (%) |
Me |
M±2m (%) |
Me |
Кр. Фишера F |
Кр. Стьюдента t |
Кр. Манна - Уитни U |
|
|
CD34 |
3.98±1,12 |
3,4 |
5,48±2,19 |
6,3 |
- |
- |
- |
|
|
CD45 |
11.86±2,50 |
11,9 |
13,14±3,38 |
14,0 |
- |
- |
- |
|
|
CD73 |
34.76±2,32 |
34,0 |
32,04±2.94 |
32,3 |
- |
- |
- |
|
|
CD90 |
6,18±1,99 |
5,8 |
7,14±2,87 |
8,0 |
- |
- |
- |
|
|
CD105 |
31,30±4,36 |
30,2 |
26,24±4,18 |
25,8 |
- |
- |
- |
|
|
Ki-67 |
4.06±1,00 |
3,7 |
2,96±0,75 |
2,8 |
- |
- |
- |
|
Примечание: ↓ - уменьшение числа клеток относительно контроля; р<0,05.
Таким образом, облучение НИЛИ сальника в наших экспериментах не привело к усилению миграции МСК в сердце. Это может быть связано с тем, что нами были взяты животные без индуцируемой кардиальной патологии, у которых отсутствовал цитокиновый вектор, стимулирующий миграцию и пролиферацию стволовых клеток, так как известно, что активация стволовых клеток сердца или усиление миграции МСК происходят на фоне повреждения миокарда, например при инфаркте или аортальном стенозе [14]. В современных исследованиях установлено, что в условиях гипоксии увеличивается выживаемость и миграционная активность МСК [15]. Другой причиной отсутствия динамики МСК в сердце может явиться разная чувствительность тканей сердца и сальника к лазерному облучению, так как эффекты НИЛИ могут значительно различаться в разных тканях и клетках в зависимости от уровня окислительно-восстановительных потенциалов, наличия и порога фотоактивации хромофорных молекул и других факторов.
Выводы
1. Десятикратное облучение сальника экспериментальных крыс низкоинтенсивным инфракрасным лазером в дозе 0,5-1,0 Дж/см2 при длине волны 890 нм вызвало липолиз в адипоцитах и их адипоцитолиз, а также стимуляцию регенераторного потенциала органа, что проявилось увеличением количества МСК и пролиферирующих клеток, наблюдаемым на фоне развития воспалительной реакции.
2. В сердце экспериментальных крыс под действием лазерного облучения в дозе 0,5-1,0 Дж/см2 при длине волны 890 нм установлено развитие липоматоза и отсутствие динамики в содержании МСК и пролиферирующих клеток, что говорит об отсутствии миграции МСК из сальника в сердце.
Библиографическая ссылка
Гуляева Н.И., Владимирский В.Е., Владимирский Е.В., Каячев А.П. СРАВНИТЕЛЬНАЯ ОЦЕНКА МОРФОЛОГИЧЕСКИХ И ИММУНОГИСТОХИМИЧЕСКИХ ИЗМЕНЕНИЙ СЕРДЦА И САЛЬНИКА КРЫС ПОД ДЕЙСТВИЕМ НИЗКОИНТЕНСИВНОГО ИНФРАКРАСНОГО ЛАЗЕРНОГО ОБЛУЧЕНИЯ // Современные проблемы науки и образования. – 2023. – № 5. ;URL: https://science-education.ru/ru/article/view?id=32938 (дата обращения: 10.05.2024).



