Рак тела матки (РТМ) – злокачественная опухоль, исходящая из слизистой оболочки тела матки (эндометрия). РТМ на сегодняшний день является самым частым злокачественным новообразованием женских половых органов и занимает второе место по частоте после рака шейки матки в мире [1, 2]. Увеличение числа случаев заболевания раком эндометрия, прежде всего, связано с увеличением средней продолжительности жизни и ростом числа «заболеваний цивилизации» (бесплодие, эндометриоз, миома матки) [3]. Рак тела матки является морфологически гетерогенной опухолью и преимущественно (более 80%) представлен эндометриоидной аденокарциномой, которой свойственно благоприятное течение с 5-летней выживаемостью после лечения, достигающей 90%. В противоположность ей, есть редкие эндометриальные опухоли, составляющие 15–20% от всех форм рака эндометрия, которые характеризуются плохим прогнозом, что определяется высокой частотой рецидивов заболевания (50%) и 5-летней выживаемостью больных, не превышающей 40% [4]. К подобным гистотипам рака эндометрия относятся эндометриоидная аденокарцинома с плоскоклеточной дифференцировкой и плоскоклеточный рак эндометрия. Оба указанных морфологических варианта эндометриоидной аденокарциномы, согласно Международной гистологической классификации ВОЗ от 2020 года, объединены в вариант аденокарциномы с плоскоклеточной метаплазией. В классификации указаны еще 13 гистотипов эпителиальных опухолей, из которых 3 (муцинозный, серозный и светлоклеточный) подтипа встречаются с частотой от 1 до 10% [5]. Плоскоклеточный рак эндометрия также регистрируется в пределах 1%, однако отдельным морфотипом данная опухоль не выделена ни в одной из существующих классификаций. Тем не менее, интерес к этому гистотипу эндометриоидной аденокарциномы в последние годы растет и привлекает все большее внимание как зарубежных, так и отечественных исследователей из-за своей агрессивности и высокого опухолевого потенциала [6–8].
Ведущим фактором в механизме злокачественной трансформации клеток в биологическом поведении уже возникших опухолей является пролиферативная активность. Это одна из наиболее важных характеристик фенотипа опухоли, в значительной степени определяющая скорость роста опухоли, риск метастазирования и рецидива, потенциальный ответ на лечение. Для выявления особенностей пролиферации клеток злокачественных опухолей человека широко используется антиген Ki-67, экспрессирующийся практически во всех фазах митотического цикла (G1-, S-, G2- и M-фазы), кроме периода G0, и отражающий величину пролиферативного пула [9]. Белки p16 (p16INK4a) и pRb также участвуют в регуляции клеточного цикла. Повышение уровня белка p16INK4a ассоциировано с нарушением деления клеток: его концентрация повышается, чтобы затормозить активную пролиферацию клеток [10]. Функциональная инактивация белка pRb с помощью белка ВПЧ E7 приводит к гиперэкспрессии p16 INK4a, что в итоге ведет к неконтролируемой пролиферации клетки и формированию клона опухолевых клеток [11]. В последнее время вышеописанные маркеры изучаются при различных локализациях, однако их значимость при раке тела матки остается недостаточно исследованной.
Целью исследования явилось сравнительное изучение морфологических и некоторых иммуногистохимических особенностей эндометриоидной аденокарциномы, аденокарциномы с плоскоклеточной метаплазией и плоскоклеточного рака эндометрия для выявления более агрессивного гистотипа.
Материалы и методы исследования. В работе использовались клинические и лабораторные данные 90 больных с раком тела матки, находившихся на лечении в НМИЦ онкологии г. Ростова-на-Дону. Диагноз карциномы эндометрия был подтвержден во всех случаях на амбулаторном этапе; гистотип опухоли был уточнен после операции в соответствии с международной гистологической классификацией РТМ (классификация Всемирной организации здравоохранения (ВОЗ), 2020 год). До операции лечение не проводилось. Группу изучения составили 40 больных с эндометриоидной аденокарциномой, 31 больная – с эндометриоидной аденокарциномой с плоскоклеточной метаплазией и 19 больных с плоскоклеточным раком эндометрия. Во всех группах преобладали больные с I и II стадиями заболевания, больные с III стадией отмечены только в группе с плоскоклеточным раком эндометрия. В исследование включены больные в возрасте от 32 до 89 лет [Me=62,5; 36–81]. Все больные были прооперированы по стандартной методике, согласно клиническим рекомендациям от 2022 года.
Морфологические исследования выполняли на базе патологоанатомического отделения ФГБУ «НМИЦ онкологии» Минздрава России, Ростов-на-Дону. Для фиксации материала использовали раствор 10%-ного нейтрального забуференного формалина с последующей автоматической проводкой в приборе Sakura Tissue-Tek xpress x 120. Далее приготавливали срезы толщиной 3–5 мкм. Гистологические препараты окрашивали гематоксилином и эозином. Иммуногистохимическое (ИГХ) исследование проводили на срезах с парафиновых блоков опухолей, предназначенных для стандартного морфологического исследования. Депарафинирование и регидратацию парафиновых срезов проводили в ксилоле и спиртах разной концентрации. «Демаскировку» антигенов осуществляли в PT-Link Thermo. Для ИГХ-исследования применяли протокол, опубликованный ранее [12]. Использовали поликлональные антитела к Ki-67 (Diagnostic BioSystems, в разведении 1:200), p16 (Ventana, RTU) и моноклональные мышиные антитела к pRB (клон BF0614) фирмы Affinity Biosciences, в разведении 1:100. Исследование проводили на автостейнере Thermo scientific 480S с применением системы детекции Reveal Polyvalent HRP-DAB Detection System. Оценивали процентное содержание окрашенных клеток опухоли при подсчете 100 опухолевых клеток в нескольких полях зрения. Оценку результатов иммуногистохимической реакции и гистологические исследования проводили с применением светового микроскопа «AxioLab.A1» (Германия) при увеличении объектива х20, х40.
Полученные данные обрабатывали с помощью пакета прикладных программ Statistica 13,0 (StatSoftInc., США). Изучаемые данные проверяли на соответствие нормальному распределению по критерию Шапиро–Уилка. В связи с тем, что первичные данные не подчинялись закону нормального распределения, сравнение групп проводили с помощью непараметрического критерия Манна–Уитни (U-критерий).
Результаты исследования и их обсуждение
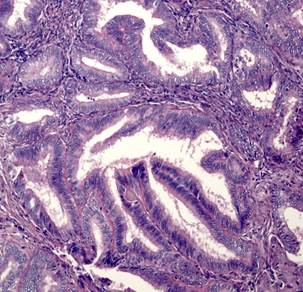
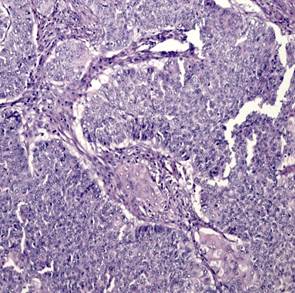
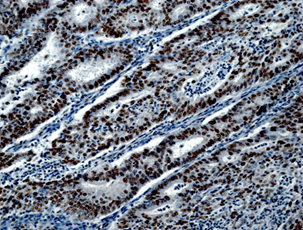
При гистологическом исследовании эндометриоидная аденокарцинома состояла из железистых или ворсинчато-железистых структур сложного строения с наличием тубулярных очагов. Железы были выстланы цилиндрическим эпителием. Цитоплазма была эозинофильной с разной степенью выраженности атипии. Опухоли чаще всего развивались на фоне гиперпластического эндометрия, миоматоза матки (рис. 1А). Морфологически в эндометриоидной аденокарциноме присутствовали типичные структуры аденокарциномы с наличием немногочисленных «округлых» образований из плоского эпителия, расцениваемых в литературе как морулы. Морулы состояли из округлых однородных клеток с овальными, центрально расположенными ядрами и мелкими одиночными ядрышками, заполняли просветы желёз, иногда располагались вокруг желёз. Изредка в морулах можно было видеть очаги некроза (рис. 1Б).
|
|
|
|
|
|
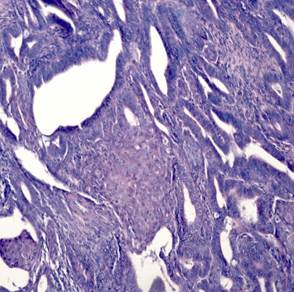
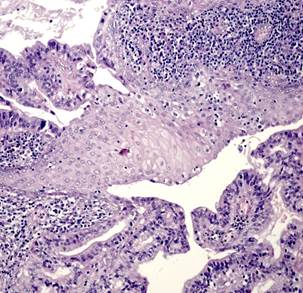
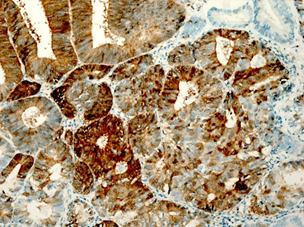
Рис. 1. Исследуемые гистотипы рака эндометрия. Окраска гематоксилином и эозином.
Ув. х200. А – Эндометриоидная аденокарцинома с наличием тубулярных очагов.
Б – Эндометриоидная аденокарцинома с наличием в морулах очагов некроза.
В – Эндометриоидная аденокарцинома с очагами плоскоклеточной метаплазии с участками кератинизации. Г – Плоскоклеточный рак эндометрия без ороговения с очагами кератинизации
Эндометриоидная аденокарцинома с плоскоклеточной метаплазией была представлена в виде обширных полей или рассеянных очагов плоскоклеточной дифференцировки, занимающих площади 20–50%, представленных диффузными очагами различной величины и формы. В очагах плоскоклеточной дифференцировки в карциномах в ряде случаев определяли кератинизацию в виде жемчужин. Очаги плоскоклеточной метаплазии наблюдали в средних отделах эпителиального опухолевого пласта, которые занимали не более 20–40% площади[C1] (рис. 1В). Клетки плоского эпителия в опухоли не были полностью дифференцированы, цитоплазма эозинофильная. Ядра однородные, ядрышки не визуализировались. Митозы редкие. В плоском эпителии присутствовали межклеточные мостики. В некоторых опухолях с диффузной плоскоклеточной дифференцировкой железы отсутствовали. Опухоли с цитологическими признаками плоскоклеточной дифференцировки занимали до 50% площади и состояли из гнезд веретенообразных клеток, которые маскировали просветы желёз. Отмечали атипию и единичные митозы. Опухоли развивались на фоне гиперпластического или смешанного эндометрия с миоматозным и аденомиозным поражением.
Плоскоклеточный рак был представлен типичными структурами (рис. 1Г), чаще с очагами кератинизации, отвечающими всем критериям плоскоклеточной карциномы и отличающимися от аденокарциномы с плоскоклеточной метаплазией распространением поражения на всю полость матки, глубокой инвазией в миометрий на фоне диффузного аденомиоза. Опухоль развивалась на фоне атрофичного эндометрия; наблюдали отсутствие желёз, наличие межклеточных мостиков и ороговения, развитие многослойного плоского ороговевающего или неороговевающего эпителия. Для многих опухолей были характерны угловатые инфильтрирующие гнезда неправильной формы с ядерным полиморфизмом и большим количеством патологических митозов. Также были выявлены анастомозирующие тяжи, между которыми располагалась воспалительная или десмопластическая строма. Во многих опухолях наблюдали лимфоваскулярную инвазию.
В результате иммуногистохимического исследования были проанализированы значения маркеров: Ki-67, p16, pRb. В таблице представлены обобщенные данные по иммуногистохимическому исследованию маркеров.
Сравнительные значения экспрессии маркеров в опухолях пациенток исследуемых групп
|
Уровень экспрессии % |
Группы больных |
||||||
|
Эндометриоидная аденокарцинома (I) (n=40) |
Эндометриоидная аденокарцинома с плоскоклеточной метаплазией (II) (n=31) |
Плоскоклеточный рак (III) (n=19) |
p-value |
||||
|
Me |
Q1–Q3 |
Me |
Q1–Q3 |
Me |
Q1–Q3 |
|
|
|
Ki-67 |
13 |
10,5–16 |
10,5 |
3–42,5 |
35 |
17–60 |
I-II = 0,617 *I-III = 0,046 **II-III = 0,002 |
|
p16 |
30 |
22,5–37,5 |
50 |
28,5–76,5 |
67,5 |
65–70 |
I-II = 0,059 *I-III = 0,020 II-III = 0,246 |
|
pRb |
41,5 |
35-47 |
43,5 |
23-60 |
19 |
7-37 |
I-II = 0,379 *I-III = 0,04 **II-III = 0,047 |
Примечание. * – отличия показателей статистически значимы между группами больных с эндометриоидной аденокарциномой и плоскоклеточным раком (р<0,05), ** – отличия показателей статистически значимы между группами больных с эндометриоидной аденокарциномой с плоскоклеточной метаплазией и плоскоклеточным раком (р<0,05) (U-критерий Манна–Уитни).
Результаты, приведенные в таблице, демонстрируют, что медианы значений экспрессии Ki-67 в клетках эндометриоидной карциномы и эндометриоидной аденокарциномы с плоскоклеточной метаплазией отличались невысокими значениями, тогда как в плоскоклеточном раке наблюдали рост количества окрашенных клеток с преобладанием значений экспрессии данного маркера. Таким образом, было установлено статистически значимое преобладание значений экспрессии Ki-67 в клетках плоскоклеточного рака в 2,7 раза по сравнению с эндометриоидной карциномой (p=0,046) и в 3,3 раза по сравнению с эндометриоидной аденокарциномой с плоскоклеточной метаплазией (p=0,002).
Медианы значений экспрессии p16 в клетках имели тенденцию к росту от эндометриоидной карциномы к плоскоклеточному раку. Экспрессия данного маркера увеличивалась с появлением плоскоклеточной метаплазии в 1,7 раза (p=0,059) и статистически значимо – в 2,3 раза (p=0,020) – непосредственно в плоскоклеточном раке. Отличия между эндометриоидной карциномой с плоскоклеточной метаплазией и плоскоклеточным раком оказались небольшими (в 1,3 раза) и поэтому статистической значимости не имели (p≥0,05).
В группах с эндометриоидной аденокарциномой медиана значений маркера pRb практически не имела отличий. А вот в группе с плоскоклеточным раком наблюдали резкое уменьшение экспрессии данного белка. Были установлены статистически значимые различия экспрессии pRb в опухоли между больными с эндометриоидной аденокарциномой и плоскоклеточным раком в 2,2 раза (p=0,046), а также между пациентками с эндометриоидной аденокарциномой с плоскоклеточной метаплазией и плоскоклеточным раком в 2,3 раза (p=0,047). При анализе полученных результатов было отмечено резкое снижение экспрессии pRb в группе с плоскоклеточным раком, что свидетельствует о более агрессивном развитии данной опухоли по сравнению с эндометриоидной аденокарциномой, имеющей плоскоклеточный компонент.
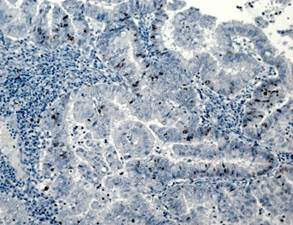
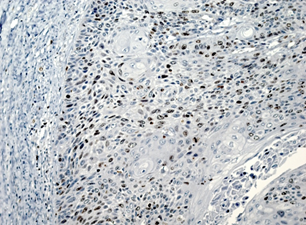
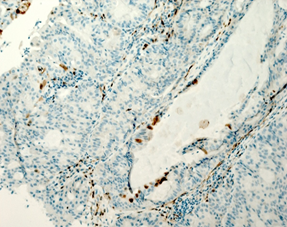
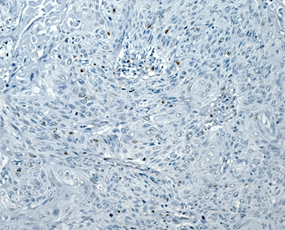
На рисунке 2 представлены различные варианты экспрессии вышеописанных маркеров в опухолях некоторых пациенток данного исследования.
|
|
|
|
|
|
|
|
|
Рис. 2. Иммуногистохимическая реакция с антителами к Ki-67, p16, pRb. А – низкий индекс пролиферации Ki-67 (эндометриоидная аденокарцинома с плоскоклеточной метаплазией). Б – высокий индекс пролиферации Ki-67 (плоскоклеточный рак). В – отсутствие экспрессии p16 в опухоли (эндометриоидная аденокарцинома). Г – экспрессия p16 +++ (эндометриоидная аденокарцинома с плоскоклеточной метаплазией). Д – отсутствие экспрессии pRb в опухоли (плоскоклеточный рак). Е – положительная экспрессия pRb в опухоли (эндометриоидная аденокарцинома). Ув. х200
Таким образом, получены результаты, демонстрирующие различия между эндометриоидной аденокарциномой, эндометриоидной аденокарциномой с плоскоклеточной метаплазией и плоскоклеточным раком эндометрия. Плоскоклеточный рак эндометрия имел отличия от аденокарциномы с плоскоклеточной метаплазией в виде отсутствия желёз, наличия ороговения и межклеточных мостиков, развития многослойного плоского эпителия и лимфоваскулярной инвазии. Данный тип отличался более высоким индексом Ki-67 (35%) и p16 (67,5%) с одновременным ингибированием pRb до 19% по сравнению с эндометриоидной аденокарциномой (Ki-67 – 13%, p16 – 30%, pRb – 41,5%), проявляя тем самым агрессивность и высокий опухолевый потенциал с неблагоприятным прогнозом, требующим серьезной коррекции адъювантных методов лечения. Наши данные согласуются с результатами исследования в зарубежной литературе, например с данными, представленными в статье L. Song с соавторами [13].
Эндометриоидной карциноме с плоскоклеточной метаплазией были присущи отдельные очаги кератинизации (от 20 до 50%); клетки с четкими границами, эозинофильной цитоплазмой и низким ядерно-цитоплазматическим соотношением, появлением очагов плоского эпителия. Достаточно высокий индекс p16 (50%) и pRb (43,5%) при небольшом коэффициенте Ki-67 (10,5%) повышает риск рецидивирования при плоскоклеточной дифференцировке. Полученные данные также согласуются с результатами исследований авторитетных клиницистов. Так, в публикации B. Ocak и соавторами [14] сообщается о наблюдении прогноза карциномы эндометрия с плоскоклеточной метаплазией и гиперэкспрессией антигена Ki-67 у пролеченных больных. В 47,0% случаев у больных в течение первых двух лет возникали рецидивы во влагалище и в 23,5% случаев – метастазы в легкие. В исследовании, проведенном D.A.P. Andrade [15], приводятся доказательства того, что плоскоклеточная метаплазия при раке эндометрия в 5,6 раза обладает повышенным риском рецидива в течение первых двух лет наблюдения.
Заключение. Таким образом, в результате проведенного морфологического и иммуногистохимического анализа были определены особенности плоскоклеточного рака эндометрия и эндометриоидной аденокарциномы с плоскоклеточной метаплазией в сравнении с эндометриоидной аденокарциномой, которые позволяют судить об агрессивности и более высоком опухолевом потенциале опухоли с наличием плоскоклеточного компонента. Полученные результаты помогут в дальнейшем индивидуализировать подход к лечению пациентов с тем или иным гистотипом.
Библиографическая ссылка
Шаталова С.В., Ульянова Е.П., Моисеенко Т.И., Непомнящая Е.М., Колесников Е.Н., Дурицкий М.Н. МОРФОЛОГИЧЕСКИЕ И НЕКОТОРЫЕ ИММУНОГИСТОХИМИЧЕСКИЕ ОСОБЕННОСТИ РАЗНЫХ ГИСТОТИПОВ РАКА ТЕЛА МАТКИ // Современные проблемы науки и образования. – 2023. – № 5. ;URL: https://science-education.ru/ru/article/view?id=32953 (дата обращения: 10.05.2024).