Рак толстой кишки (РТК) является одной из острых проблем современной онкологии. РТК занимает третье место по заболеваемости и второе – по смертности среди опухолей желудочно-кишечного тракта [1]. Согласно статистике, за 2018 год было зарегистрировано около 1,8 млн новых случаев [2], за 2020 год – более 1,9 млн случаев [1]. По прогнозам, к 2040 году число новых случаев РТК в мире достигнет 3,2 млн [3].
Несмотря на очевидный прогресс в развитии медицины и расширение возможностей лечения, включая эндоскопическое и хирургическое иссечение, химио-, иммуно-, лучевую и таргетную терапию, статистика показывает, что совершенствование методов лечения РТК и поиск новых терапевтических средств являются необходимыми для увеличения продолжительности жизни больных и улучшения ее качества при данном заболевании [3, 4].
Одной из ключевых точек при разработке современных противоопухолевых препаратов, помимо синтеза самого действующего вещества и создания лекарственной формы, является экспериментальное моделирование опухолевого процесса на лабораторных животных. Опухолевые мышиные модели используются на доклинической стадии исследования фармакологических субстанций для оценки противоопухолевой эффективности in vivo. Для получения результатов, которые бы максимально точно отражали ответ на медикаментозное лечение и повторяли клинические особенности онкозаболевания, наиболее подходящими моделями считаются ксенографты, полученные от пациента (PDX – patient-derived xenograft) [5]. Имплантация донорского материала может быть выполнена как гетеротопически, то есть подкожно или в не связанный с первоначальным местом расположения злокачественного новообразования орган, так и ортотопически, в гистологически соответствующий сайт. Второй вариант является более предпочтительным, поскольку имплантируемый материал помещается в естественную среду, в которой развивалась опухоль у человека, что необходимо для адекватного моделирования инвазии, роста и метастазирования ксенографта [6].
При создании PDX-моделей РТК также стоит учитывать различное эмбриональное происхождение разных частей толстой кишки, морфологические и гистологические отличия опухолей, сформировавшихся в различных отделах толстой кишки. Кроме того, в ряде исследований были продемонстрированы отличия восходящего (правостороннего) и нисходящего (левостороннего) отделов толстой кишки. Установлено, что клинические параметры, такие как прогноз, риск метастазирования, наличие или отсутствие мутаций, выраженность ответа на химиотерапию, зависят от локализации опухоли [7]. В связи с этим разработка и создание опухолевых моделей с учетом локализации злокачественного процесса представляются важной научной задачей.
Целью исследования стало создание различных вариантов ортотопических PDX-моделей РТК и сравнение методик их получения.
Материал и методы исследования
Для создания PDX-модели были взяты фрагменты первичных опухолей от трех пациентов с диагнозом РТК, обратившихся в ФГБУ «НМИЦ онкологии» Минздрава России в период с декабря 2021 года по февраль 2022 года, ранее не получавших химиотерапию. До проведения хирургической операции от всех пациентов было получено письменное информированное согласие на передачу биологического материала.
В качестве реципиентов были взяты самки мышей линии BALB/c Nude в возрасте 6–7 недель и массой тела 20–24,5 г (n=20). Все животные содержались в SPF-виварии в индивидуально вентилируемых клетках при температуре 21–23°С и влажности воздуха 40–70%. Световой день составлял 12 часов. Проавтоклавированные корм и вода предоставлялись животным ad libitum.
Для получения PDX-моделей РТК опухолевый материал транспортировали в стерильном контейнере с питательной средой для культуры клеток RPMI-1640 из оперблока в SPF-виварий ФГБУ «НМИЦ онкологии» Минздрава России. Далее от опухолевого образца отделяли некротические участки ткани и делили его на фрагменты размером 2×2×2 мм для осуществления имплантации в соответствующие ортотопические сайты. Длительность наблюдения за животным в эксперименте составляла 60 дней.
Перед имплантацией мышей вводили в наркоз: премедикация – «Рометар» («Bioveta, a. s.», Чешская Республика) в дозе 1,5 мл/кг, анестезия – «Золетил 100» («Virbac», Франция) в дозе 67,5 мг/кг. Все эксперименты выполняли в соответствии с «Правилами проведения работ с использованием лабораторных животных».
Результаты исследования и их обсуждение
Создание ортотопической опухолевой модели представляет собой важный инструмент для изучения рака толстой кишки, поскольку этот метод моделирования позволяет довольно точно имитировать события, которые происходят с тканями в ходе развития данного заболевания.
В ходе эксперимента по созданию различных вариантов ортотопической PDX-модели РТК была выполнена имплантация донорского опухолевого материала иммунодефицитным мышам линии BALB/c Nude в следующие сайты: слепую кишку, восходящую ободочную кишку, а также двумя различными способами в нисходящую ободочную кишку.
Для создания PDX-модели рака слепой кишки наркотизированным мышам выполняли лапаротомию с последующим выведением в операционную рану слепой кишки, наложением кисетного шва и рассечением серозно-мышечного слоя ее концевой части. Затем тупым пинцетом формировали углубление и в образовавшийся «карман» помещали фрагмент опухоли примерно 2×2×2 мм, после чего осуществляли его фиксацию путем затягивания лигатуры на слепой кишке мыши. Порядок проведения операции представлен на рисунке 1.
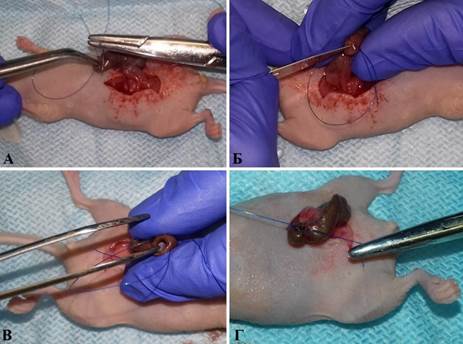
Рис. 1. Имплантации опухолевого фрагмента в слепую кишку мыши: А – выведение в операционную рану слепой кишки и наложение кисетного шва; Б – надсечение серозно-мышечного слоя в концевой части слепой кишки; В – имплантация фрагмента опухоли человека в сформированный в концевой части слепой кишки «карман»; Г – затягивание лигатуры на слепой кишке мыши
Слепая кишка мыши достаточно велика и легко доступна для лапаротомии, поэтому она является предпочтительным сайтом для ортотопических имплантаций, осуществляемых при помощи различных подходов. Например, в статье L.M.C. Georges с соавт. (2019) создание моделей РТК проводилось с использованием опухолевых культур клеток, которые вводились после срединной лапаротомии в стенку слепой кишки мыши [8]. Невзирая на то что имплантация опухолевой клеточной линии иммунодефицитным животным является традиционной моделью ксенотрансплантации, она имеет ряд недостатков: отсутствие исходной трехмерной архитектуры опухоли и гетерогенности. При культивировании поляризация клеток, отсутствие стромы, обилие факторов роста, питательных веществ и кислорода могут изменить поведение опухолевых клеток и их ответ на терапию, поэтому такие модели имеют ограниченную прогностическую ценность для исследований РТК человека [9]. Применение подхода с использованием фрагментов опухолей, полученных от пациентов для создания PDX-модели, способно преодолеть недостатки моделей, полученных при помощи инъекции клеточных линий.
Для получения PDX-модели рака восходящей ободочной кишки после лапаротомии в операционную рану выводили слепую кишку, а также восходящей отдел ободочной кишки. После этого надсекали серозный слой стенки кишечника, подшивали в область повреждения фрагмент опухоли и возвращали кишку в брюшную полость. Операционную рану послойно ушивали непрерывным обвивным швом (рис. 2).
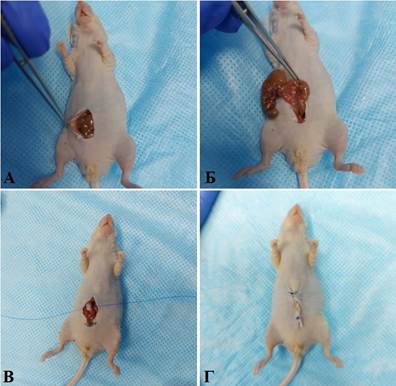
Рис. 2. Имплантации опухолевого фрагмента в восходящую кишку мыши: А – выполнение послойного рассечения кожи и тканей брюшной стенки; Б – выведение участка восходящей кишки в операционную рану; В – подшивание фрагмента опухоли к восходящей кишке мыши; Г – вид мыши после ушивания операционной раны
С учетом того факта, что восходящий и нисходящий отделы толстой кишки различаются в таких немаловажных аспектах, как прогноз, вероятность метастазирования, наличие мутаций, ответ на химиотерапию, задача по созданию модели восходящей ободочной кишки имеет важное научное значение. Анализ литературных данных показал, что при создании этого варианта модели значительная часть исследовательских групп использует метод инъекций клеточных линий рака кишки, характеризующийся рядом недостатков, описанных выше [8]. Преодолеть эти недостатки, как и при работе по моделированию рака слепой кишки, позволяет метод имплантации опухолевого фрагмента. Однако необходимо отметить, что в сравнении со слепой кишкой восходящая кишка является менее удобным объектом для хирургических манипуляций в силу меньшего диаметра просвета и более тонких стенок, что требует уверенного владения навыками экспериментальной хирургии.
Ортотопическая PDX-модель рака нисходящей ободочной кишки была получена двумя способами. В первом случае после срединной лапаротомии в операционную рану выводили прилегающую к передней брюшной стенки часть кишечника. С помощью анатомических пинцетов выделяли нисходящую кишку, производили продольное надсечение ее серозной оболочки и подшивали опухолевый фрагмент к нисходящей кишке мыши. Извлеченные части кишечника возвращали в операционную рану и послойно ее ушивали (рис. 3).
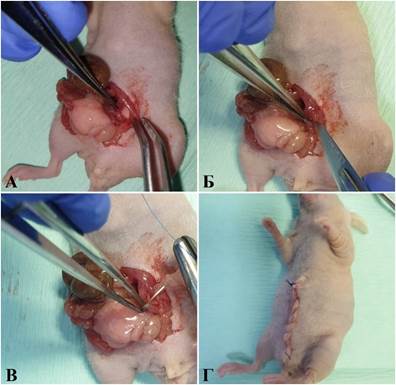
Рис. 3. Имплантации опухолевого фрагмента в нисходящую кишку мыши (доступ с вентральной стороны туловища): А – выведение участка нисходящей кишки в операционную рану; Б – надсечение серозно-мышечного слоя; В – подшивание фрагмента опухоли к нисходящей кишке мыши; Г – вид мыши после ушивания операционной раны
Представленный способ был оценен как не вполне удовлетворительный, так как для его осуществления потребовались выполнение большого по протяженности рассечения тканей и извлечение практически всех отделов кишечника из брюшной полости с последующим их возвратом, что увеличивает длительность процедуры и делает затруднительным выполнение работ с использованием большого количества животных.
Во втором случае разрез протяженностью 10–15 мм выполняли в пояснично-крестцовой области спины мыши. Через разрез выводили участок нисходящего отдела ободочной кишки, надсекали ее серозную оболочку и подшивали в области повреждения фрагмент опухоли человека. Операционную рану ушивали послойно (рис. 4).
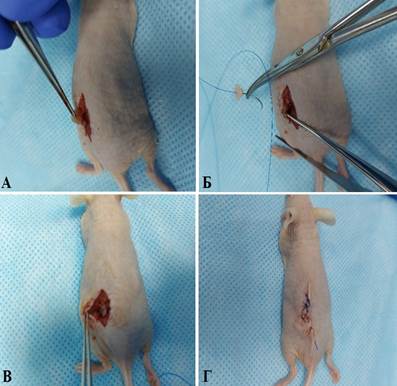
Рис. 4. Имплантации опухолевого фрагмента в нисходящую кишку мыши (доступ с дорсальной стороны туловища): А – выведение участка восходящей кишки в операционную рану; Б – подшивание фрагмента опухоли к восходящей кишке мыши; В – вид после подшивания фрагмента опухоли; Г – вид мыши после ушивания операционной раны
Этот способ имплантации опухолевого фрагмента в нисходящую кишку является более предпочтительны, по сравнению с предыдущим, так как характеризуется значительно меньшими временными затратами на его осуществление и меньшей травматичностью для лабораторных мышей (меньшая протяженность операционной раны, не выполняется извлечение кишечника из брюшной полости).
Особенностью ортотопической модели нисходящей кишки независимо от способа создания является повышенный риск возникновения непроходимости кишечника по сравнению с моделями опухолей других отделов толстой кишки (слепой, восходящей).
В ходе данного исследования не было зафиксировано случаев метастазирования, хотя различные варианты ортотопических моделей часто применяют для изучения основных механизмов метастатического прогрессирования, так как установлено, что имплантация опухолевого материала в ортотопические сайты и наличие соответствующей им сети кровеносных и лимфатических сосудов в большей степени способствуют процессу метастазирования, чем имплантация опухоли подкожно. Отсутствие метастазирования в ходе данного исследования, возможно, связано с незначительным метастатическим потенциалом первичной донорской опухоли или недостаточным временем наблюдения. Основные характеристики способов создания ортотопических PDX-моделей, представленных в данном исследовании, резюмированы в таблице.
Основные характеристики различных способов создания ортотопических PDX-моделей РТК
|
Способ создания ортотопической PDX-модели |
Технические особенности |
|
|
Имплантация фрагмента опухоли в слепую кишку |
· Наиболее легкодоступный и предпочтительный сайт для имплантации опухолевого материала · Дает возможность вывести слепую кишку из брюшной полости через лапаротомическую рану наружу для визуального наблюдения и манипуляций в течение довольно продолжительного времени (до нескольких дней) · Средний уровень сложности
|
· Требуется использование анестезии для лабораторных животных · Требуется использование специального оборудования или проведение лапаротомии для оценки динамики роста опухоли · Необходимо владение навыками экспериментальной хирургии
|
|
Имплантация фрагмента опухоли в восходящую ободочную кишку
|
· Относительно более высокий риск повреждения органа в связи с малым диаметром просвета кишки · Высокий уровень сложности |
|
|
Имплантация фрагмента опухоли в нисходящую ободочную кишку (способ 1) |
· Высокий риск развития кишечной непроходимости · Повышенный риск травмирования животного вследствие извлечения/возврата кишечника · Требует много времени · Наиболее сложный из всех представленных способов |
|
|
Имплантация фрагмента опухоли в нисходящую ободочную кишку (способ 2)
|
· Высокий риск развития кишечной непроходимости · Наименее времязатратный из всех представленных способов · Средний уровень сложности |
|
Заключение
На сегодняшний день в сфере точной медицины наблюдается растущая потребность в высокоспециализированных моделях рака. Ортотопическая PDX-модель является многообещающим инструментом как для фундаментальных исследований в области онкологии, так и доклинических испытаний новых противоопухолевых средств in vivo. Это особенно актуально для тестирования терапевтических соединений, мишенью которых являются факторы опухолевого микроокружения. Выполнение задач создания ортотопической PDX-модели РТК требует высокого уровня технического оснащения, а также наличия соответствующей квалификации персонала, что предполагает свободное владение навыками экспериментальной хирургии независимо от выбранного варианта моделирования опухолевого процесса.
Библиографическая ссылка
Гончарова А.С., Ходакова Д.В., Худына Ю.Е., Гусарева М.А., Зинькович М.С., Удаленкова И.А. ХАРАКТЕРИСТИКА СПОСОБОВ СОЗДАНИЯ ОРТОТОПИЧЕСКИХ PDX-МОДЕЛЕЙ РАКА ТОЛСТОЙ КИШКИ // Современные проблемы науки и образования. – 2023. – № 5. ;URL: https://science-education.ru/ru/article/view?id=32983 (дата обращения: 10.05.2024).



