Развитие медицины, разработка новых методов диагностики и лечения инфекционно-воспалительных заболеваний верхних дыхательных путей, появление современных противомикробных средств способствовали заметному снижению частоты внутричерепных осложнений у детей при ЛОР-патологии. Однако проблема гнойных менингитов отогенной и риносинусогенной этиологии на сегодняшний день остается очень актуальной [1, 2]. Согласно литературным данным, распространенность острых бактериальных менингитов в детской популяции на территории Российской Федерации составляет 4–6 случаев на 100 тыс. детского населения [3]. Среди всех внутричерепных осложнений (ВЧО) при воспалительной патологии среднего уха у детей гнойные менингиты занимают лидирующие позиции, составляя 46,4%, а при патологии придаточных пазух носа могут достигать 12,5% [4-6]. Для гнойных менингитов характерны высокие показатели летальности, которые в детской популяции могут составлять 3,7–10%, у детей младшего возраста при тяжелом течении – 45%, а в странах с ограниченными возможностями достигать 100% [7, 8]. В случаях же, заканчивающихся выздоровлением, данная патология может вести к формированию психоневрологического дефицита более чем в 50% случаев, что существенно ухудшает качество жизни этих пациентов, нарушая их социальную адаптацию [7, 9]. Высокие риски неблагоприятных исходов требуют не только своевременной диагностики вторичных гнойных менингитов, в том числе и отогенной/риносинусогенной этиологии, но и незамедлительного применения комплексных лечебных мероприятий, включающих адекватную системную противомикробную терапию (СПМТ), выбор которой зависит от знаний об этиологически значимых возбудителях данной патологии. Согласно литературным данным, при развитии вторичных гнойных отогенных/риносинусогенных менингитов (ВГОРСМ) наиболее часто встречаются типичные для отитов и риносинуситов патогены, такие как S.pneumoniae, другие представители Streptococcus spp., Staphylococcus spp., H. Influenzae [5, 10-13]. Однако ряд авторов указывают и на этиологическую значимость представителей порядка Enterobacterales, неферментирующих грамнегативных бактерий, анаэробов и других микроорганизмов [1, 5, 14]. При назначении противомикробных препаратов, согласно принципам проведения рациональной СПМТ, сформулированным российскими экспертами в данной области, следует обязательно учитывать уровень резистентности основных патогенов не только на территории Российской Федерации, но и в конкретном регионе, и в каждом лечебном учреждении, а также индивидуальные факторы риска наличия устойчивой микрофлоры [15, 16].
Цель исследования. Обобщить имеющиеся литературные данные об этиологических факторах ВГОРСМ, антибиотикорезистентности причинно-значимых микроорганизмов и характере СПМТ в детской популяции. Сравнить полученные данные с нашим опытом оказания медицинской помощи детям с ВГОРСМ в условиях детского оториноларингологического отделения ГБУЗ ТО «ОКБ № 2» за период с 2012 г. по 2022 г. и 7 месяцев 2023 г.
Материалы и методы исследования. Проведен литературный обзор научной литературы за последние 20 лет с использованием ресурсов поисковых систем PubMed, eLIBRARY, RusMed, MEDLINE по вышеуказанным ключевым словам. Для исследования использовались статьи, содержащие информацию об этиологии, антибиотикочувствительности выделенной микрофлоры при ВГОРСМ, характере СПМТ, исходах при данной патологии, в том числе и в детской популяции. Сравнили полученные результаты с опытом оказания медицинской помощи 13 пациентам с ВГОРСМ, находящимся на лечении в нашем стационаре, что составило 35,5% от общего количества всех детей с внутричерепными осложнениями (ВЧО) данной этиологии за изученный период. Под наблюдением находились 9 (69,2%) пациентов мужского и 4 (30,8%) – женского пола в возрасте от 5 месяцев до 14 лет (средний возраст – 5,6±1,4 года). Для включения пациентов в исследование была проведена оценка наличия острых воспалительных заболеваний среднего уха или придаточных пазух носа, сопровождающихся течением ВГОРСМ, подтвержденным с помощью клинико-лабораторных исследований, включая анализ спинномозговой жидкости (СМЖ), осмотр узких специалистов. Средние показатели плеоцитоза в СМЖ у наших пациентов составили 2475,1±871,4 клеток/мл, преимущественно нейтрофильного характера (2178,8±762,7 клеток/мл), что указывало на течение гнойного процесса. Для поиска первичного очага инфекции, а также для исключения возможных противопоказаний для люмбальной пункции проводились инструментальные методы исследования (компьютерная томография, магнитно-резонансная томография головного мозга). Были изучены результаты микробиологического исследования материала из операционной раны, ликвора, крови, характер оказания медицинской помощи, в том числе объем СПМТ. Исследование выполнено в соответствии с принципами Хельсинкской декларации. Протокол исследования одобрен комитетом по этике при ФГБОУ ВО Тюменский ГМУ Минздрава России (протокол № 115).
Результаты исследования и их обсуждение: ВГОРСМ являются наиболее частыми ВЧО среднего отита уха (34–77%), в том числе и в детской популяции, а при патологии придаточных пазух носа могут составлять 12,5% [4 – 6, 17].
Своевременная и эффективная СПМТ является одним из основополагающих факторов оказания медицинской помощи при гнойных менингитах различной этиологии у детей. Несвоевременное назначение либо выбор нерационального противомикробного препарата увеличивают риски неблагоприятных исходов. При подозрении на бактериальный гнойный менингит необходимо как более раннее введение антибактериального средства, так как задержка с назначением СПМТ у пациентов с бактериальным менингитом в значительной степени ассоциируется с неблагоприятным клиническим исходом [14, 18, 19]. В исследовании M. Glimåker et al. продемонстрировано, что задержка при назначении противомикробной терапии (более 2 часов после госпитализации) ведет к значительному увеличению риска летального исхода с относительным увеличением смертности на 12,6% на каждый час задержки и повышает вероятность осложнений при последующем наблюдении в 1,3 раза [20]. Большой вклад в раннюю диагностику внутричерепных осложнений при ЛОР-патологии, в том числе и гнойных менингитов, а также своевременное назначение адекватной СПМТ могут внести расчетные данные с определением индекса сдвига лейкоцитов (ИСЛ), который в настоящее время используется достаточно широко [21, 22, 23]. У наших пациентов расчетные показатели индекса сдвига лейкоцитов составили 4,5±0,8 (при референтных значениях – у детей в возрасте 1−5 лет – 1,1±0,2; старше 5 лет – 1,9±0,3) [21]. Согласно данным Н.Е. Кузнецовой и соавт., у детей с инфекционно-воспалительной патологией органа слуха или придаточных пазух носа с высокой долей вероятности прогнозируется развитие отогенных или риносинусогенных внутричерепных осложнений при ИСЛ ≥3,98 или ≥4,5 соответственно [24, 25].
При выборе эмпирической СПМТ при ВГОРСМ в первую очередь необходимы знания об основных возбудителях данной патологии, так как микрофлора является одним из факторов, определяющих течение инфекционно-воспалительного процесса и эффективность его лечения. Общеизвестно, что наиболее частым возбудителем вторичных менингитов при ЛОР-патологии как у взрослых, так и у детей является S.pneumoniae [5, 10–13, 26], составляя, по некоторым данным, до 75% положительных результатов микробиологического исследования СМЖ, материала из среднего уха и придаточных пазух носа. Для инфекций пневмококковой этиологии характерны молниеносное развитие процесса, тяжелое течение, высокие показатели летальности, связанные с развитием жизнеугрожающих внутричерепных осложнений в остром периоде заболевания (церебральные васкулиты, инфаркты – 5–28,6%), с тяжелыми инвалидизирующими последствиями в исходах у выживших пациентов в 40–70% случаев (например, сенсоневральная тугоухость может развиваться у 40% пациентов) [27]. При этом необходимо учитывать, что вакцинация способна влиять на этиологический фактор внутричерепных осложнений и на эффективность СПМТ. Так, внедрение во многих странах мира, а в 2000 году и на территории Российской Федерации в практику 7-валентной конъюгированной вакцины (ПКВ 7 – превенар), обеспечивающей активную иммунизацию против заболеваний, вызванных S.pneumoniae серотипов 4, 6B, 9V, 14, 18C, 19F и 23F, привело к появлению особо агрессивного штамма S. рneumoniae серотипа 19А, характеризующегося множественной антибиотикорезистентностью [28]. Согласно же данным, приведенным в работе B. Skotnicka, лидирующие позиции в качестве этиологического фактора развития ВГОРСМ (до 39%) может занимать H. Influenzae [17]. Обязательные вакцинации против гемофильной и пневмококковой инфекций, входящие в Национальный календарь профилактических прививок в РФ с 2011 г. и 2014 г. соответственно [29, 30], существенно изменили этиологическую структуру средних отитов, риносинуситов у детей и их осложнений, что необходимо учитывать при выборе препаратов для эмпирической СПМТ при ВГОРСМ [27, 31]. Ряд авторов указывают на этиологическую значимость представителей порядка Enterobacterales, неферментирующих грамнегативных бактерий, таких как P.aeruginosa, анаэробов (Prevotella spp., Peptostreptococcus spp., Fusobacterium spp.) и других микроорганизмов [1, 5, 14, 17]. Из представителей порядка Enterobacterales, согласно литературным данным, лидирующие позиции занимает P.mirabilis [1, 17]. В исследовании H. Jiang et al. продемонстрировано, что ведущим грамнегативным возбудителем при гнойных менингитах у детей младшего возраста является E.coli, составляя 28,5% всех положительных результатов [26]. Известно, что такие патогены, как S.aureus, S.pyogenes, P.aeruginosa, E.coli, K.pneumoniae, H.Influenzae, увеличивают вероятность тромботических осложнений. Данные микроорганизмы запускают каскад системной воспалительной реакции с высвобождением цитокинов ИЛ-6, ИЛ-8 и фактора некроза опухоли альфа (ФНО-α), что ведет к повреждению эндотелия, активации и агрегации тромбоцитов, увеличению активности прокоагулянтных белков, таких как тканевой фактор, и снижению действия антикоагулянтных механизмов, таких как фибринолиз [32–34]. При этом сами патогены часто способны модулировать систему свертывания крови путем выработки прокоагулянтных белков [32, 34]. Считается, что системные инфекции увеличивают риск тромбоза глубоких вен / тромбоэмболии легочной артерии примерно в 2–20 раз [32].
Менингит, вызванный Enterococcus spp., встречается редко, на его долю приходится всего от 0,3% до 4% случаев бактериального менингита, однако для него характерны высокие показатели летальности (от 10 до 58%).Чаще всего эта патология описывается у нейрохирургических пациентов, в последние годы отмечаются случаи заболевания, развивающиеся, главным образом, у пациентов с дисфункцией иммунной системы [35–37]. В работе V. Pintado et al. продемонстрировано, что в детской популяции в 56,5% случаев энтерококковый менингит развивается после нейрохирургических вмешательств, в остальных случаях – спонтанно [35].
В нашем исследовании в ходе оперативного вмешательства у всех детей для микробиологического исследования был взят биологический материал из первичного очага, также для исследования забиралась спинномозговая жидкость, по показаниям – кровь. Первые результаты были получены в среднем на 4±0,45 сутки, в 52,9% случаев они были отрицательными, что затрудняло выбор эффективной СПМТ. Анализ положительных результатов микробиологического исследования представлен на рисунке.
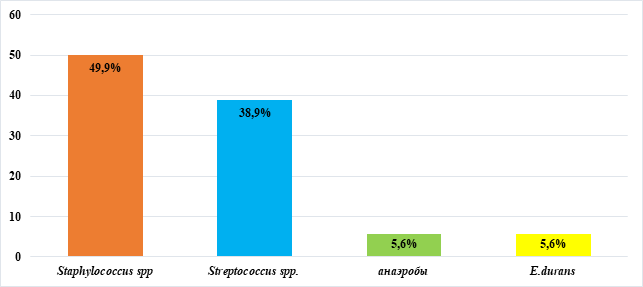
Микробный пейзаж при ВГОРСМ у детей
Из выделенной микрофлоры лидирующие позиции (49,9%) заняли Staphylococcus spp. (S.epidermidis, S.aureus). Из представителей Streptococcus spp. преобладал S.pneumoniae, генетический материал (ДНК) которого в 75% случаев также обнаруживался методом полимеразной цепной реакции (ПЦР) в СМЖ. В единичных случаях высевался E.durans, относящийся к условно-патогенной микрофлоре толстого кишечника. Анаэробная микрофлора была представлена Peptostreptococcus spp.
При выборе СПМТ при ВГОРСМ необходимо учитывать и проницаемость гематоэнцефалического барьера (ГЭБ) для антибактериальных препаратов. Известно, что по уровню проникновения противомикробных средств через ГЭБ они подразделяются на три группы: первая – препараты, характеризующиеся хорошим проникновением, к ним относятся фторхинолоны, линезолид, хлорамфеникол, метронидазол, эти средства можно использовать в стандартных дозировках. Фторхинолоны, несмотря на хорошее проникновение через ГЭБ, в педиатрической практике противопоказаны и могут назначаться только при жизнеугрожающих состояниях при отсутствии альтернативных средств ввиду риска развития артропатий [38–40]. Хлорамфеникол при инфекциях центральной нервной системы относится к резервным препаратам из-за большого набора нежелательных лекарственных реакций, может быть назначен только при документированной анафилактической реакции на β-лактамные антибиотики [40]. Линезолид – бактериостатический препарат, активный в отношении S.aureus, коагулазонегативных стафилококков, в том числе и метициллин-резистентных штаммов, Streptococcus spp., включая пенициллин-резистентные штаммы, Enterococcus spp., включая ванкомицин-резистентные штаммы, что делает его резервным для борьбы только с проблемной грампозитивной микрофлорой [10, 38, 40].
Ко второй группе относятся антибиотики с умеренным проникновением, однако проницаемость ГЭБ для препаратов увеличивается при использовании максимальных дозировок без выраженных рисков развития нежелательных лекарственных реакций. В эту группу входят β-лактамные антибиотики (пенициллины, цефалоспорины, карбапенемы), фосфомицин, сульфометаксазол/триметоприм.
Третья группа представлена противомикробными средствами с плохим проникновением через ГЭБ, а при увеличении доз повышается вероятность развития побочных эффектов (аминогликозиды, ванкомицин, полимиксины, даптомицин, тигециклин) [41].
Большинство авторов при ВГОРСМ в качестве стартовых препаратов рекомендуют цефалоспорины 3–4-го поколений (цефтриаксон, цефотаксим или цефепим) в сочетании (при наличии абсцесса) с антианаэробными препаратами – метронидазолом либо клиндамицином [10, 38, 42–44]. Из представителей цефалоспоринов 3-го поколения предпочтение при внутричерепных осложнениях необходимо отдавать цефтриаксону, что связано с отсутствием у данного препарата рисков развития судорожного синдрома, характерного для цефотаксима (с частотой 0,1–1% случаев) [39, 40]. Цефепим, цефалоспорин 4-го поколения, обладает хорошей активностью в отношении не только Streptococcus spp. и метициллин-чувствительных штаммов Staphylococcus spp., но и природно более активен в отношении представителей порядка Enterobacterales, чем цефалоспорины 3-го поколения, проявляет активность и в отношении такого неферментирующего грамнегативного микроорганизма, как P. aeruginosa [10, 39, 40]. Несмотря на плохое проникновение через ГЭБ, ванкомицин, согласно существующим рекомендациям, следует добавлять к цефалоспоринам 3–4-го поколений при наличии рисков пенициллин-резистентных штаммов S.рneumoniae [10, 14, 45]. При выборе противомикробного средства для терапии ВГОРСМ необходимо помнить, что антибиотики, хорошо или умеренно проникающие через ГЭБ, весьма эффективны только на стадии раннего и позднего церебрита, но их активность снижается на стадии формирования капсулы из-за невозможности создать адекватную терапевтическую концентрацию антибиотика в полости абсцесса [13]. Препаратом выбора для воздействия на анаэробную флору (Bacteroides spp.,Fusobacterium, Peptostreptococcus spp., Prеvotella loescheii), что наблюдалось в нашем исследовании, является метронидазол, характеризующийся бактерицидным эффектом даже в отношении штаммов, устойчивых к другим антианаэробным препаратам [10, 38, 39]. По уровню проникновения через ГЭБ он относится к первой группе и при внутричерепных осложнениях может использоваться в стандартных дозировках [41]. С учетом полимикробной этиологии ВГОРСМ при назначении эмпирической антибактериальной терапии метронидазол обычно комбинируют с цефалоспоринами 3–4-го поколений [10, 38, 39]. Бактерицидной антианаэробной активностью обладают и карбапенемы (меропенем, имипенем/циластатин, эртапенем, дорипенем, биапенем), они могут рассматриваться как антибиотики первой (в отношении Bacteroides fragilis) или второй линии (в отношении Fusobacterium, Peptostreptococcus spp., Prеvotella loescheii) ввиду высокой активности in vitro и доказанной клинической эффективности [10, 39]. Однако, согласно официальным инструкциям на препараты, при инфекциях ЦНС разрешается только меропенем [40].
При выборе СПМТ необходимо учитывать не только международные данные по антибиотикорезистентности основных патогенов ВГОРСМ, но и данные по их устойчивости на территории Российской Федерации, конкретно в каждом регионе, а также индивидуальные факторы риска наличия устойчивой микрофлоры [15, 16]. По данным Z. Alamarat et al., резистентность основного возбудителя гнойных менингитов S.pneumoniae к пенициллину в последнее время во всем мире увеличивается с частотой от 30% во Франции и Испании до менее 3% в северных странах [19]. В исследовании Sh. Ben-Shimol et al. показано, что средняя доля менингитов, вызванных пенициллин-резистентными штаммами пневмококков у детей младшего возраста, после внедрения пневмококковой конъюгированной вакцины снизилась на 83,9% и составила 9,6±7,4% в сравнении с 40,5±8,0% до введения обязательного вакцинирования. Менингиты, вызванные пневмококками, устойчивыми к цефтриаксону, до введения вакцинирования составили 5,0±0,8%, после введения изолятов, устойчивых к цефтриаксону, выявлено не было [46]. Однако в работе H. Jiang et al. показаны более низкие уровни чувствительности S. pneumoniae, которые составили к пенициллину и цефтриаксону 68,8 и 81,3% соответственно [26]. По результатам многоцентровых исследований, проведенных на территории РФ, штаммы S.pneumoniaе и H.influenzae, выделенные у пациентов с инфекциями дыхательных путей и ЛОР-органов, сохраняли, по критериям EUCAST (Рекомендации «Определение чувствительности микроорганизмов к антимикробным препаратам. Версия 2021–01»), ≥92,8% и 100% чувствительность к цефалоспоринам 3-го поколения соответственно. Аналогичной активностью обладал и цефалоспорин 4-го поколения цефепим [16, 47]. В работе С.М Мирзаханова и соавт. продемонстрировано, что штаммы S.pneumoniaе, выделенные из мокроты детей с инфекциями нижних дыхательных путей, сохраняли хорошую чувствительность к пенициллинам, цефотаксиму, цефтриаксону, которая составила в среднем 99,6±0,4%, 92,9±3% и 97,1±1,9% соответственно [48]. В исследовании авторов данной статьи все штаммы Streptococcus spp., выделенные из биологического материала при ВГОРСМ, обладали хорошей чувствительностью ко всем титруемым В-лактамным антибиотикам (пенициллинам и цефалоспоринам 3–4-го поколений). Необходимо помнить, что, согласно рекомендациям «Определение чувствительности микроорганизмов к антимикробным препаратам. Версия 2021-01», S.aureus и другие представители Staphylococcus spp. могут быть чувствительны к цефалоспоринам 3-го поколения (цефотаксиму, цефтриаксону) только при увеличении их экспозиции, т.е. высокая вероятность эффективности препаратов достигается путем коррекции режима их дозирования. Исходя из этого, цефалоспорины 3-го поколения не являются препаратами выбора при инфекциях, вызванных Staphylococcus spp. [10, 38, 39]. Поэтому при подозрении на стафилококковую этиологию ВГОРСМ к цефотаксиму и цефтриаксону добавляют ванкомицин. Это связано и с тем, что в последние годы отмечается нарастание резистентности стафилококков к другим титруемым антибиотикам [10, 39]. В исследовании H. Jiang et al. продемонстрировано, что штаммы Staphylococcus spp., выделенные у детей с гнойными менингитами, были чувствительны к оксациллину и гентамицину в 30,6 и 77,8% случаев соответственно [26]. В нашем исследовании ситуация с Staphylococcus spp. была более благоприятной (в 88,9% высевались оксациллин-чувствительные штаммы).
При выборе противомикробного препарата необходимо учитывать его активность и в отношении представителей порядка Enterobacterales (E.coli, Protes spp., Enterobacter spp. и др.), поскольку, согласно литературным данным, они могут играть роль в развитии ВГОРСМ [1, 5, 14]. В настоящее время отмечается рост устойчивости штаммов энтеробактерий, вызывающих внебольничные инфекции. По данным электронной платформы AMRmap, резистентность внебольничных штаммов Enterobacterales, выделенных у пациентов всех возрастных групп с инфекциями ЦНС, в нашей стране за период 2016–2021 гг. составила к ампициллину – 66,7%, амоксициллин/клавуланату – 55,6%, гентамицину, цефалоспоринам 3–4-го поколений – по 33,3%, колистину – 22,2%, пиперациллину/тазобактаму и фосфомицину – по 11,1%. Максимальную активность в отношении этих микроорганизмов проявили только карбапенемы, амикацин, цефтазидим/авибактам, тигециклин, цефтолозам/тазобактам [13]. Однако, согласно официальным инструкциям, цефтазидим/авибактам, тигециклин и цефтолозам/тазобактам не рекомендованы для терапии инфекций центральной нервной системы [40]. В нашем исследовании эти микроорганизмы не являлись этиологическим фактором развития ВГОРСМ.
Ввиду ограниченного выбора противомикробных средств, природно активных в отношении Enterococcus spp., и ввиду увеличения частоты штаммов с приобретенной устойчивостью обязательным условием оказания медицинской помощи при ВГОРСМ данной этиологии является учет локальных данных по его антибиотикорезистентности. По данным электронной платформы AMRmap, резистентность штаммов Enterococcus spp., выделенных у пациентов всех возрастных групп с инфекциями ЦНС на территории Российской Федерации за период 2002–2021 гг., составила к ампициллину – 35,1%, гентамицину – 51,4%. Минимальная устойчивость энтерококков наблюдается к ванкомицину и к линезолиду [40]. В исследовании, проведенном авторами статьи, были получены аналогичные данные, чувствительность к ампициллину и гентамицину была в среднем на уровне 66,7%, к ванкомицину – 100%.
С учетом нарастания устойчивости причинно-значимых в развитии ВГОРСМ микроорганизмов большинство авторов указывают на альтернативную цефалоспоринам 3–4-го поколений терапию меропенемом, разрешенным в педиатрической практике с 3-месячного возраста [13, 14, 39]. По данным проспективного рандомизированного исследования, меропенем характеризуется высокой клинической эффективностью при менингите, сопоставимой с таковой цефотаксима и цефтриаксона, и даже превышает активность цефалоспоринов, включая препараты 4-го поколения [49, 50].Меропенем и имипенем/циластатин являются единственными карбапенемами, по которым имеются исследования в педиатрической популяции.Имипенем/циластатин достигает более высоких концентраций в ликворе, однако предпочтение отдается меропенему из-за меньшего риска развития судорожного синдрома у детей с менингитом. Однако в отсутствие воспаления ЦНС этот побочный эффект не имеет клинического значения [39].
Анализ СПМТ наших пациентов с ВГОРСМ вывил, что в 61,5% случаев терапию начинали с таких В-лактамных антибиотиков, как ингибиторзащищенные аминопенициллины (ампициллин/сульбактам), цефалоспорины 3–4-й генераций (цефтриаксон, цефотаксим, цефепим). Однако во всех случаях при верификации диагноза менингита, с учетом тяжести состояния пациентов, высоких рисков неблагоприятных исходов, полиморфизма, согласно литературным данным, этиологически значимых микроорганизмов, вероятности отсроченного получения результатов микробиологического исследования, проводили коррекцию СПМТ (переход на меропенем) либо комбинацию цефепима с метронидазолом. При высеве метициллин-резистентных штаммов Staphylococcus spp. или ампициллин-устойчивых штаммов Enterococcus spp. в терапию добавляли ванкомицин [10]. В 38,5% случаев ВГОРСМ СПМТ начиналась с меропенема ввиду того, что эти пациенты переводились из других лечебных учреждений, где они уже получали стартовую терапию меропенемом либо другими антибактериальными средствами. При стабилизации состояния в 53,8% случаев вновь переходили на препараты более узкого спектра действия (цефтриаксон, ампициллин/сульбактам). Антибактериальная терапия у наших детей с ВГОРСМ в среднем продолжалась 18,3±1,2 дня, что не противоречит современным клиническим рекомендациям [10, 39]. На фоне ранней диагностики, своевременного и адекватного хирургического вмешательства, рациональной СПМТ у всех пациентов с ВГОРСМ была отмечена выраженная положительная динамика и все дети были выписаны из стационара с улучшением, без психоневрологического дефицита. Летальных исходов не наблюдалось. Средний койко-день составил 20,6±2,5.
Исходя из всего сказанного, эффективность СПМТ при ВГОРСМ у детей зависит от многих факторов, таких как своевременность, знание о наиболее значимых при данной патологии возбудителях, учет не только международных, но и региональных особенностей антибиотикорезистентности, наличие информации о способности антибактериального средства проникать через гематоэнцефалический барьер. Все это позволяет минимизировать риски неблагоприятных исходов.
Заключение. Своевременная диагностика, четкая тактика оказания медицинской помощи, включая выбор эффективной СПМТ с ранним использованием деэскалационных схем, позволяют минимизировать риски неблагоприятных исходов при ВГОРСМ у детей.
Библиографическая ссылка
Вешкурцева И.М., Кузнецова Н.Е., Извин А.И., Кудымов С.А., Постой С.С., Пономарева М.Н. ПРОТИВОМИКРОБНАЯ ТЕРАПИЯ КАК ОСНОВА ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ ПРИ ВТОРИЧНЫХ ГНОЙНЫХ МЕНИНГИТАХ У ДЕТЕЙ // Современные проблемы науки и образования. – 2023. – № 5. ;URL: https://science-education.ru/ru/article/view?id=33005 (дата обращения: 10.05.2024).



