Большой интерес представляют аналоги природных биологически активных веществ, которые обладают собственной флуоресценцией, чувствительной к изменению условий внешней среды. К ним принадлежат кумарины с бензодиоксановыми фрагментами, изредка встречающиеся в растениях различных семейств. Например, соединение В и метиловый эфир пропацина встречаются в семействе Jatropha glandulifera (Euphorbiaceae), Дафнетицин – Daphne tangutica (Thymelaceae), Пропацин – Protium opacum (Burseraceae), Клеомискозин А – Cleome viscosa (Capparidaceae), Клеомискозин С (аквиллохин) и Клеомискозин D – Aquillaria agallocha (Thymelaeaceae), Молуцканин – Aleurites moluccana (Euphorbiaceae) и другие [5].
3-Арильные кумарины являются антикоагулянтами, среди них найдены вещества с антибактериальной, антифунгицидной, антиатеросклеротической и антилептической активностями. Строение этих кумаринов было изучено благодаря значительным успехам последних лет в структурном анализе кумариновых соединений и в большей степени обусловлены применением современных физико-химических методов, особенно ядерного магнитного резонанса на ядрах 1Н и 13С.
В ходе систематических структурных исследований различных лигноидов выявляются закономерности, которые применимы для всего этого класса природных соединений. В особенности это касается таких современных спектральных методов, как ЯМР 1Н-, 13С – спектроскопия и масс-спектрометрия (техника INEPT).
Данные масс-спектров вышеперечисленных соединений показывают большое сходство фрагментации кумаринолигноидов. В масс-спектрах эти вещества показывают пики ионов с m/z 180, 162, 151, 137 и 124, которые доказывают наличие в молекуле остатка кониферилового спирта или его производных. Здесь анализ спектральных данных позволяет сделать выводы, что фрагментация производных кумаринов идет с образованием интенсивных пиков ионов (М-Х) [1].
Рассмотрение вопросов структурного анализа кумаринолигнанов свидетельствует о том, что при решении структуры тех веществ, в молекуле которых содержится 1,4-диоксановое кольцо, обязательны не только спектральные методы, химические превращения, синтезы, но и их расщепления исходных соединений и модельных образцов.
Это удобные объекты для проведения химических модификаций, но их синтетические модели с точки зрения масс-спектра до сих пор не были изучены.
Масс-спектрометрия полифенольных соединений, и в частности флавоноидов, дополняет информацию, получаемую другими спектральными методами исследований, и позволяет оценить, каким образом отдельные структурные фрагменты соединены друг с другом в составе молекулы. Кроме того, по данным масс-спектра можно сделать вывод относительно размера и структуры боковых радикалов, что трудно установить химическими методами.
Неофлавоноиды [4] имеют специфическую схему фрагментации, пригодную для идентификации этих соединений, в отличие от флавоноидов других типов.
Поэтому целью нашей работы явилось охарактеризовать возможные пути фрагментации синтетической модели 3-арил-кумарина с 1,4-бензодиоксановым фрагментом (4) [3, 7, 8] с помощью масс-спектра.
Экспериментальная часть. Контроль за ходом реакции и определение индивидуальности синтезированного соединения (4) осуществляли методом ТСХ на пластинках Silufol UV-254 (элюент: бензол – этанол, 9 : 1). Температуру плавления определяли на приборе ПТП (Россия). Исходные соединения гетероарилацетонитрил (2), гетероарилуксусная кислота (3) синтезированы и охарактеризованы, как описаны в работах [6, 10]. Все остальные реактивы производства Реахим (Россия) и ЗАО «Ximreaktivkomplekt» (Узбекистан).
Методика синтеза 3-(2, 3-дигидробензо [1,4] диоксин-6-ил)-хромен-2-он (4) [3, 7, 8]. Смесь 10 ммоль гетероарилацетонитрила (2) или гетероарилуксусной кислоты (3), 10 ммоль салицилового альдегида (1), 0,12 мл пиперидина и 10 мл 95% этанола кипятили в течение 4-6 ч. (В случае гетероарилацетонитрила реакционную смесь гидролизовали 5 мл 2 н. соляной кислотой в течение 1 ч.) После охлаждения осадок отфильтровывали и промывали 1 % водным раствором NaHCO3. Остаток кристаллизовали из этилацетата (схема 1).
Выход 25 %. Т.пл. 190-1910С. Rf 0,44. С17Н12О4.
Масс-спектрометрия (LC-MS). Масс-спектрометрическое исследование синтезированного нового кумарина (4) проводили на приборе Q-TOF LC-MS Agilent Technologies серии 6520В в следующих условиях: источник ионизации – ESI+; поток осушающего газа – 5 л/мин; температура осушающего газа – 300°C; напряжение на конуса скиммера – 20V; на фрагменторе – 125V; диапазон масс – в режиме MS 100 – 400 m/z, а в режиме Targeted MS/MS 25 – 400 m/z; энергия столкновения (collision energy) – 65. Способ ионизации: положительный. Образец вводили в масс-спектрометр с помощью хроматографа фирмы Agilent Technologies серии 1200, колонка Zorbax SB C18, 3 µm, 0,5x150 мм. Мобильная фаза: А – 0,1 % раствор муравьиной кислоты, В – ацетонитрил + 0,1 % муравьиная кислота. Элюцию осуществляли на приборе Agilent Technologies серии 1260 Cap Pump при скорости потока 15 мкл/мин в изократическом режиме – 90 % раствора В. Растворы дегазировали на приборе Agilent Technologies 1260 µ-degasser. Образец наносили в колонку с помощью прибора Agilent Technologies Micro WPS по 1 мкл.
Результаты и их обсуждение. Соединение (4) синтезировано в результате модифицированного метода в условиях конденсации Кневенагеля в присутствии спирта и пиперидина (схема 1) [3, 7, 8]. Полученный кумарин (4) – бесцветное кристаллическое вещество, хорошо растворим в большинстве органических растворителях и нерастворим в воде. Он легко обнаруживается по голубой флуоресценции в УФ-свете.
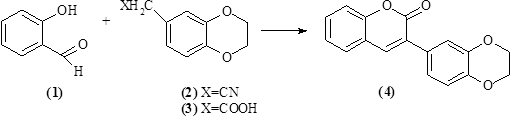
Схема 1. Синтез соединения (4)
1 – салициловый альдегид, 2 – гетероарилацетонитрил, 3 – гетероарилуксусная кислота.
Заболеваемость туберкулезом, несмотря на широту осуществляемых лечебных и профилактических мероприятий, растет, причем увеличивается число случаев лекарственно-устойчивого туберкулеза [2]. В связи с этим представляет интерес поиск новых противотуберкулезных средств, из числа ранее не использованных классов соединений. Так, синтезированный нами новый 3-арил-кумарин с 1,4-бензодиоксановым фрагментом (4) был исследован на антимикобактериальную активность против M. Tuberculosis, которая проводилась совместно с Southern Research Institute, Birmingham в рамках Антитуберкулезной программы «Tuberculosis Antimicrobial Acquisition & Coordinating Facility», USA. Первичный скрининг антимикобактериальной активности проводился in vitro. Для анализа минимальной ингибирующей концентрации (МИК) использовали образцы в концентрации 6,25 мкг/мл против Micobacterium tuberculosis H37Rv (ATTCC 27294) на среде BACTEC 12B, используя микроплаcтины Alamar Blue Assay (MABA). Флуоресценцию составов определяли на радиометрической системе BACTEC 460, эффективность ингибирования выражали в %. В результате исследований обнаружено, что соединение (4) проявил 49 % противотуберкулезную активность.
Масс-спектрометрическое исследование синтезированного вещества (4) в режиме MS показало, что m/z молекулярного иона составляет 281,083. Далее в режиме Targeted MS/MS при энергии столкновения (collision energy) – 35, 65 из молекулярного иона образовались вторичные фрагменты положительных ионов с m/z 181, 165, 152, 141, 127, 115, 77 (рис. 1, схема 2).
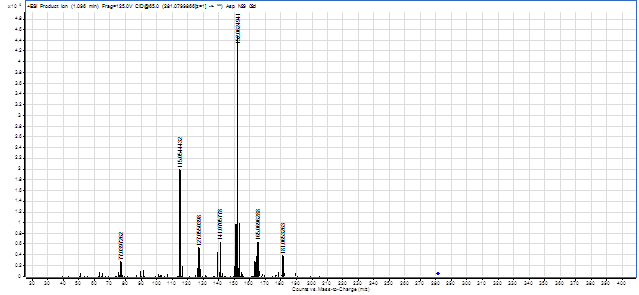
Рис.1. Масс-спектр соединения (4)
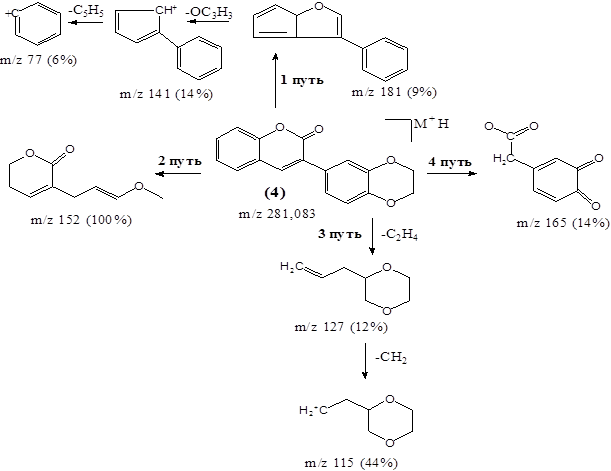
Схема 2. Возможные пути масс-спектрометрического распада соединения (4)
Из-за термической неустойчивости масс-спектрометрические исследования флавоноидов проводят на их силиловых эфирах. Для большинства флавоноидных агликонов основным сигналом в спектрах является сигнал М+, затем (М-СО)+, а фрагментация идет по двум основным путям [9]. В нашем случае, как видно из схемы 2, фрагментация идет по четырем (1, 2, 3, 4) направлениям.
Расщепление кумарина (4) по первому направлению фрагментации молекулярного иона идет с образованием вторичного иона с m/z 181, который далее распадается с образованием дочерних ионов с m/z 141 и 77. По второму направлению из молекулярного иона образуется фрагмент с m/z 152, а по третьему фрагмент с m/z 127. В дальнейшем из последнего образуется осколок с m/z 115. Четвертое направление характеризуется образованием фрагмента с m/z 165. Следует отметить, что фрагмент с m/z 181 более интенсивный, чем другие фрагменты, что также служит доказательством достройки фуранового цикла.
Таким образом, с помощью масс-спектрометрического анализа нами охарактеризованы четыре возможных путей фрагментации с образованием боковых радикалов синтетической модели 3-арил-кумарина с 1,4-бензодиоксановым фрагментом (4). Показано, что данные положительных ионов, образующихся в процессе фрагментации исследуемого соединения (4), дополняют друг друга.
Авторы выражают благодарность Ж.Ф. Зиявитдинову за проведение масс-спектров.
Рецензенты:
Зияев Х.Л., д.х.н., старший научный сотрудник лаборатории полифенолов Института биоорганической химии им. акад. А.С. Садыкова АН РУз, г. Ташкент.
Саитмуратова О.Х., д.б.н., профессор, ведущий научный сотрудник лаборатории биорегуляторов Института биоорганической химии им. акад. А.С. Садыкова АН РУз, г. Ташкент.



