Введение
Очистку отходящих газов от кислотных компонентов обычно проводят их абсорбцией содовым раствором [1]. В результате очистки образуются разбавленные нейтрализованные растворы, концентрирование которых неизбежно связано с большими затратами тепла на упарку растворов. Предпринимаются попытки [2-5] разработки технологий их использования в производстве натриевых солей (фосфатов, нитратов или сульфатов натрия). Но чаще отработанные растворы с установок очистки газов направляют на станцию очистки стоков. Водная абсорбция газов от кислотных компонентов менее эффективна, хотя она позволяет получать более концентрированные растворы абгазных кислот [6]. После нейтрализации такой кислоты содой получаемые нейтрализованные растворы имеют более высокую концентрацию и используются для производства солей.
С учетом возросших экологических требований к чистоте отходящих газов разработка более эффективных малоотходных технологий очистки абгазов остается актуальной.
Цель работы
Определить эффективные способы очистки отходящих газов от кислотных компонентов и переработки образующихся нейтрализованных абсорбционных растворов в соответствующие соли без дополнительных затрат тепла на упарку данных растворов.
Экспериментальная часть
На диаграмме состава систем, образующихся при абсорбции кислотных компонентов из отходящих газов содовым раствором, проведен анализ процесса очистки газов, нейтрализации абсорбционного отработанного раствора содой и кристаллизации соли из нейтрализованного раствора. В результате анализа установлено перспективное направление совершенствования технологии солей из компонентов отходящих газов.
Результаты и их обсуждение
Процесс поглощения кислого компонента ![]() из газов содовым раствором можно представить на диаграмме состава в образующейся системе
из газов содовым раствором можно представить на диаграмме состава в образующейся системе ![]() , приведенной на рис. 1 линией
, приведенной на рис. 1 линией ![]() . Абсорбцию проводят при температуре раствора 30-35 °С. Поэтому для орошения абсорбера используют водный раствор соды концентрацией 15-22% (точка
. Абсорбцию проводят при температуре раствора 30-35 °С. Поэтому для орошения абсорбера используют водный раствор соды концентрацией 15-22% (точка ![]() ). В процессе нейтрализации раствора поглощенным кислым компонентом х фигуративная точка раствора перемещается из точки
). В процессе нейтрализации раствора поглощенным кислым компонентом х фигуративная точка раствора перемещается из точки ![]() к точке
к точке ![]() , в которой нейтрализация соды завершается. Раствор становится насыщенным образовавшейся солью
, в которой нейтрализация соды завершается. Раствор становится насыщенным образовавшейся солью ![]() .
.
Если в системе ![]() возможно осаждение двух кристаллогидратов:
возможно осаждение двух кристаллогидратов: ![]() и
и ![]() (
(![]() ), то при более низких температурах (например, 15-35 °С) в осадок выпадает соль с большей долей гидратной воды, равновесная при данных температурах. Поэтому для получения более концентрированной соли с меньшей долей гидратной воды полученный нейтрализованный раствор после абсорбции кислого компонента водным 21%-ным содовым раствором необходимо упарить. Упарка раствора нужна даже в случае выделения более водного кристаллогидрата
), то при более низких температурах (например, 15-35 °С) в осадок выпадает соль с большей долей гидратной воды, равновесная при данных температурах. Поэтому для получения более концентрированной соли с меньшей долей гидратной воды полученный нейтрализованный раствор после абсорбции кислого компонента водным 21%-ным содовым раствором необходимо упарить. Упарка раствора нужна даже в случае выделения более водного кристаллогидрата ![]() для достижения полного использования маточного раствора. Если кристаллогидрат
для достижения полного использования маточного раствора. Если кристаллогидрат ![]() содержит 58% безводной соли, а кристаллогидрат
содержит 58% безводной соли, а кристаллогидрат ![]() - 70%, то их состав отображается на диаграмме точками А и Б соответственно.
- 70%, то их состав отображается на диаграмме точками А и Б соответственно.
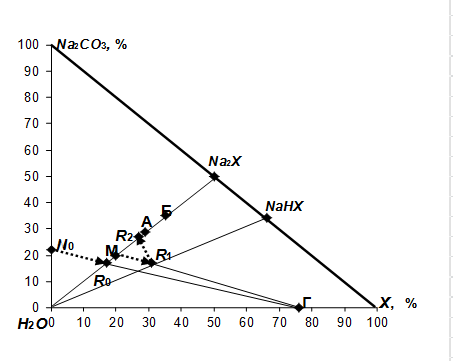
Рис. 1. Стадии получения соли ![]() на диаграмме
на диаграмме ![]()
Количество упариваемой воды определяется водным балансом системы в соответствии с уравнением:
![]() ,
,
где 0,42 – доля воды в растворе после его упарки до содержания соли 58%;
х – количество упариваемой воды;
(1 + х) – количество содового раствора, необходимого при абсорбции кислого компонента для получения 1 тонны упариваемого раствора с содержанием соли 58%;
0,79 – доля воды в исходном растворе соды.
Решение уравнения дает, что на 1 т упаренного раствора, насыщенного кристаллогидратом ![]() , надо выпарить 2,76 т воды. В соответствии с балансом воды при кристаллизации
, надо выпарить 2,76 т воды. В соответствии с балансом воды при кристаллизации ![]()
![]() ,
,
где 0,3 – содержание воды в кристаллогидрате ![]() ;
;
0,6 – доля воды в маточном растворе.
Решение уравнения дает, что после охлаждения упаренного раствора до 35 °С из него кристаллизуется 0,6 т кристаллогидрата ![]() . Следовательно, на 1 т получаемой соли в виде кристаллогидрата
. Следовательно, на 1 т получаемой соли в виде кристаллогидрата ![]() упаривается 4,6 т воды:
упаривается 4,6 т воды:
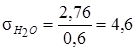 т.
т.
Если оставшийся маточник возвратить в систему абсорбции для орошения абсорбера, то процесс абсорбции будет проходить с образованием кислой соли ![]() . Фигуративная точка раствора будет перемещаться от точки М к точке R на луче растворения соли
. Фигуративная точка раствора будет перемещаться от точки М к точке R на луче растворения соли ![]() в воде. При нейтрализации раствора состава точки R содой фигуративная точка раствора перемещается из точки R1 к точке R2 . Доля воды в полученном нейтрализованном растворе составляет 42%. После политермической кристаллизации соли
в воде. При нейтрализации раствора состава точки R содой фигуративная точка раствора перемещается из точки R1 к точке R2 . Доля воды в полученном нейтрализованном растворе составляет 42%. После политермической кристаллизации соли ![]() охлаждением раствора до 35 °С и отделения кристаллов оставшийся маточный раствор характеризуется фигуративной точкой М. Данный раствор возвращается на стадию абсорбции. Как видно из диаграммы состава системы, рецикл маточного раствора позволяет получать соль
охлаждением раствора до 35 °С и отделения кристаллов оставшийся маточный раствор характеризуется фигуративной точкой М. Данный раствор возвращается на стадию абсорбции. Как видно из диаграммы состава системы, рецикл маточного раствора позволяет получать соль ![]() без использования воды на приготовление содового раствора. Следовательно, исключается необходимость упарки воды из системы.
без использования воды на приготовление содового раствора. Следовательно, исключается необходимость упарки воды из системы.
Коэффициент рецикла (Кр) маточника равен отношению масс жидкой ![]() и твердой
и твердой ![]() фаз в системе в конце кристаллизации соли
фаз в системе в конце кристаллизации соли ![]() .
.
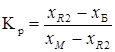 ,
,
где ![]() ,
, ![]() и
и ![]() - соответственно доли воды в маточнике, в растворе, поступающем на кристаллизацию, и в выделенном кристаллогидрате.
- соответственно доли воды в маточнике, в растворе, поступающем на кристаллизацию, и в выделенном кристаллогидрате.
Выход соли ![]() в долях от единицы составит:
в долях от единицы составит:
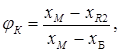
а выход маточника равен:
![]() .
.
Использование рецикла маточного раствора на орошение абсорбера позволяет исключить необходимость упарки растворов для получения соли. При этом энергетические затраты на производство соли снижаются. В результате исключения выпарного аппарата, конденсатора паров, емкостей упаренного раствора и конденсата насосов уменьшаются капитальные затраты и амортизационные отчисления.
Выполнена экспериментальная отработка предложенной циркуляционной технологии получения сульфита натрия из отходящих газов, содержащих 3,4% диоксида серы, и получения хлористого аммония из отходящих газов с долей хлористого водорода 30-35%. При этом достигнуто снижение энергетических затрат по сравнению с традиционными технологиями в 3,2 раза при получении сульфита натрия и в 5,6 раза при получении хлористого аммония.
Заключение
Применение рецикла маточного раствора на абсорбцию утилизируемого компонента из отходящих газов обеспечивает снижение энергетических затрат при производстве солей в 3-5 раз.
Рецензенты:
Луконин В.П., д.т.н., профессор, генеральный директор ФГУП «НИИ полимеров им. академика В.А. Каргина», г. Дзержинск.
Сажин С.Г., д.т.н., профессор, генеральный директор НТЦ «АТЦ», г. Дзержинск.



