Введение. Для замещения дефектов в клинической практике используют разнообразные кальцийфосфатные материалы, имеющие различия по биосовместимости и резорбируемости матрицы, степени выраженности остеокондуктивности и остеоиндуктивности. Свойства кальцийфосфатных материалов определяются их физико-химическими и структурными параметрами. Однако до сих пор среди них нет идеально совпадающих по своему составу и свойствам с нативной костной тканью [10].
Цель исследования - сравнительный гистоморфометрический анализ костной ткани регенератов, формирующихся в конусообразных дефектах метафиза, при применении композиционных имплантационных материалов, содержащих низкомолекулярные неколлагеновые костные белки, имеющие различное сродство к ионообменникам.
Материал и методы исследования
Эксперименты проведены на 19 взрослых беспородных собаках обоего пола в возрасте от одного года до трех лет весом 11,2±2,4 кг.
Животным в стерильных условиях под общим наркозом моделировали конусообразные несквозные дефекты диаметром 5 мм и высотой 7 мм в проксимальных метафизах большеберцовых и плечевых костей. Дефекты заполняли композиционным материалом, в состав которого входили кальцийфосфатное соединение, выделенное из костной ткани сельскохозяйственных животных по оригинальной методике [8], и низкомолекулярные неколлагеновые костные белки, имеющие сродство к катионообменникам или не имеющие сродство к ионообменникам [2].
Животные были разделены на 2 группы. В первой группе «О» (n=9) композиционный материал содержал низкомолекулярные неколлагеновые костные белки, не имеющие сродства к ионообменникам; во второй «К» - (n=10) - имеющие сродство к катионообменникам. В обеих группах животных выводили из эксперимента через 21 (n=5+5) и 42 (n=4+5) суток после операции.
Содержание животных, оперативные вмешательства и эвтаназию осуществляли согласно требованиям приказа МЗ СССР № 755, 1977 г., а также руководствуясь требованиями, изложенными в «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» с соблюдением этических норм и гуманного отношения к объектам изучения [3].
Для гистологического и гистоморфометрического исследования выпиливали фрагменты проксимальных метафизов большеберцовых и плечевых костей, включающие области сформированных конусообразных дефектов. Все образцы костей фиксировали в 10% нейтральном растворе формалина, после чего метафизы распиливали пополам в саггитальной плоскости. Одну половину после декальцинации и стандартной гистологической проводки заливали в целлоидин, изготавливали срезы толщиной 8-10 мкм и окрашивали их гематоксилином и эозином, пикрофуксином по Ван-Гизону и трихромным методом по Массону. На гистологических препаратах в площади дефекта определяли долю новообразованной костной ткани и композиционного имплантационного материала (КИМ).
Вторую половину материала не декальцинировали, после фиксации и проводки изготавливали аралдитовые блоки. На ультрамикротоме «Nova» (Швеция) с помощью стеклянных ножей изготавливали срезы толщиной 1-2 мкм. Без удаления смолы срезы окрашивали метиленовым синим, реактивом Шиффа, а также по методу Косса с дополнительной окраской по Ван-Гизону [4].
Гистоморфометрическое исследование недекальцинированных срезов включало определение статических показателей костеобразования и резорбции, рекомендуемых American Society of Bone and Mineral Research Histomorphometry Nomenclature Committe в остеологических исследованиях [6]: объем (OV/BV, %), поверхность (OS/BS, %) и толщину (O.Th., мкм) остеоида, поверхность резорбции (ES/BS, %). Также определяли толщину трабекул (Tb.Th., мкм) и объем трабекулярной кости, который соответствовал проценту объема губчатой кости, занятого минерализованной и остеоидной костной тканью, исключая медуллярные и васкулярные пространства [5].
Оцифровку полей зрения гистологических препаратов проводили на аппаратно-программном комплексе «ДиаМорф» (Россия), для анализа оцифрованных изображений использовали программное обеспечение «ВидеоТесТ 4,0 – Мастер» (Россия).
С целью получения результатов в реальных единицах измерения (мкм) выполняли калибровку системы по изображению объект-микрометра, введенного при том же увеличении (об. 40, ок. 10), что и поля зрения препаратов.
Учитывая, что состав кости собак имеет близкие значения к аналогичным показателям человека [9], полученные результаты сравнивали с данными литературы [6].
Статистическую обработку результатов выполняли с помощью программ «Microsoft Excel – 2007» и «AtteStat» Версия 1.0 [1]. Цифровые данные представлены в виде среднего арифметического значения и стандартного отклонения (M±SD) или медианы (Me) и интерквартильного размаха (LQ25-UQ75). Для оценки статистической значимости различий средних и медиан, в зависимости от нормальности распределения, использовали критерии Стьюдента и Вилкоксона. Различия между группами считали существенными при р<0,05.
Результаты исследования
У животных обеих групп в полости дефекта наблюдали однотипные морфологические изменения. Так, через 21 сутки эксперимента дефект имел четкую границу, по его периферии новообразованные костные структуры формировали мелкопетлистую трабекулярную сеть по направлению от края к центру. Центр дефекта был заполнен рыхлой волокнистой соединительной тканью, в толще которой формировались трабекулы из ретикулофиброзной костной ткани.
К 42 суткам эксперимента в обеих группах четкая граница дефекта отсутствовала, новообразованный участок отличался от окружающей его кости микроархитектурной организацией трабекулярной сети и содержимому межтрабекулярных пространств (соотношению красного и желтого костного мозга, количеству кровеносных сосудов).
В тоже время отмечались различия между группами по скорости заполнения дефектов костной тканью, о чем свидетельствуют данные морфометрии гистологических препаратов (рис. 1).
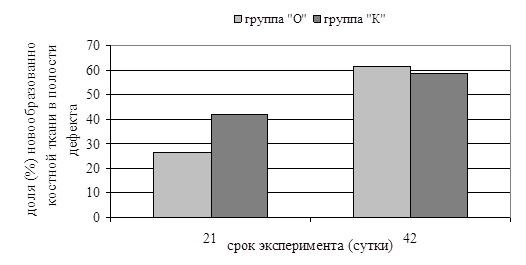
Рис. 1. Динамика заполнения дефектов новообразованной костной тканью.
* - различия значимы по сравнению с группой «О» при р<0,05
Различным оказалось содержание и распределение имплантационного материала в полости дефекта. У животных из группы «О» через 21 сутки эксперимента гранулы имплантационного материала располагались, в основном, в центре дефекта, их доля составляла 10,2% (7,6%; 12,6%), в группе «К» - КИМ в полости дефекта был распределен неравномерно и занимал 1,2% (1,1%; 2,3%) (р=0,014) его площади. У всех животных в составе новообразованных трабекул определялись частицы КИМ. К 42 суткам эксперимента в полости дефекта в каждой группе только у двух животных определялись единичные гранулы КИМ.
В проведенных ранее исследованиях было показано, что без заполнения КИМ через 42 суток эксперимента происходит лишь частичное возмещение аналогичных дефектов. При этом в кости сохраняется выемка, заполненная рыхлой волокнистой соединительной тканью, а кортикальная пластинка находится в стадии формирования [7].
Результаты гистоморфометрического исследования также показали различия между группами в скорости репаративных процессов, происходящих в полости дефекта (табл. 1).
Таблица 1.
Гистоморфометрические параметры костной ткани регенератов,
формирующихся в дефектах
|
Параметры |
1. Группа «О» |
2. Группа «К» |
||
|
21 сутки (n=5) |
42 суток (n=4) |
21 сутки (n=5) |
42 суток (n=5) |
|
|
Объем трабекулярной кости, % |
72,07 (66,39; 82,54) |
42,75** (35,31; 61,01) |
64,45 (58,60; 72,91) |
36,67** (27,43; 44,51) |
|
Объем остеоида (OV/BV), % |
24,82 (18,08; 30,65) |
9,22* (6,30; 12,06) |
19,55 (14,92; 28,09) |
7,23* (3,68; 14,15) |
|
Толщина остеоида (O.Th.), мкм |
11,80 (8,90; 14,25) |
6,74 (4,59; 8,15) |
9,28 (6,28; 12,72) |
4,70 (2,35; 9,20) |
|
Остеоидная поверхность (OS/BS), % |
86,46 (66,91; 99,72) |
21,52** (15,40; 30,65) |
77,21 (69,61; 87,35) |
19,79*** (12,68; 27,68) |
|
Поверхность резорбции (ES/BS), % |
4,69 (0,00; 8,36) |
9,68 (4,16; 13,74) |
12,11# (5,41; 16,98) |
5,73 (0,00; 11,83) |
|
Средняя ширина трабекул (TbTh), мкм |
85,89 (73,67; 96,61) |
61,14 (54,93; 80,09) |
77,72 (49,01; 104,86) |
51,95 (42,10; 71,07) |
1. различия значимы по сравнению со сроком эксперимента 21 сутки в соответствующей группе:
* - p˂0,05; ** - p˂0,01; *** - p˂0,001.
2. различия значимы по сравнению с группой «О» на соответствующем сроке эксперимента: # - р<0,05.
При исследовании недекальцинированных срезов установлено, что через 21 сутки в обеих группах новообразованные трабекулы имели ретикулофиброзное строение. В группе «К» в полости дефекта поверхность трабекул была покрыта толстым слоем остеоида с включенными в него клетками и активными остеобластами, расположенными в 1-2 ряда. Многочисленные остеокласты, в основном функционально активные, содержащие от 4 до 9 ядер, располагались в межтрабекулярном пространстве, возле поверхности трабекул и в гаушиповых лакунах. Расположенные по краю дефекта трабекулы приобретали пластинчатое строение, их поверхность покрывал тонкий слой остеоида и неактивные остеобласты. В межтрабекулярном пространстве преобладал красный костный мозг. Высокую интенсивность процессов костеобразования и резорбции подтверждают и данные гистоморфометрического анализа. Значения показателей OV/BV, O.Th., OS/BS, отражающих соответственно объем, толщину остеоида, остеоидную поверхность превышали значения нормы [6].
В группе «О» на данном сроке эксперимента были более выражены остеопластические процессы, так же как и у животных группы «К» на поверхности трабекул определялся толстый слой остеоида и активные остеобласты, расположенные в 2-3 ряда. Полости резорбции, напротив, были немногочисленны, в связи с чем показатель ES/BS (поверхность резорбции) значимо отличался от соответствующего показателя в группе «К».
К 42 суткам эксперимента в обеих группах происходило уменьшение показателей, отражающих интенсивность остеопластических процессов - OV/BV, O.Th., OS/BS. Уменьшалась толщина трабекул, увеличивалось расстояние между ними, межтрабекулярное пространство было заполнено красным и желтым костным мозгом. У животных группы «К» преобладали трабекулы, имеющие пластинчатое строение. В группе «О» в центральной части регенерата продолжалось замещение грубоволокнистой костной ткани пластинчатой. У всех животных наблюдалась адаптивная перестройка новообразованной костной ткани.
На протяжении всего периода наблюдения в полости дефекта у животных обеих групп мы отмечали наличие значительного количества капилляров синусоидного типа, что позволяет предположить присутствие в составе имплантируемых материалов факторов, которые не только оказывают воздействие на остеогенез в полости дефекта, но и стимулируют ангиогенез.
Заключение. Таким образом, при гистологическом и гистоморфометрическом исследовании костной ткани регенератов установлено, что степень выраженности остеогенеза на 21 сутки после операции была выше у животных в группе «О», которым имплантировали композиционный материал, содержащий низкомолекулярные неколлагеновые костные белки, не имеющие сродства к ионообменникам. У животных группы «К» отмечалось не только высокая активность процессов костеобразования, но и резорбции, что свидетельствует о начале процессов ремоделирования новообразованной костной ткани, расположенной по краю дефекта. К 42 суткам наблюдали замедление репаративных процессов в обеих группах и продолжение процессов ремоделирования. Учитывая полученные результаты можно сделать следующие выводы: оба материала способствуют восстановлению дефекта, вызывая активацию ангиогенеза, процессов костеобразования и резорбции, при этом на начальных сроках эксперимента биодеградация КИМ и замещение дефекта в группе «К» происходит быстрее, чем в группе «О».
Рецензенты:
Дьячков А.Н., д.м.н., главный научный сотрудник ФГБУ «РНЦ «ВТО» имени академика Г.А. Илизарова» Минздрава России, г. Курган.
Краснов В.В., д.б.н., ведущий научный сотрудник ФГБУ «РНЦ «ВТО» имени академика Г.А. Илизарова» Минздрава России, г.Курган.



