Введение
Процесс никелирования широко применяется в промышленности. Наиболее распространенными электролитами, используемыми для нанесения матовых и блестящих никелевых покрытий, являются электролиты типа Уоттса, содержащие в своем составе около 1 моль/л никеля [1; 7]. При эксплуатации данных растворов на катоде наряду с разрядом ионов никеля наблюдается восстановление воды и образование гидроксид-ионов, которые вызывают увеличение значений pH раствора [8]. Для решения данной проблемы в электролит вводят добавки, обладающие буферными свойствами.
Для получения блестящих и полублестящих покрытий непосредственно в процессе электролиза в электролит вводят блескообразующие добавки, которые, как правило, негативным образом влияют на функциональные свойства формируемых покрытий, а также способствуют питтингообразованию [8].
Еще одним недостатком применяемых технологий является необходимость поддержания достаточно высоких температур (50-60 °С) раствора.
Таким образом, разработка электролита и высокопроизводительной технологии формирования гальванических покрытий никелем из малотоксичного, экологически малоопасного электролита является весьма актуальной и своевременной целью.
Для достижения поставленной цели в качестве добавки можно предложить молочную кислоту, которая выступает в роли поверхностно активного вещества, комплексообразователя и буферной добавки, а также использование нестационарных режимов электролиза (импульсный ток), которые имеют ряд преимуществ перед стационарным режимом и позволяют формировать покрытия высокого качества с улучшенным комплексом свойств без введения дополнительных блескообразующих добавок, а также повысить скорость процесса [4; 5].
Методика эксперимента
Определение оптимального режима электролиза проводили в прямоугольной ячейке объемом 0,2 л с применением в качестве катода медных (М00) и стальных (08X18Н10Т) пластин площадью 4·10-4 м2 и графитовых анодов. Подготовка катода проводилась в соответствии с требованиями [1].
Для приготовления растворов использовали реактивы марки «ч.» или «х.ч.» и дистиллированную воду. Выработка электролита по ионам металла не превышала 5%.
В качестве источника тока, регистратора зависимости потенциала и силы тока во времени использовали потенциостат IPC-ProMF, подключенный к персональному компьютеру. Потенциалы измерены относительно хлоридсеребряного электрода (ЭВЛ-1М) и пересчитаны относительно стандартного водородного электрода. рН электролита определяли рН-метром-иономером И-160. Электропроводность раствора определяли с помощью кондуктометра КЭЛ-1М.
Для расчета катодного выхода по току никеля при использовании импульсного тока использовали общее количество электричества, прошедшее через электрохимическую систему, которое определялось интегрированием зависимости силы тока от времени [4].
Результаты и их обсуждение
В ходе данной работы было исследовано влияние основных режимов импульсного электролиза (амплитудных значений потенциалов первого (E1) и второго (E2) импульсов, следующих друг за другом, а также их длительностей (τ1 и τ2) (рис. 1)) и состава электролита на катодный выход по току никеля и качество осаждаемых покрытий.
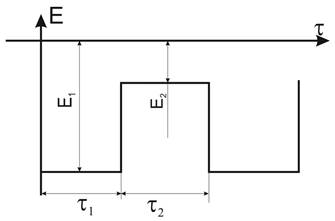
Рис. 1. Параметры потенциостатического режима импульсного электролиза, задаваемые в данном исследовании.
Исследование зависимости катодного выхода по току никеля от технологических параметров процесса проводили в электролите следующего состава: NiSO4.7H2O – 0,86 моль/л, молочная кислота – 0,3 моль/л, при рН равном 3,5 и температуре 20 °С.
При работе в потенциостатическом режиме необходимо задавать и поддерживать постоянной величину потенциала рабочего электрода. При этом необходимо учитывать омическое падение потенциала в электролите, которое зависит, прежде всего, от электропроводности раствора, состояния поверхности электрода и аппаратного оформления процесса, в частности от расстояния между капилляром хлоридсеребряного электрода и поверхностью электрода.
Для плоского электрода сопротивление электролита прямо пропорционально зависит от расстояния между капилляром Луггина-Габера и поверхностью электрода и обратно пропорционально от удельной электропроводности раствора электролита [6]. Таким образом, можно предположить, что чем ближе капилляр будет подведен к поверхности электрода, тем меньше омические потери потенциала. Для снижения электрического сопротивления раствора в электролит дополнительно вводился сульфат натрия.
Однако при слишком близком расположении капилляра электрода сравнения возникает эффект экранирования поверхности электрода, а также разрыв цепи пузырьками выделяющегося газа. Для определения оптимального расстояния между капилляром и поверхностью электрода был проведен эксперимент, в котором исследовалось значение силы тока, протекающего через электрохимическую систему при постоянном значении потенциалов Е1 и Е2 и различном расстоянии между капилляром электрода сравнения и поверхностью электрода (рис. 2, 3).
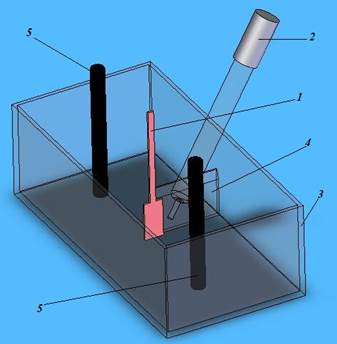
Рис. 2. Схема взаимного расположения рабочего электрода и электрода сравнения:
1 – рабочий электрод; 2 – хлоридсеребряный электрод сравнения; 3 – ячейка; 4 –шкала; 5-аноды.
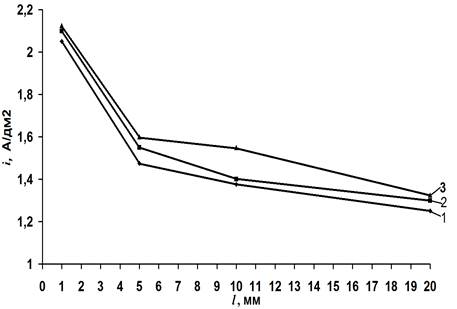
Рис. 3. Зависимость плотности тока (i) от расстояния (l) между рабочим электродом и капилляром электрода сравнения при различном содержании сульфата натрия в электролите никелирования: 1 – без добавления сульфата натрия; 2 – концентрация сульфата натрия 0,07 моль/л; 3 – концентрация сульфата натрия 0,14 моль/л.
Увеличение концентрации сульфата натрия в электролите приводит к повышению электропроводности раствора, так, при концентрациях 0, 0,07 и 0,14 моль/л электропроводность раствора составляет 6,1, 6,5 и 6,7 См/м соответственно.
Таким образом, проведенные исследования позволили на основании изучения зависимости плотности тока, выхода никеля по току, а также качества покрытий от расстояния капилляра электрода сравнения от поверхности рабочего электрода найти оптимальное расстояние, которое составляет 5 мм. Взаимное положение электродов не менялось в ходе всех нижеприведенных экспериментов.
Изменение потенциала импульса E1 от -800 до -1200 мВ при E2 = -700 мВ, (![]() ) не приводит к значительному изменению катодного выхода по току никеля, однако при Е1 = -900мВ осаждаются покрытия наилучшего качества. Смещение потенциала электрода в область более отрицательных значений приводит к ухудшению качества покрытия (отслаиванию и подгару в углах пластинки).
) не приводит к значительному изменению катодного выхода по току никеля, однако при Е1 = -900мВ осаждаются покрытия наилучшего качества. Смещение потенциала электрода в область более отрицательных значений приводит к ухудшению качества покрытия (отслаиванию и подгару в углах пластинки).
Добавление сахарина в количестве 0,1 г/л приводит к снижению катодного выхода по току никеля от 89 до 82% и снижает внутреннее напряжения сжатия со 140 до 130 МПа, при этом ухудшения качества покрытия не происходит. Дальнейшее увеличение концентрации сахарина в растворе значительно снижает выход по току и ухудшает качество получаемых никелевых покрытий.
Исследование влияния изменения Е2 проводили при Е1 = -900 мВ и ![]() , при этом определяли ВТк и качество никелевого покрытия. В интервале E2 (-400 – -700) мВ происходит увеличение ВТк от 75 до 89%, при значении Е2 = -700 мВ наблюдается наилучшее качество покрытия и максимальный выход металла по току.
, при этом определяли ВТк и качество никелевого покрытия. В интервале E2 (-400 – -700) мВ происходит увеличение ВТк от 75 до 89%, при значении Е2 = -700 мВ наблюдается наилучшее качество покрытия и максимальный выход металла по току.
С увеличением частоты от 1 до 2 Гц наблюдается рост катодного выхода по току никеля с 81 до 89%. Дальнейшее увеличение частоты до 20 Гц приводит к снижению катодного выхода по току никеля до 80%, что связано с увеличением доли тока, затраченной на перезарядку двойного электрического слоя. Поэтому увеличение частоты импульсного тока в потенциостатическом режиме выше 20 Гц нецелесообразно.
Исследование зависимости катодного выхода по току никеля от скважности импульсного тока проводили при длительности первого импульса равного 0,25 с.
С увеличением скважности от 1,2 до 2 происходит возрастание катодного выхода по току никеля от 72 до 89% , дальнейший рост скважности снижает катодный выход по току никеля. Последующие исследования проводили при следующем режиме: Е1 = -900 мВ, Е2 = -700 мВ и ![]() .
.
Изменение концентрации ионов никеля в исследуемом растворе от 0,34 до 1,03 моль/л приводит к увеличению катодного выхода по току никеля от 50 до 89% и увеличению скорости осаждения (vос, мкм/ч) никелевых покрытий.
В данном диапазоне концентраций зависимость скорости осаждения от концентрации ионов никеля в растворе достаточно точно (коэффициент корреляции 0,91) описывается следующим уравнением:
![]()
Анализ зависимости ![]() позволяет определить порядок реакции по ионам никеля в растворе. Для этого необходимо построить зависимость в координатах
позволяет определить порядок реакции по ионам никеля в растворе. Для этого необходимо построить зависимость в координатах ![]() , тангенс угла наклона которой равен порядку реакции по ионам никеля. Для данного случая порядок реакции равен 0,83, что свидетельствует о стадийности процесса разряда ионов никеля на катоде.
, тангенс угла наклона которой равен порядку реакции по ионам никеля. Для данного случая порядок реакции равен 0,83, что свидетельствует о стадийности процесса разряда ионов никеля на катоде.
Дальнейшее повышение содержания ионов никеля в электролите не оказывает заметного влияния на катодный выход по току и, следовательно, нецелесообразно. Наилучшее качество покрытия наблюдается при концентрации ионов никеля в растворе 0,86 моль/л.
При содержании ионов никеля в растворе 0,86 моль/л изменение концентрации молочной кислоты в электролите от 0,1 до 0,5 моль/л уменьшает катодный выход по току никеля и скорость его осаждения. Равномерные блестящие покрытия никелем получаются при концентрации данной добавки 0,3 моль/л. Повышение концентрации выше 0,5 моль/л молочной кислоты не целесообразно.
Исследование влияния рН электролита на катодный выход по току никеля проводилось в диапазоне от 1,5 до 5,5. В интервале рН от 1,5 до 3,5 наблюдается рост катодного выхода по току никеля от 5 до 89%. Дальнейшее повышение pH ведет к снижению катодного выхода по току и потере устойчивости раствора. Так, при значениях pH выше 5,5 наблюдается выпадение осадка. Покрытия наилучшего качества осаждаются при рН=3,5.
На основании проведенных исследований для электролитического осаждения полублестящих равномерных никелевых покрытий можно рекомендовать следующий состав электролита и режим электролиза:
|
NiSO4.7H2O, моль/л |
0,3 – 1,1 |
|
Молочная кислота, моль/л |
0,1 - 0,6 |
|
Сахарин, г/л |
0,1 |
|
pH |
3,2-3,7 |
|
Температура, °С |
20-30 |
|
Е1, мВ |
-900 |
|
Е2, мВ |
-700 |
|
|
0,25 |
При указанном режиме получаются равномерные полублестящие покрытия никелем с выходом по току 87-91% и скоростью электроосаждения – 14,3 мкм/ч, что на 10-15% превосходит значения скорости, приведенные в [8] этого же электролита при стационарном режиме электролиза.
Выводы
Проведенные исследования позволили определить оптимальные параметры процесса формирования гальванических покрытий никелем с использованием потенциостатического режима импульсного электролиза. Результаты исследования показывают преимущества потенциостатического режима импульсного электролиза перед стационарным режимом и гальваностатическим режимом импульсного электролиза. В первую очередь это связано с увеличением скорости процесса без изменения состава электролита. Данные преимущества авторами доказаны на примере и других металлов, а именно цинка [3] и олова [2].
Рецензенты:
Кошев А.Н., д.х.н., профессор кафедры «Информационно-вычислительные системы», ФГБОУ ВПО «Пензенский государственный университет архитектуры и строительства», г.Пенза.
Розен А.Е., д.т.н., профессор, зав. кафедрой «Сварочное, литейное производство и материаловедение», ФГБОУ ВПО «Пензенский государственный университет», г. Пенза.



