Введение
Продукт обогащения железной руды методом магнитной сепарации, предназначенный для получения железа доменным способом, называется рядовым концентратом. Рядовые концентраты содержат от 60 до 70 % железа и до 10 % примесей, в которых преобладает кремний в виде кварца и других кремнийсодержащих минералов, а также алюминий, кальций, магний и другие примеси. Более полная очистка рядового концентрата от примесей не требуется, так как процессы очистки происходят в самом доменном процессе: в расплавленном состоянии примеси переходят в шлак при взаимодействии с карбонатом кальция, который в виде известняка вводится в домну вместе с концентратом.
Положение кардинально меняется при самостоятельном использовании железорудного концентрата для получения порошкового и губчатого железа, синтеза ферритов, в производстве щелочных аккумуляторов, в химических процессах (получение гидроксида натрия ферритным методом, переработка нитрата натрия и др.). Для этих целей производятся чистые концентраты, в которых общее содержание примесей снижено до 2–3 %, в том числе кремния до 0,4–1,3 %. Чистые концентраты получают из рядовых, применяя дополнительное измельчение, обработку в сильных магнитных полях, флотацию.
Но уже сейчас необходимы и в ближайшей перспективе технического прогресса потребуются в большом количестве сверхчистые концентраты, в которых содержание примесей должно быть на уровне сотых долей процента. Их получение традиционными методами магнитной сепарации и флотации чрезвычайно затруднено и практически невозможно, так как потребуется сверхтонкое, технически не достижимое, измельчение исходного материала.
Производство сверхчистых концентратов возможно методами химического обогащения либо непосредственно железной руды, либо её концентратов. Более целесообразно использование в качестве исходного материала рядовых или чистых концентратов, так как в этом случае снижается расход химических реагентов.
Исследования по химическому обогащению железных руд проводятся во многих промышленно развитых странах [3]. В России наиболее полные исследования по химическому обогащению железных руд и по получению сверхчистых концентратов химическими методами проведены в Томском политехническом университете [4]. Изучена растворимость рядовых концентратов в кислотах [5] и очистка от кальция и магния азотной кислотой в стационарном режиме [6] и при совмещении кислотной обработки с измельчением [7].
Особое внимание уделено очистке от кремния, который во всех рудах является основной примесью. Для его удаления из рядовых концентратов использовались растворы гидроксида натрия, эффективность которых примерно на порядок выше, чем гидроксида калия. Установлено, что при температурах, значения которых ниже температур кипения растворов щёлочи (80–125 °С), полной очистки от этой примеси не происходит из-за резкого замедления после выщелачивания небольшой части (10–20 %) за первое время (до 30 мин) от начала процесса [8]. Другие результаты получены при автоклавном выщелачивании – при температурах выше температур кипения растворов (при 140–200 °С): в этих экспериментах установлено практически полное выщелачивание кремния, а также очистка от других примесей.
Предметом настоящего исследования является кинетическая обработка опытных данных, полученных при автоклавном выщелачивании кремния из рядового Криворожского железорудного концентрата.
Методика и результаты исследования
Типичные временные зависимости автоклавного выщелачивания приведены на рис. 1, а полные результаты этого исследования опубликованы в предыдущих статьях [9, 10].
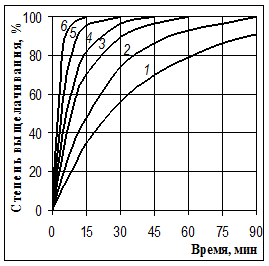
Рис 1. Выщелачивание кремния из рядового Криворожского концентрата при температурах (°С): 140 (1), 150 (2), 160 (3), 170 (4), 180 (5), 200 (6)
При рассмотрении временных зависимостей, представленных на этом рисунке и в статьях [9, 10], возникает предположение о том, что лимитирующей стадией процесса является не диффузия, как при выщелачивании при атмосферном давлении, а химическая реакция кремнийсодержащих соединений с гидроксидом натрия. В пользу такого предположения свидетельствует независимость показателей выщелачивания от размера частиц руды и интенсивности перемешивания, а также значительное увеличение скорости процесса при повышении температуры (рис. 1).
С химической точки зрения выщелачивание кремния из железорудного концентрата является сложным гетерогенным процессом, в котором с гидроксидом натрия взаимодействует ряд различных соединений кремния, содержащихся в руде. Но с позиций формальной кинетики он является, как большинство гетерогенных процессов, реакцией первого порядка. Если это действительно так, то зависимость степени выщелачивания a от времени t должна описываться уравнением
![]() = k·t,
= k·t,
в котором коэффициент пропорциональности k является константой скорости реакции.
Константу скорости реакции вычисляли по результатам опытов, которые были проведены в изотермических условиях (табл. 1); значения вычисленных констант при различных условиях проведения опытов приведены в табл. 2.
Т а б л и ц а 1
Концентрация кремния в растворе (C, г SiO2/л) и степень его выщелачивания (a, %) в зависимости от времени (t) при различных температурах.
Постоянные условия: массовая доля гидроксида натрия в растворе – 40 %, соотношение Ж:Т – 5:1, размер частиц концентрата – до 2 мм, интенсивность перемешивания – 90 об/мин, содержание SiO2 в исходном концентрате – 4,07 %.
|
t, мин |
140 °С |
150 °С |
160 °С |
170 °С |
180 °С |
200 °С |
||||||
|
C |
a |
C |
a |
C |
a |
C |
a |
C |
a |
C |
a |
|
|
5 10 15 30 45 60 75 90 |
1,4 2,5 3,8 5,9 7,5 8,5 9,3 9,8 |
12.6 23,3 35,0 55,8 70,2 79,2 86,7 91,2 |
2,1 4,0 5,2 7,9 9,3 10,0 10,3 10,7 |
19,7 37,0 48,2 73,8 86,4 93,0 96,4 100 |
3,4 6,2 7,6 9,6 10,4 10,7 – – |
31,7 57,3 70,5 89,3 96,5 100 – – |
4,6 7,2 8,7 10,4 10,7 – – – |
42,6 67,4 82,2 96,5 100 – – – |
6,5 8,8 10,0 10,7 – – – – |
59,3 87,1 95,4 100 – – – – |
9,3 10,4 10,7 – – – – – |
87,0 97,3 100 – – – – – |
Т а б л и ц а 2
Результаты вычисления константы скорости реакции при автоклавном выщелачивании кремния в изотермических условиях по кинетическому уравнению первого порядка
|
Температура, °С |
Массовая доля NaOH, % |
Число значений k |
Среднее значение k, мин–1 |
Разброс значений k, % |
|
140 150 160 170 180 200 170 170 170 170 170 180 180 180 180 180 |
40 40 40 40 40 40 10 20 30 40 50 10 15 20 25 30 |
8 7 5 4 3 2 7 6 5 5 4 9 8 8 7 6 |
0,027 0,044 0,077 0,111 0,183 0,389 0,014 0,024 0,036 0,078 0,166 0,034 0,041 0,047 0,052 0,056 |
6,8 4,0 5,5 1,1 1,6 0,9 13,6 1,7 2,2 1,0 1,1 1,6 1,3 11,2 9,3 3,2 |
Результаты расчетов свидетельствуют о том, что в большинстве опытов (в 11 опытах из 16) значения константы скорости реакции при разном времени выщелачивания отличаются от среднего значения не более чем на 5 %, в 3-х опытах имеются отличия на 5–9 %, и только в двух опытах имеются значения k, отличающиеся от среднего значения на 11,6 % и 13,6 %. Это даёт основание считать, что кинетическое уравнение первого порядка применимо для описания изучаемого процесса в изотермическом режиме автоклавного выщелачивания.
По средним значениям константы скорости для шести первых опытов, проведённых при одной концентрации гидроксида натрия (40 %), но при разных температурах построен график зависимости натурального логарифма k от обратного значения температуры, то есть график в координатах уравнения Аррениуса:
![]() ¾
¾ ![]()
Этот график приведён на рис. 2. Из него видно, что зависимость в данных координатах во всём температурном интервале линейная. По углу наклона прямой вычислена энергия активации, величина которой равна 76,5 кДж/моль, что свидетельствует о протекании реакции в кинетической области.
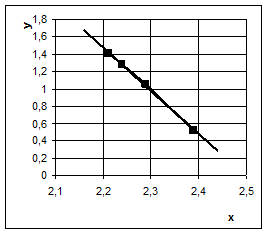
Рис. 2. Результаты выщелачивания кремния 40%-м раствором NaOH при температурах 140–180 °С в координатах уравнения Аррениуса:
х = ![]() , y =
, y = ![]()
При выщелачивании кремния при атмосферном давлении энергия активации равна
23 кДж/моль и лимитирующей стадией является диффузия [4]. При автоклавном выщелачивании диффузионное торможение процесса отсутствует и наиболее вероятными причинами отсутствия такого торможения является разрыхление частиц руды и уменьшение вязкости раствора.
Главной причиной снятия диффузного торможения мы считаем разрыхление частиц руды, появление в них пористости вследствие выщелачивания примесей. Свидетельством появления пористости является увеличение удельной поверхности руды после автоклавного выщелачивания на 35–40 % (удельную поверхность определяли по методу [2]), тогда как при выщелачивании при атмосферном давлении она увеличивается на 15–20 %.
Другой вероятной причиной снятия диффузионного торможения может быть уменьшение вязкости раствора. В табл. 3 приведены значения вязкости растворов гидроксида натрия при температуре от 20 до 200 °С.
Т а б л и ц а 3
Вязкость растворов гидроксида натрия при различных концентрациях и температурах [1]
|
Массовая доля NaOH в растворе, % |
Вязкость в сантипуазах при различных температурах (°С): |
|||||||||
|
20 |
40 |
60 |
80 |
110 |
120 |
140 |
160 |
180 |
200 |
|
|
10 15 20 30 40 |
2,0 3,3 4,8 15,0 38,0 |
1,3 1,9 2,7 6,3 15,0 |
0,97 1,3 1,8 3,5 6,8 |
0,60 0,85 1,2 2,3 3,9 |
0,40 0,57 0,74 1,5 2,4 |
0,30 0,39 0,48 0,90 1,4 |
0,22 0,28 0,34 0,55 0,80 |
0,18 0,23 0,26 0,40 0,50 |
0,15 0,17 0,20 0,25 0,30 |
0,12 0,15 0,17 0,20 0,24 |
Из таблицы видно, что с увеличением температуры вязкость растворов щёлочи резко снижается, что приводит к ускорению диффузионных процессов в соответствии с уравнением, которое связывает коэффициент диффузии, температуру и вязкость [11]:
![]()
где D – коэффициент диффузии, Т – температура, m – вязкость раствора, d – диаметр частиц, NA – число Авагадро.
В соответствии с этим уравнением, повышение температуры раствора от 100 °С (343 К) до 180 °С (453 К) приводит к увеличению коэффициента диффузии растворённых частиц примерно на 30 %.
Выводы
- Скорость автоклавного выщелачивания кремния из рядового железорудного концентрата при температурах от 140 до 200 °С описывается кинетическим уравнением первого порядка.
- Энергия активации автоклавного выщелачивания равна 76,5 кДж/моль, что свидетельствует о протекании процесса в кинетическом режиме.
- Вероятными причинами отсутствия диффузионного торможения являются разрыхление частиц руды и уменьшение вязкости раствора.
Рецензенты:
Саркисов Ю.С., д.т.н., профессор, заведующий кафедрой химии Томского государственного архитектурно-строительного университета, г. Томск.
Лотов В.А., д.т.н., профессор кафедры силикатов и наноматериалов Томского политехнического университета, г. Томск.



