Введение
Плохая экологическая обстановка наряду с большим объемом техногенных отходов и технологий обогащения рудных и нерудных пород поставила в ряд первостепенных и актуальных задач применение экологически чистых малоэнергоемких технологий с использованием техногенных отходов, в частности отходов камнедробления. Около 45% всех эксплуатируемых месторождений промышленности нерудных строительных материалов приходится на долю карбонатных пород.
В настоящее время особый интерес вызывают комбинированные вяжущие, составляющими которых могут быть самостоятельно твердеющие природные минералы, считавшиеся ранее в большинстве случаев инертными. К таким минералам можно отнести доломиты и доломитизированные известняки, используемые ранее исключительно в качестве наполнителей и заполнителей в композиционных материалах на основе цементных и полимерных вяжущих. Высокая химическая активность природных доломитов, в отличие от кальциевых известняков, при формировании прочности в композиции со шлаками в щелочной среде предопределяет протекание реакции бруситизации, роль которой при твердении вяжущих совершенно не изучена.
Исследователи не принимают во внимание возможность участия карбонатов кальция и магния, являющихся основной частью карбонатных пород, в процессах структурообразования, обусловленных реакцией со щелочами, ссылаясь на отсутствие реакционной активности СаСО3 и MgСО3 со щелочами и карбонатами щелочных металлов. В технологии получения карбонатношлаковых изделий [3] не имеет места химическое взаимодействие между продуктами гидратации шлака и карбонатами кальция и магния, идущее вглубь карбонатных частиц. Кроме того, не рассматривается возможность реакционно-химического взаимодействия карбонатной породы со щелочами, выступающими в качестве активизаторов твердения карбонатношлакового вяжущего.
Целью данного исследования является установление реакционной активности доломитизированных карбонатных пород в щелочных средах на основании термодинамического и качественного химического анализов и выявление возможности образования самостоятельной твердеющей структуры в системе «доломит – щелочь».
1. Реакционная активность карбонатных пород в системе «доломит - щелочь»
1.1. Термодинамический и кинетический анализ возможности протекания процессов взаимодействия доломитов и доломитизированных известняков со щелочами.
Критерием направления самопроизвольного необратимого протекания той или иной реакции является изобарно-изотермический потенциал (энергия Гиббса) [4]. Энергия Гиббса не изменяется в обратимых процессах и убывает в необратимых. Иными словами, энергия Гиббса любой системы при Т=const и p=const стремится уменьшиться в самопроизвольных процессах и достигает минимума, когда система приходит в равновесие.
Изменение энергии Гиббса в системе при протекании химической реакции в стандартных условиях находят по формуле
![]() , (1)
, (1)
где ![]() - изменение энтальпии и энтропии, соответственно. В стандартных условиях их находят по формулам:
- изменение энтальпии и энтропии, соответственно. В стандартных условиях их находят по формулам:
![]() , (2)
, (2)
![]() . (3)
. (3)
Для оценки термодинамической и кинетической возможности протекания процессов взаимодействия доломитов и доломитизированных известняков со щелочными активизаторами NaOH, КОН рассчитаны значения энергии Гиббса ![]() и констант химического равновесия Кравн для возможных химических реакций. Здесь целесообразно привести расчет константы равновесия на примере реакции взаимодействия MgCO3 с гидроксидом натрия, происходящей в растворе:
и констант химического равновесия Кравн для возможных химических реакций. Здесь целесообразно привести расчет константы равновесия на примере реакции взаимодействия MgCO3 с гидроксидом натрия, происходящей в растворе:
MgCO3 + 2NaOH ® Mg(OH)2 + Na2CO3,
а в ионном виде
MgCO3 + 2Na+ + 2OH– ® Mg(OH)2 + 2Na++ CO32–
MgCO3 + 2OH– ® Mg(OH)2 + CO32
Из сокращенного ионного уравнения следует
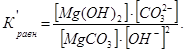
Концентрация труднорастворимых веществ в растворе остается постоянной, откуда следует:
![]()
Умножив числитель и знаменатель на концентрацию ионов Mg2+ , получим
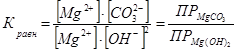 (4)
(4)
При использовании значений стандартных величин ![]() ,
, ![]() , ПР исходных веществ (табл. 1), по уравнениям (1-3) были получены данные для энергии Гиббса, а по уравнению (4) и аналогичным ему уравнениям для других систем были рассчитаны константы равновесия реакций, протекающих в растворе (табл. 2).
, ПР исходных веществ (табл. 1), по уравнениям (1-3) были получены данные для энергии Гиббса, а по уравнению (4) и аналогичным ему уравнениям для других систем были рассчитаны константы равновесия реакций, протекающих в растворе (табл. 2).
Таблица 1
Значения стандартных величин ![]() ,
, ![]() , ПР исходных веществ [7]
, ПР исходных веществ [7]
|
Соединение |
|
|
ПР |
|
CaCO3 |
-1206,83 |
91,71 |
9,8×10-9 |
|
MgCO3 |
-1095,85 |
65,10 |
4,0×10-5 |
|
NaOH |
-426,35 |
64,43 |
- |
|
КОН |
-424,72 |
79,28 |
- |
|
Са(ОН)2 |
-985,12 |
83,39 |
5,5×10-6 |
|
Na2CO3 |
-1130,80 |
138,80 |
- |
|
Mg(OH)2 |
-924,66 |
63,18 |
6,0×10-10 |
|
К2СО3 |
-1150,18 |
155,52 |
- |
Таблица 2
Значения величин ![]() ,
, ![]() ,
, ![]() и
и ![]()
|
№ |
Схема химического процесса |
|
|
|
|
|
1 |
а) CaCO3 + 2NaOH ® ® Ca(OH)2 + Na2CO3 б) MgCO3 + 2NaOH ® ® Mg(OH)2 + Na2CO3 |
-56,74 |
1,62 |
-57,22 |
8,7×10-4 |
|
-106,91 |
8,02 |
-109,30 |
6,7×104 |
||
|
2 |
а) CaCO3 + 2КOH ® ® Ca(OH)2 + К2CO3 б) MgCO3 + 2КOH ® ® Mg(OH)2 + К2CO3 |
-79,03 |
-11,36 |
-75,65 |
8,7×10-4 |
|
-129,55 |
-4,87 |
-128,1 |
6,7×104 |
Следует отметить, что данные по константам равновесия, рассчитанным по уравнению (4) и по зависимости ![]() , несколько отличаются друг от друга. Это связано с тем, что при расчете
, несколько отличаются друг от друга. Это связано с тем, что при расчете ![]() не учитывается то, что реакция протекает в водной среде.
не учитывается то, что реакция протекает в водной среде.
Термодинамические расчеты, выполненные для доломитощелочных систем (реакции 1 (а, б), 2 (а, б)), свидетельствуют, что энергия Гиббса ![]() в стандартных условиях меньше нуля, поэтому химические процессы по данным схемам реакций термодинамически возможны. Однако расчет констант равновесия Кравн свидетельствует о том, что для системы «CaCO3 – Na(К)OH» (реакции 1а и 2а) процесс равновесия сдвинут влево (
в стандартных условиях меньше нуля, поэтому химические процессы по данным схемам реакций термодинамически возможны. Однако расчет констант равновесия Кравн свидетельствует о том, что для системы «CaCO3 – Na(К)OH» (реакции 1а и 2а) процесс равновесия сдвинут влево (![]() ), т.е. прямая реакция (реакция, идущая в сторону продуктов реакции) практически не протекает [5]. Для системы «MgCO3 – Na(К)OH» (реакции 1б, 2б)
), т.е. прямая реакция (реакция, идущая в сторону продуктов реакции) практически не протекает [5]. Для системы «MgCO3 – Na(К)OH» (реакции 1б, 2б) ![]() , т.е. равновесие сдвинуто вправо, данные реакции в растворе должны протекать с большим выходом. Хотя термодинамически в данных доломитощелочных системах возможны все пять химических процессов, при введении в сферу реакции воды наиболее вероятным является процессы образования Mg(OH)2 по схемам 1б, 2б.
, т.е. равновесие сдвинуто вправо, данные реакции в растворе должны протекать с большим выходом. Хотя термодинамически в данных доломитощелочных системах возможны все пять химических процессов, при введении в сферу реакции воды наиболее вероятным является процессы образования Mg(OH)2 по схемам 1б, 2б.
1.2. Качественный химический анализ основных продуктов химического взаимодействия карбонатных пород со щелочами.
Для подтверждения термодинамически обусловленной реакционно-химической активности в щелочных средах MgСО3, являющегося основным компонентом доломитов и доломитизированных известняков, был выполнен качественный химический анализ, целью которого являлось определение наличия основных продуктов в результате химического взаимодействия карбонатных пород со щелочами при условии, что основными конечными продуктами являются гидроксид магния Mg(ОН)2 и карбонат соответствующего щелочного металла.
В качестве карбонатной составляющей композиционных материалов использовались карбонатные породы различной степени доломитизации. В качестве активизатора твердения (щелочного компонента) использовался гидроксид натрия NaOH и гидроксид калия КОН квалификации ЧДА.
Определение нерастворимого Mg(OH)2 основано на свойстве гидроксида магния адсорбировать некоторые красители. 1-2 капли растворенной в воде доломитощелочной смеси помещали на предметное стекло и добавляли 1-2 капли раствора реактива. В щелочной среде с магнезоном (I) Mg(OH)2 образует сине-фиолетовую окраску. Определение (Na,K)2CO3 основано на разложении карбонатов концентрированными растворами кислот с выделением углекислого газа. Навеску доломитощелочной смеси растворяли в дистиллированной воде и отфильтровывали от нерастворимого осадка. Фильтрат, содержащий ионы ![]() , обрабатывали концентрированным раствором соляной кислоты. Углекислый газ обнаруживали известковой водой (насыщенный раствор Са(OH)2) по выпадению осадка карбоната кальция. Результаты экспериментов приведены в табл. 3.
, обрабатывали концентрированным раствором соляной кислоты. Углекислый газ обнаруживали известковой водой (насыщенный раствор Са(OH)2) по выпадению осадка карбоната кальция. Результаты экспериментов приведены в табл. 3.
Таблица 3
Качественное содержание основных продуктов реакции бруситизации
|
Вид карбонатной породы |
Вид щелочного активизатора |
Mg(ОН)2 |
(Na,K)2CO3 |
|
Магнезит |
NaОН |
+ |
+ |
|
КОН |
+ |
+ |
|
|
Доломит |
NaОН |
+ |
+ |
|
КОН |
+ |
+ |
|
|
Доломитизированный известняк |
NaОН |
+ |
+ |
|
КОН |
+ |
+ |
|
|
Кальцит |
NaОН |
– |
– |
|
КОН |
– |
– |
Продукты реакционно-химического процесса обнаружены при взаимодействии со щелочами магнезита, доломита и доломитизированного известняка. При взаимодействии же кальциевой карбонатной породы со щелочами данных продуктов реакции обнаружено не было. Таким образом, результаты проведенного качественного химического анализа подтверждают реакционно-химическую активность карбонатных пород, содержащих MgСО3, со щелочами.
В доломитощелочной системе химическое взаимодействие протекает на поверхности раздела сосуществующих фаз. Различают два типа превращений твердых веществ [1; 6]: 1) протекающие без изменения химического состава фаз; 2) сопровождающиеся появлением фаз с измененным химическим составом. Экспериментальным путем доказано, что химическое взаимодействие в доломитощелочной системе связано с возникновением фаз измененного состава, вследствие чего превращения в этой системе могут быть отнесены к превращениям второго типа.
В процессе физико-химического изменения доломитощелочной смеси можно выделить пять основных стадий [2]:
1) адсорбция щелочного реагента на твердой поверхности карбонатной породы;
2) химическое взаимодействие реагента с карбонатной породой с образованием твердого Mg(ОН)2 и ионно-растворенного карбоната щелочного металла Ме2СО3;
3) десорбция продуктов реакции с твердой поверхности;
4) обратная диффузия продуктов реакции и их выход в жидкую фазу;
5) диффузия новых порций щелочного реагента к твердой поверхности карбонатной породы.
В общем виде карбонатная порода реагирует со щелочью, образуя твердый гидроксид магния Mg(ОН)2 и ионно-растворенный карбонат соответствующего щелочного металла.
Схема реакционно-химического взаимодействия карбонатной породы со щелочью представлена на рис. 1.
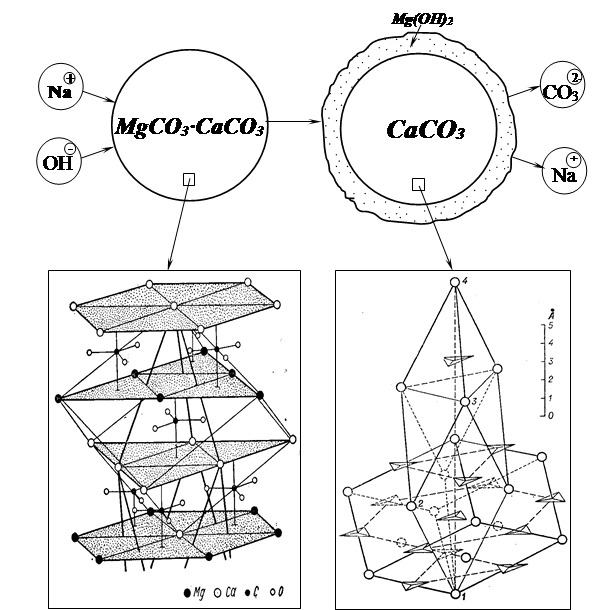
Рис. 1. Схема реакционно-химического взаимодействия зерен карбонатной породы с NaOH.
2. Применение
Проведенные исследования предопределили возможность создания композитов на основе доломитошлакового вяжущего, которые могут использоваться в качестве стеновых материалов, отделочных плиток, декоративных сплиттерных камней. Экономия от применения композиционных материалов будет достигаться за счет использования дешевых сырьевых материалов - отходов камнедробления доломитизированных известняков и исключения из технологической схемы производства сложных операций.
3. Заключение
Таким образом, проведенные термодинамический и качественный анализы на способность взаимодействия карбонатных пород со щелочами NаОН, КОН позволили выдвинуть гипотезу о возможности образования в доломитощелочной системе твердеющей структуры, основной вклад в формирование которой вносит гидроксид магния Mg(OH)2, образующийся в результате химической реакции.
Рецензенты:
Фокин Г.А., д.т.н., профессор кафедры физики и химии, Пензенский государственный университет архитектуры и строительства, г. Пенза.
Вилкова Н.Г., д.х.н., профессор кафедры физики и химии, Пензенский государственный университет архитектуры и строительства, г. Пенза.



