Введение
Нейростимуляция представляет собой важный раздел альтернативной терапии для пациентов с фармакорезистентными формами эпилепсии, а также для больных, которые не могут быть подвергнуты хирургическому лечению. На стадии разработки эффективных методик находятся: стимуляция тройничного нерва, ультразвуковая стимуляция мозга и ритмическая транскраниальная магнитная стимуляция (рТМС) [1, 5, 7]. Разработка новых методов нейростимуляци направлена на поиск оптимальных режимов воздействия. Для внедрения новых средств, технологий лечебных воздействий, а также изучения основных «мишеней» и механизмов противосудорожного действия препаратов и физических факторов используется экспериментальное моделирование различных форм эпилепсий и эпилептических приступов [2, 3, 4, 6].
Целью нашего исследования явилось изучение закономерностей противосудорожного действия импульсных магнитных полей (ИМП) напикротоксиновой модели судорог при рТМС, поскольку этот метод позволяет безболезненно и неинвазивно вызвать стимуляцию структур мозга посредством индуцированных токов, способных блокировать нейрональную гиперсинхронизацию. В современной литературе данные об исследовании эффективности противосудорожного действия транскраниальной магнитной стимуляции с использованием модели пикротоксиновых судорог отсутствуют. Данная модель является важной для понимания механизмов антиконвульсивного действия ИМП.
Материалы и методы
Эксперименты проведены на аутбредных мышах-самцах массой 24±0,3 г. При выполнении пикротоксиновой модели опытная группа составила 450 животных, контрольная – 147. Пикротоксин («Sigma», США) инъецировали в дозе 2,5 мг/кг подкожно через 5 минут после процедуры рТМС или ложного воздействия. Затем в течение 30 минут у каждого животного, помещенного в отдельный контейнер, визуально регистрировали латентный период наступления миоклонусов и клонических приступов, рассчитывали частоту развития судорог с потерей ортостатического рефлекса, общее количество судорожных приступов и общую продолжительность судорожного периода.
При выполнении исследования режимы рТМС варьировали по частоте стимуляции (0,1, 0,3, 0,5, 1,0 и 10 Гц), интенсивности магнитного импульса (10, 20 и 40 % максимальной магнитной индукции (ММИ) большого кольцевого койла) и количеству процедур (1, 3, 10). В качестве источника рТМС использовали аппарат «Нейро-МС» (Россия) с кольцевым койлом диаметром 15 см. Ритмическая ТМС длительностью 5 минут проводилась ежедневно в одно и то же время суток.
Для статистической обработки результатов в зависимости от типа анализируемых значений и характера распределения использовали параметрические и непараметрические методы, включая однофакторный дисперсионный анализ ANOVA c post-hoc обработкой результатов, многофакторный дисперсионный анализ,однофакторный ранговый сравнительный анализ Крускала–Уоллиса c последующим множественным сравнением по критерию Данна; критерий Уилкоксона. Различия считались достоверными при уровне значимости p<0,05.
Результаты исследования и их обсуждение
Латентный период (ЛП) развития миоклонусов в контроле составил в среднем 142,4±1,96 секунды (n=147). Ритмическая ТМС в 43 из 45 изученных режимов воздействия статистически достоверно, при высоких уровнях значимости увеличивала ЛП миоклонусов (рисунок 1), что свидетельствует о ее выраженно мантиконвульсивном эффекте.
Как видно на рисунке 2, увеличение ЛП миоклонусов при различных сочетаниях параметров рТМС значительно варьирует, однако, выявляемое по данному показателю снижение судорожной возбудимости мозга под влиянием магнитной стимуляции является закономерным, что подтверждают результаты интегральной оценки зависимости влияния рТМС на ЛП миоклонусов от параметров воздействия – числа сеансов, частоты и мощности импульсов. Данные рисунка 2А наглядно иллюстрируют, что при интегральной оценке 1-, 3- и 10-кратные воздействия рТМС закономерно приводят к увеличению времени появления миоклонусов на 30–60 % (р<0,001). Примечательно, что 10-кратные процедуры при этом примерно в 2 раза более эффективны, чем одно- и трехкратные (р<0,001). Влияние частоты импульсов магнитного поля на ЛП миоклонусов (рисунок 2Б) также является однозначным: ЛП существенно возрастает при всех испытанных частотах стимуляции (р<0,001), но наиболее значительно – при стимуляции с частотами 1 и 10 Гц (р<0,02) при сравнении с другими частотами. Эффекты мощности импульсов в интервале 10–40 % ММИ по критерию ЛП миоклонусов (рисунок 2В) значимо различались между собой при наличии высокой статистической достоверности влияния этого параметра в целом (р<0,001). Наиболее эффективны были воздействия с интенсивностью 20 % ММИ (р<0,01). Многофакторным дисперсионным анализом установлено, что в реализации угнетающего влияния рТМС на судорожную готовность мозга у мышей, оцениваемую по ЛП миоклонусов, достоверную значимость имеют вариации всех параметров воздействия и их сочетаний.
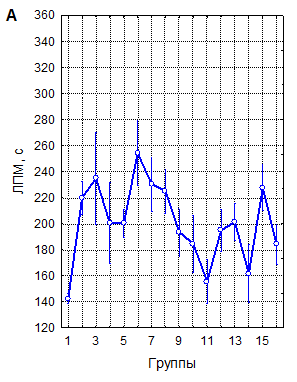
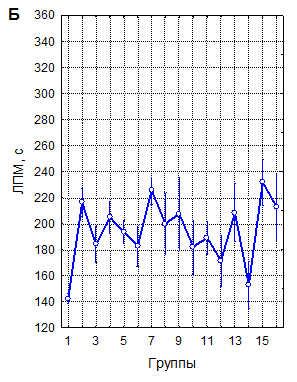
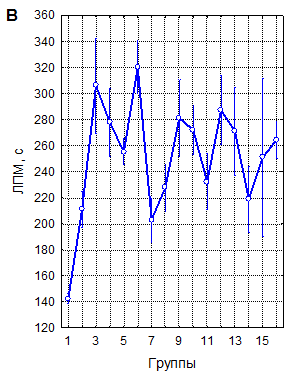
А – однократная рТМС; Б – трехкратная рТМС; В – десятикратная рТМС
1 – контроль; 2 – 10 Гц, 40 % ММИ; 3 – 10 Гц, 20 % ММИ; 4 – 10 Гц, 10 % ММИ; 5 – 1 Гц, 40 % ММИ; 6 – 1 Гц, 20 % ММИ; 7 – 1 Гц, 10 % ММИ; 8 – 0,5 Гц, 40 % ММИ; 9 – 0,5 Гц, 20 % ММИ; 10 – 0,5 Гц, 10 % ММИ; 11 – 0,3 Гц, 40 % ММИ; 12 – 0,3 Гц, 20 % ММИ; 13 – 0,3 Гц, 10 % ММИ; 14 – 0,1 Гц, 40 % ММИ; 15 – 0,1 Гц, 20 % ММИ; 16 – 0,1 Гц, 10 % ММИ. Вертикальные линии – 95 % доверительные интервалы. Красной линией указан уровень контроля
Рисунок 1. Латентный период развития миоклонусов (ЛПМ) у мышей в пикротоксиновом тесте после воздействия рТМС в различных режимах
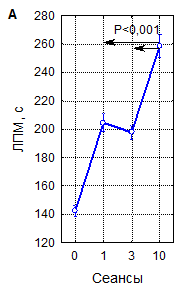
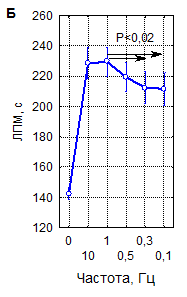
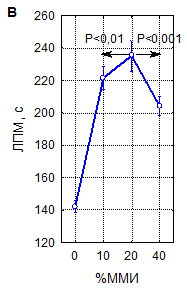
Рисунок 2. Интегральные эффекты параметров рТМС (числа сеансов (А), частоты (Б) и мощности импульсов (В)) при оценке по влиянию на латентный период развития миоклонусов (ЛПМ) в пикротоксиновом тесте у мышей
Примечание – вертикальные линии – 95 % доверительные интервалы, пунктиром указан уровень контроля. Уровень статистической значимости различий в сравнении с контролем (р, критерий Дункана) при всех представленных на рисунке вариантах параметров рТМС<0,0001.
Следовательно, антиконвульсивный эффект рТМС на данной модели является результирующей сочетанного влияния частоты импульсной стимуляции, мощности импульсов и числа процедур воздействия ИМП, при вариабельности которых эффективность рТМС может значимо изменяться.
Таким образом, результаты, полученные в пикротоксиновом тесте по критерию задержки развития миоклонусов, подтверждают, что антиконвульсивный эффект низкоинтенсивных рТМС является закономерным явлением.
Латентный период развития клонических приступов (ЛПКП) в контроле составил 309±3,8 секунды. Ритмическая ТМС в 44 из 45 режимов воздействия статистически достоверно с высоким уровнем значимости увеличивала время развития клонических судорог, которое возрастало в большинстве случаев в 1,5–2 раза. Девиация ЛПКП после рТМС проявляется закономерным увеличением этого показателя, хотя количественно эффекты довольно вариабельны в зависимости от режимов стимуляции. Ритмическая ТМС закономерно увеличивает латентное время наступления клонических судорог с высоким уровнем значимости (р<<0,001) независимо от числа сеансов воздействия. Эффекты частоты стимуляции на ЛП клонических судорог также является однозначными: во всем диапазоне испытанных частот рТМС существенно увеличивает ЛП клонических судорог (р<<0,001) при отсутствии значимых различий в эффективности различных частот. Как и по ЛП миоклонусов, доминирующий эффект мощности импульсов в отношении ЛП клонических судорог отмечался при 20 % ММИ наряду с высокой статистической достоверностью влияния этого параметра в целом (р<<0,001).
Показателями, характеризующими интенсивность пикротоксиновых судорог, являются частота развития судорог с потерей ортостатического рефлекса, общее количество судорожных приступов (КСП) и общая продолжительность судорожного периода (ОПСП). Защита от судорог максимальной степени тяжести существенно колеблется в зависимости от режимов рТМС, однако число эффективных режимов при 10-кратной стимуляции наибольшее и составляет 13 из 15, что означает высокую достоверность наличия антиконвульсивного эффекта рТМС при оценке по критерию Фишера (p<0,001).
Ритмическая ТМС во всех без исключения режимах воздействия в 1,5–2 раза уменьшала количество судорожных припадков, причем эффективность 10-кратной стимуляции суммарно была наибольшей. Результаты интегральной оценки влияния вариаций параметров рТМС на общее количество судорог показали зависимость эффекта рТМС от числа сеансов по параметру КСП: 1-кратные, 3-кратные и 10-кратные стимуляции закономерно приводят к снижению количества приступов в среднем с 38 до 24–26, причем эффект 10-кратных воздействий является наибольшим при высоких уровнях значимости в сравнении с эффектами 1-3-кратных воздействий (р<0,02–0,001).
Влияние частоты импульсов магнитного поля на количество приступов также является однонаправленным: рТМС во всем диапазоне испытанных частот КСП существенно уменьшает (р<0,001), причем эффекты вариаций частоты малозначимы. Эффекты влияния вариаций мощности импульсов в интервале 10–40 % ММИ на общее количество приступов также значимо не различались при наличии высокой статистической достоверности влияния этого параметра в целом (р<<0,001). Многофакторный дисперсионный анализ позволил установить, что в реализации антиконвульсивного эффекта рТМС, оцениваемого по критерию КСП, достоверную значимость имеют вариации числа процедур и его сочетаний с частотой и мощностью импульсов, а также сочетание всех трех параметров стимуляции; в то время как изолированные эффекты вариаций частоты и мощности импульсов были малозначимы. Таким образом, в пикротоксиновом тесте по данному критерию проявления судорог подтверждена закономерность, согласно которой рТМС обладает антиконвульсивным эффектом примерно равной силы при мощностях импульсов (0,12–0,48 Тл).
Общая продолжительность судорожного периода (ОПСП) в пикротоксиновом тесте также относится к важнейшим критериальным показателям судорожной возбудимости мозга, так как при ее угнетении судороги возникают и исчезают при больших концентрациях конвульсанта в области мишеней, что приводит в итоге к сокращению продолжительности гиперкинеза, поскольку фармакокинетическая кривая концентрации конвульсанта в мозгу имеет холмообразную форму. Как показал статистический анализ, ОПСП достоверно коррелирует с параметром КСП (r=0,67, р<0,05) и обнаруживает сходные с ним закономерности девиации после рТМС в различных режимах, включая сходные профили зависимости от характеристик магнитной стимуляции.
Выводы или заключение
Проведенные исследования позволили выявить эффективные режимы рТМС в отношении редукции различных проявлений пикротоксиновых судорог и обозначить ряд особенностей их действия. Выявлена зависимость редукции критериальных показателей данной конвульсивной модели от различных параметров рТМС.
Ритмическая ТМС во всех изученных режимах воздействия с высоким уровнем достоверности (р<0,005) уменьшает количество судорожных припадков на пикротоксиновой модели в 1,5–2 раза, причем эффективность 10-кратной стимуляции суммарно была наибольшей. Наиболее стойкий и значимый эффект по критерию снижения судорожной готовности мозга, оцениваемой по ЛП миоклонусов в пикротоксиновом тесте, рТМС оказывает при 10-кратном воздействии с интенсивностью 20% ММИ в диапазоне частот 0,5–1 Гц.
Параметр количества судорожных приступов – прямой индикатор судорожной возбудимости мозга и реципрокно – состояния его тормозных механизмов. По общему количеству судорожных приступов (КСП), являющемуся важнейшим критериальным показателем тяжести судорожного синдрома, многофакторным дисперсионным анализом подтверждается доминирующая нейродепрессивная активность 10-кратной рТМС подпороговой интенсивности.
Таким образом, снижая общее количество судорог и длительность судорожного периода, рТМС активирует тормозные функции мозга.
Совокупность полученных данных свидетельствует о том, что рТМС способна модулировать соотношение процессов возбуждения и торможения в различных типах клеток и локальных нейронных сетях в зависимости от частоты и интенсивности импульсного магнитного поля, а также от числа воздействий импульсным магнитным полем.
Полученные данные экспериментально обосновывают целесообразность клинического использования низкоинтенсивных рТМС в качестве лечебного фактора в сочетанной терапии эпилепсии.
Рецензенты:
Кульчицкий В.А., д.м.н., профессор, заместитель директора по научной работе, ГНУ «Институт физиологии НАН Беларуси», г.Минск.
Шамова Т.М., д.м.н., профессор, профессор кафедры неврологии и нейрохирургии, УО «Гродненский государственный медицинский университет», г.Гродно.



