Известно, что многие представители классов сульфонилазотсодержащих соединений (сульфониламидины, амиды, гуанидины, мочевины и др.) обладают высокой биологической активностью и применяются в качестве лекарственных препаратов нового поколения пестицидов, эффективных заменителей сахара, а также в других сферах жизнеобеспечения человека [1, 2, 6]. Поэтому разработка методов синтеза новых классов сульфонил-азотсодержащих соединений является важной проблемой современной химической науки.
В последние годы в качестве структурных блоков для получения сульфонилазотсодержащих соединений широко используются аддукты, комплексы, реакционные частицы и другие интермедиаты, легко образующиеся при взаимодействии триоксида серы с цианогруппами нитрилов и других цианосодержащих соединений.
Перспективными реагентами в этом плане оказываются гетероциклические аддукты нитрилов и триоксида серы – 2,6-дизамещенные 1,4,3,5-оксатиадиазин-4,4-диоксиды [4].
Целью данной работы является изучение новых путей синтеза сульфонилазотсодержащих соединений на основе взаимодействия цианидов с 2,6-дизамещенными 1,4,3,5-оксатиадиазин-4,4,-диоксидами.
Ранее нами было показано, что 2,6-дизамещенные 1,4,3,5-оксатиадиазин-4,4-диоксиды (I) реагируют с дизамещенными цианамидами с образованием различных соединений [4].
В данной работе подробно исследовано влияние природы заместителей (R1 и R2) в диоксиде (I) и возможность использования по аналогии с цианамидами других классов цианосодержащих реагентов в реакции:
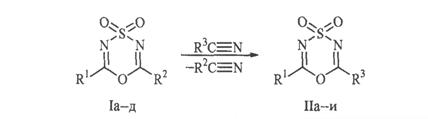
I, R1 = CCl3, R2 = 4-NO2C6H4 (a); R1 = CCl3, R2 = 4-ClC6H4 (б); R1 = CCl3, R2 = CH2=C-CH3 (в); R1 = CBr3, R2 = CH3 (г); R1 = C6F5, R2 = CH3 (д); II, R1 = CCl3, R3 = 4-ClC6H4 (а); R1 = CCl3, R3 = C6H5 (б); R1 = CCl3, R3 = (CH3)2CHS (в); R1 = CCl3, R3 = пиперидино (г); R1 = CBr3, R3 = пиперидино (д); R1 = CBr3, R3 = морфолино (е); R1 = CBr3, R3 = (С2H5)2N (ж); R1 = C6F5, R3 = пиперидино (з); R1 = R3 = CCl3 (и).
В качестве реагентов был взят большой ряд соединений, цианогруппы которых, как сильно нуклеофильны (цианамиды, тиоцианаты), так и напротив, характеризуются большим дефицитом электронной плотности (трихлорацетонитрил).
К раствору соответствующего диоксида (I) в бензоле прибавляли эквимолярное количество цианида и выдерживали при 60˚С в атмосфере осушенного азота. Смесь выдерживали при этой температуре определенное время. Растворитель удаляли, остаток обрабатывали гексаном. Получили диоксиды (II а-и). Продолжительность реакций, выходы, температуры плавления, ИК-спектры диоксидов (II а-и) приведены в табл. 1, спектры ЯМР 1Н диоксидов (II в-д, з) и элементный состав диоксидов (II в, д-з) представлены в табл. 2. ИК-спектры соединений записаны на спектрофотометрах UR-20 и Specord 80-M в метиленхлориде. Спектры ЯМР 1Н записаны на спектрометре Gemini 300 (рабочая частота 300 МГц), внутренний стандарт – ТМС.
Таблица 1
Продолжительность реакции, выходы, температуры плавления и ИК-спектры диоксидов (II а-и)
|
№ соединения |
Время, ч (60˚C, C6H6) |
Выход, % |
Т. пл. (разл.), ˚C |
ИК-спектр, |
|
|
SO2 |
C=N |
||||
|
IIа |
7 |
96 |
125-126а |
1190, 1350 |
1635, 1730 |
|
IIб |
4 |
97 |
152-154б |
1200, 1400 |
1640, 1725 |
|
IIв |
4 |
95 |
127 |
1180, 1350 |
1635, 1725 |
|
IIг |
5 |
85 |
144в |
1170, 1395 |
1680, 1750 |
|
IIд |
5 |
94 |
152 |
1180, 1375 |
1650, 1725 |
|
IIе |
5 |
89 |
178 |
1185, 1360 |
1650, 1720 |
|
IIж |
5 |
93 |
139 |
1180, 1360 |
1655, 1720 |
|
IIз |
9 |
93 |
138 |
1185, 1360 |
1670, 1730 |
|
IIи |
9 |
94 |
146-147 |
1185, 1385 |
1720 |
Примечание. а Лит. т. пл. 125-126˚С [5]. б Лит. т. пл. 153-155˚С [5]. в Лит. т. пл. 144˚С [5].
Таблица 2
Спектры ЯМР 1Н и данные элементного анализа диоксидов (IIв-з)
|
№ соединения |
Спектр ЯМР 1Н, δ, м. д. |
Найдено/вычислено, % |
Формула |
||||
|
С |
Н |
Hlg |
N |
S |
|||
|
IIв |
1.24 д (6Н, СН3), 3.12-3.84 м (1Н, СН)а |
23.07 23.11 |
2.19 2.25 |
34.21 34.19 |
4.50 4.49 |
20.50 20.58 |
C6H7Cl3NO3S2 |
|
IIг |
1.48-1.84 м (6Н, СН2),3.44-3.82т [4H, (CH2)2N]б |
- |
- |
- |
- |
- |
- |
|
IIд |
1.75-1.99 м (6H, CH2),3.50-3.81т [4H, (CH2)2N]б |
20.75 20.53 |
2.13 2.15 |
51.11 51.22 |
8.81 8.98 |
6.83 6.88 |
C8H10Br3N3O3S |
|
IIе |
- |
17.95 17.90 |
1.70 1.72 |
51.10 51.04 |
8.98 8.94 |
6.80 6.78 |
C7H8Br3N3O4S |
|
IIж |
- |
18.48 18.45 |
1.10 1.11 |
52.62 52.60 |
5.25 5.27 |
7.00 7.08 |
C7H5Br3N2O3S |
|
IIз |
1.55-1.70 м (6Н, СН2),3.50-3.65т [4H, (CH2)2N]б |
40.81 40.74 |
2.60 2.63 |
24.72 24.78 |
10.75 10.96
|
8.32 8.35 |
C13H10F5N3O3S |
Примечание. а Спектр ЯМР 1Н в CDCl3. б Спектры в ацетоне-d6.
В результате работы выявлено, что направление взаимодействия цианогруппы реагента контролируется также, прежде всего, электронными эффектами заместителей в субстрате (I).
Установлено, что замена иминного фрагмента R2CN в субстрате протекает при взаимодействии диоксидов (I), имеющих сильные акцепторные группы R1 (CCl3, CBr3, C6F5) и слабые электроноакцепторные или донорные группы R2 (4-NO2C6H4, 4-ClC6H4, CH3). Это направление реализуется, как правило, при использовании в реакции соединений, имеющих более нуклеофильные цианогруппы по отношению к нитрилу, выделяемому в реакции из цикла диоксида (I).
Также установлено, что при резком увеличении электроноакцепторных свойств заместителя R2 в диоксиде (I) (R2 = CCl3) и повышении нуклеофильности цианогруппы в цианиде R3CN (при использовании в реакции вместо нитрилов цианамидов) изменяется направление реакции. В этом случае происходит образование 2,4,6-тризамещенных 1,2,3,5-оксатиадиазин-2-оксидов, описанных в работе [3].
Полученные в ходе работы данные позволяют предположить пути протекания реакции. Замещение иминного фрагмента протекает с участием во взаимодействии с цианогруппой электрофильного атома серы и нуклеофильного атома кислорода цикла диоксида (I). Можно полагать, что различия в поведении цианидов, содержащих сильнодонорные группы, с одной стороны, и сильноакцепторные - с другой, обусловлены образованием в реакции различных интермедиатов. Диоксиды (I), имеющие сильноакцепторные (R1 = CCl3, CBr3, C6F5) и менее акцепторные группы (R2 = 4-NO2C6H4, C6H5, CH2=C(CH3), CH3) реагируют с нитрилами, имеющими донорные или слабоакцепторные группы (C6H5, 4-ClC6H4), по-видимому, по типу [4+2]-циклоприсоединения.
В реакциях тех же диоксидов с цианамидами и тиоцианатами, цианогруппы которых обладают более высокой нуклеофильностью за счет сильных пара-донорных групп, больший вклад во взаимодействие вносится за счет координирования атомов серы в диоксиде (I) и азота цианогруппы и реакция идет по типу замещения.
При взаимодействии указанных диоксидов (I) с трихлорацетонитрилом, характеризующимся большим дефицитом электронной плотности на цианогруппе, больший вклад вносится за счет координирования атома кислорода гетероцикла (I) и атома углерода цианогруппы.
Если же исходный диоксид (I) имеет два сильных акцепторных заместителя R1 и R2, его взаимодействие с достаточно нуклеофильными цианогруппами (цианамиды) не приводит к образованию продуктов переиминирования.
Таким образом, выявлены четкие критерии осуществимости реакции 2,6-дизамещенных 1,4,3,5-оксатиадиазин-4,4-диоксидов с нитрилами, тиоцианатами и N,N-дизамещенными цианамидами, селективно протекающей с заменой иминного фрагмента в исходном субстрате соответствующим фрагментом цианида. Эта реакция позволит целенаправленно вводить заместители с заданными свойствами в молекулу диоксида (I), не нарушая ее гетероциклической структуры.
Рецензенты:
Казанцев О.А., д.х.н., профессор кафедры «Химическая технология органических веществ», заместитель директора по научно-исследовательской работе, Дзержинский политехнический институт (филиал) федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Нижегородский государственный технический университет имени Р.Е. Алексеева», г. Дзержинск;
Данов С.М., д.т.н., профессор, заведующий кафедрой «Химическая технология органических веществ», Дзержинский политехнический институт (филиал) федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Нижегородский государственный технический университет имени Р.Е. Алексеева», г.Дзержинск.



