Введение
Одним из важнейших продуктов химии и химической технологии является серная кислота. Большое количество её используется в качестве рабочей среды или водоотнимающего средства, и после её применения в основных производствах она не входит в состав конечных продуктов, а выводится в виде отходов. По данным [6; 7], насчитывается более 200 видов сернокислотных отходов, а их годовой объем составляет около 10% общего производства серной кислоты при ежегодном приросте 2,5–3,0%. Несмотря на существенную тенденцию замены процессов на базе серной кислоты более совершенными и малоотходными технологиями, на современном уровне развития науки и техники применение серной кислоты и олеума в ряде производств не может быть исключено. Поэтому проблема утилизации сернокислых отходов актуальна в настоящее время и в перспективе.
Одним из способов утилизации сернокислотных отходов является повторное использование. В производстве высокоэнергетических веществ (ВВ) образуется большое количество отработанной серной кислоты (ОСК), содержащей оксиды азота и азотную кислоту. Такую кислоту денитрируют и после концентрирования до 92–93% H2SO4 направляют для приготовления нитрирующей смеси.
В реальном процессе на денитрацию поступает ОСК с массовой долей серной кислоты 67–70%.
Денитрацию ОСК в действующем производстве ВВ производят в тарельчатой денитрационной колонне при непосредственном контакте с водяным паром. Максимальная степень денитрации достигается при температуре вверху колонны 115–120 °С, внизу колонны 150–160 °С. Повышение температуры в верхней части колонны ведет к интенсивному пенообразованию при выделении оксидов азота и наличии в кислоте нитросоединений. Пена может уноситься газами в абсорбционную систему. Верхний предел температуры ограничивается температурой кипения кислоты.
Особенностью работы денитрационной колонны является высокая нагрузка по жидкой фазе и значительные изменения расхода газовой фазы по высоте колонны. При денитрации ОСК водяным паром массовое соотношение расходов жидкости и пара в колонне составляет 10 : 1, а расход газовой фазы вверху колонны уменьшается в 5–7 раз. Для интенсификации процесса денитрации, прежде всего, нужно стабилизировать гидродинамический режим работы по высоте колонны. С этой целью было предложено проводить процесс денитрации паровоздушной смесью при одновременном исключении подсоса воздуха в абсорбционную систему.
Цель исследования
Исследовать равновесные парциальные давления оксидов азота (II) и (III), азотной кислоты в нитрозе, содержащей 0,5-4,0% N2O3, 70% H2SO4 в интервале температур 293 - 433 К.
Методы исследования
Для расчета колонны необходимо знание равновесного парциального давления оксидов азота и азотной кислоты над нитрозой с массовой долей серной кислоты 70%. Такое исследование было выполнено в интервале температур 293-433 К и нитрозности кислоты 0,5-4,0% N2O3. В известных источниках информации такие данные отсутствуют.
Растворы для исследования готовили путем растворения кристаллов нитрозилсерной кислоты в серной кислоте с исходной концентрацией 70% H2SO4.
Известно [4], что в нитрозе, исходная серная кислота которой меньше 73% H2SO4, происходит распад азотистой кислоты, образующейся при гидролизе нитрозилсерной кислоты на азотную кислоту и оксид азота (II) по уравнению
3 HNO2 → HNO3 + 2NO + H2O.
Соответственно в растворе появляется свободная азотная кислота. Чем выше содержание оксида азота (III), тем больше концентрация свободной азотной кислоты в нитрозе.
Методика эксперимента и обработки полученных данных были описаны ранее [1].
Результаты исследования
Впервые были определены равновесные парциальные давления не только оксида азота (III) и азотной кислоты, но и оксида азота (II).
На рисунке 1 представлена зависимость парциального давления оксида азота (II) от нитрозности раствора и температуры. Как видно из рисунка, чем выше нитрозность раствора, тем интенсивнее растет упругость пара оксида азота (II) с ростом температуры. Особенно сильно растет упругость пара оксида азота (III) (рис. 2) и суммарное давление с повышением нитрозности раствора (рис. 4). Зависимость давления пара азотной кислоты от нитрозности и температуры дана на рисунке 3.
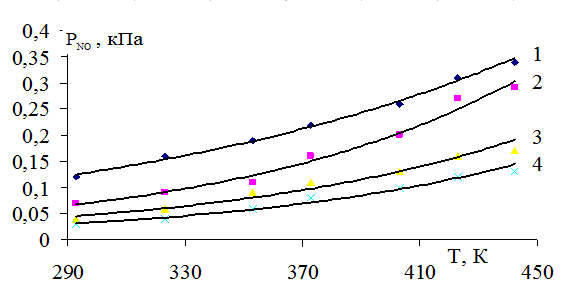
Рис. 1. Зависимость парциального давления оксида азота (II) от температуры при нитрозности: 1 - 4,0; 2 - 2,5; 3 - 1,5; 4 - 0,5% N2O3
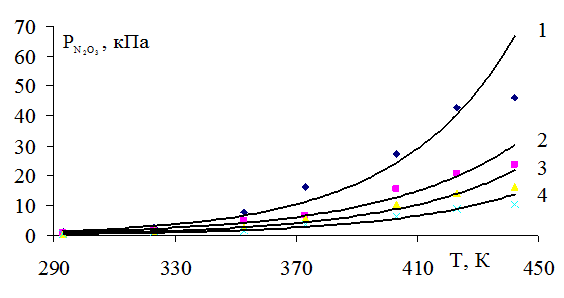
Рис. 2. Зависимость парциального давления оксида азота (III) от температуры при нитрозности: 1 - 4,0; 2 - 2,5; 3 - 1,5; 4 - 0,5% N2O3
По полученным опытным данным было выведено эмпирическое уравнение для определения как равновесного парциального давления оксидов азота и азотной кислоты, так и суммарного давления паров в интервале исследованных температур и нитрозности кислоты.
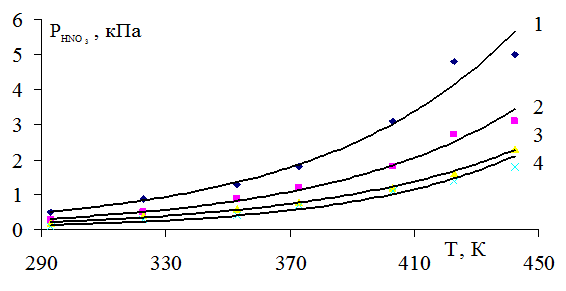
Рис. 3. Зависимость парциального давления азотной кислоты от температуры при нитрозности: 1 - 4,0; 2 - 2,5; 3 - 1,5; 4 - 0,5% N2O3
На рисунке 4 представлено суммарное давление паров оксидов азота и азотной кислоты от температуры.
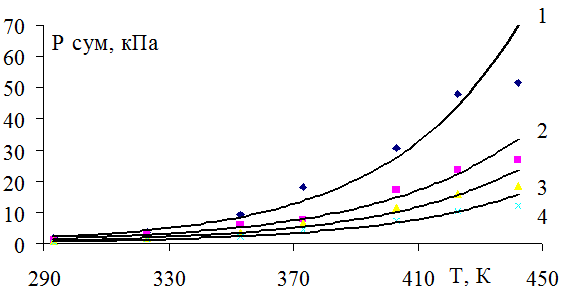
Рис. 4. Зависимость суммарного давления паров от температуры при нитрозности: 1 – 4,0; 2 – 2,5; 3 – 1,5; 4 – 0,5% N2O3
Полученное уравнение представлено ниже
![]() ,
,
где Р – равновесное парциальное давление, кПа; Т – температура, К; ![]() – нитрозность кислоты, % масс.
– нитрозность кислоты, % масс.
Значения коэффициентов приведены в таблице 1.
Таблица 1. Значения коэффициентов
|
a |
b |
c |
d |
e |
f |
g |
h |
|
|
|||||||
|
0,0003 |
-0,00165 |
0,0022 |
0,0093 |
0,0907 |
-0,5005 |
0,5374 |
3,1856 |
|
|
|||||||
|
-0,0002 |
0,00167 |
-0,0041 |
0,0096 |
-0,0766 |
0,5997 |
-1,5584 |
3,8662 |
|
|
|||||||
|
-0,0002 |
0,0011 |
-0,0017 |
0,0050 |
-0,0691 |
0,3879 |
-0,7799 |
3,1039 |
|
Рсум |
|||||||
|
0,00009 |
-0,00052 |
0,0006 |
0,0094 |
0,0354 |
-0,1873 |
0,0275 |
3,0721 |
Максимальное отклонение расчетных данных от экспериментальных не превышает ± 6%.
Полученные экспериментальные данные можно использовать для расчета оборудования и выяснения механизма гидролиза нитрозилсерной кислоты [2; 3; 5].
Выводы
1. Изучены равновесные парциальные давления оксидов азота и азотной кислоты над нитрозой, содержащей 0,5 – 4,0% N2O3, 70% H2SO4 в интервале температур 293 – 433 К.
2. Выведено эмпирическое уравнение для расчета парциальных давлений оксидов азота и азотной кислоты, а также суммарное давление в изученном интервале изменения параметров процессов.
Рецензенты:
Ксандров Н.В., д.т.н., профессор, зав. кафедрой ТНВ Дзержинского политехнического института НГТУ им. Р.Е. Алексеева, г. Дзержинск.
Ульянов В.М., д.т.н., профессор, профессор кафедры МАХПП Дзержинского политехнического института НГТУ им. Р.Е. Алексеева, г. Дзержинск.



