Распространенным заболеванием людей старшего возраста является нарушение мозгового кровообращения. Одним из эффективных лекарственных препаратов для лечения этого заболевания является циннаризин, выпускаемый в виде таблеток по 0,025 г. Однако при длительном приеме этого препарата возможно появление побочного действия [1]. Во избежание этого целесообразно разработать ректальную лекарственную форму препарата, лишенную этого недостатка. В литературе имеются сообщения о целесообразности и эффективности замены пероральных лекарственных препаратов ректальными [2, 3].
Целью исследования явилась разработка состава, технологии и стандартизация рациональной лекарственной формы – суппозиториев с циннаризином 0,025 г и кислотой янтарной 0,1 г. Кислота янтарная улучшает клеточное дыхание и работу мозга, печени, почек, усиливает действие других лекарств. Сочетание таких лекарственных препаратов будет эффективно при лечении гериатрических больных.
Материалы и методы исследования
В работе использовали методы: спектрофотометрии, хроматографии в тонком слое сорбента, диализа через полупроницаемую мембрану, термического разложения.
Выбор оптимальной основы, биодоступность циннаризина и процесс высвобождения его из суппозиториев исследовали методом диализа через полупроницаемую мембрану.
Для подтверждения подлинности и изучения продуктов деструкции рибоксина использовали метод тонкослойной хроматографии на пластинках «Сорбфил» в оптимальной системе растворителей н-пропанол–р-р аммиака 25 % (7:3). Проявляли пятна циннаризина в УФ-свете и кислоту янтарную раствором 2,6-дихлорфенолиндофенолята натрия [4].
Для количественного определения циннаризина использовали спектрофотометрический метод, кислоты янтарной – алкалиметрический.
Качество приготовленных суппозиториев оценивали согласно требованиям Государственной фармакопеи XII издания. Для этой цели использовали показатели: описание, подлинность, средняя масса суппозиториев и отклонения от нее, время растворения, температура плавления, посторонние примеси, количественное содержание.
Проведена валидационная оценка разработанных суппозиториев. Для этого использовали показатели: линейность, прецизионность, правильность.
Результаты исследования и их обсуждение
При выборе основы суппозиториев использовали липофильные: комплексную жировую основу (КЖО), масло какао, твердый жир типа А, суппоцир; гидрофильную: полиэтиленоксидную (ПЭО) и дифильную – витепсол.
Кинетику высвобождения циннаризина изучали методом равновесного диализа через полупроницаемую мембрану, диализная среда – спирт этиловый 40 %. Количественное определение его проводили спектрофотометрическим методом (253 нм) (рис. 1).
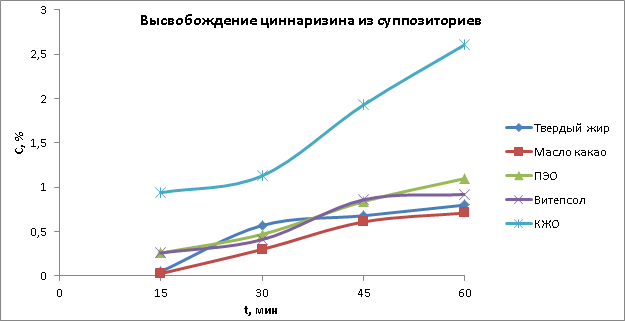
Рис. 1. Результаты высвобождения циннаризина из суппозиториев
Из рисунка 1 следует, что больше всего циннаризина высвобождается за 60 минут из полиэтиленоксидной основы (ПЭО) и комбинированной жировой основы (КЖО).
При выборе вспомогательных веществ были использованы пропиленгликоль и эмульгатор Т-2.
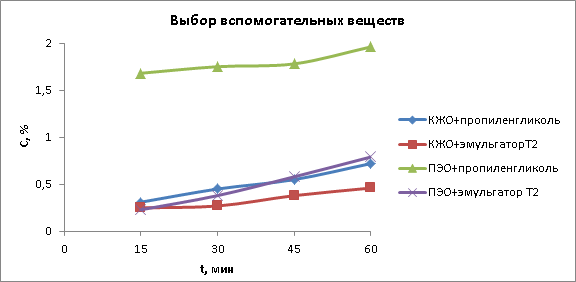
Рис. 2. Результаты выбора вспомогательных веществ
Установлено, что наибольшее количество циннаризина наблюдается при использовании полиэтиленоксидной основы и 3 % пропиленгликоля.
Для подтверждения подлинности, изучения стабильности рибоксина и обнаружения возможных продуктов деструкции был использован метод тонкослойной хроматографии на пластинках «Сорбфил». В работе использовали ряд систем, содержащих полярные и неполярные растворители (табл. 1).
Таблица 1
Результаты выбора системы растворителей
|
Состав системы |
|
Время, мин |
|
|
циннаризин |
янтарная кислота |
||
|
Система 1: гексан – ацетон – бензол – раствор аммиака 25%(35:25:15:1) |
0,67 |
0 |
14 |
|
Система 2: этанол 40 % - хлороформ – раствор аммиака 25 % (70:40:20:20) |
0,94 |
0,75 |
60 |
|
Система 3: этилацетат – муравьиная кислота – вода (3:1:1) |
0,1 |
0 |
33 |
|
Система 4: н-пропанол – р-р аммиака 25 % (70:30) |
0,88 |
0,54 |
50 |
Из таблицы 1 следует, что оптимальной системой является н-пропанол – раствор аммиака 25 %.
Для изучения возможных продуктов деструкции было проведено термическое разложение циннаризина, кислоты янтарной и их модельной смеси (0,025:0,1). Лекарственные вещества помещали в бюкс и нагревали в сушильном шкафу при температуре 105 °С. Контроль проводили через каждые сутки методом тонкослойной хроматографии (рис. 3).
Установлено, что через 3 суток термического разложения обнаружены дополнительные пятна продукта деструкции циннаризина с ![]() =0,71. Такое же пятно обнаружено после термического разложения смеси циннаризина и кислоты янтарной. Таким образом, при обнаружении дополнительного пятна с указанным значением
=0,71. Такое же пятно обнаружено после термического разложения смеси циннаризина и кислоты янтарной. Таким образом, при обнаружении дополнительного пятна с указанным значением![]() субстанцию или лекарственное вещество в суппозиториях следует считать несоответствующим требованиям ФС.
субстанцию или лекарственное вещество в суппозиториях следует считать несоответствующим требованиям ФС.
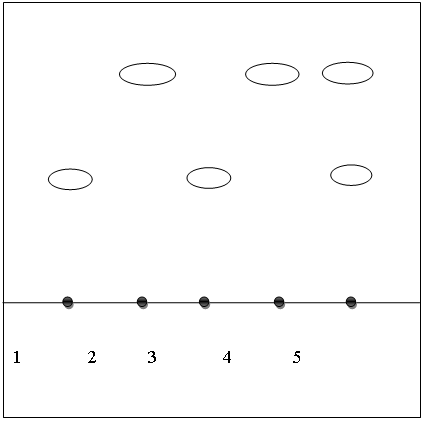
Рис. 3. Хроматограмма термического разложения в течение 3 суток
1 – СО янтарной кислоты;
2 – СО циннаризина;
3 – янтарная кислота после термического разложения;
4 – циннаризин после термического разложения;
5 – янтарная кислота + циннаризин после термического разложения.
Количественное определение циннаризина определяли спектрофотометрическим методом в максимуме поглощения при длине волны 253 нм. Кислота янтарная в этой области не имеет светопоглощения и не мешает определению циннаризина. Это подтверждает специфичность спектрофотометрического определения циннаризина.
Для количественного определения кислоты янтарной использовали алкалиметрический метод (индикатор – фенолфталеин). Результаты количественного определения компонентов суппозиториев приведены в табл. 2.
Таблица 2
Результаты количественного определения компонентов суппозиториев
|
Лекарственное вещество |
|
S |
Sx |
ΔH |
±ε,% |
|
циннаризин |
0,0251 |
0,000548 |
0,000223 |
0,000574 |
2,29 |
|
Кислота янтарная |
0,0994 |
0,00123 |
0,00050 |
0,00128 |
1,29 |
Из таблицы 2 следует, что относительная погрешность анализа циннаризина в суппозиториях не превышает ±2,29 %, кислоты янтарной ±1,29 %.
Проведена валидационная оценка спектрофотометрического анализа компонентов суппозиториев по показателям: линейность, прецизионность, правильность [5]. Для подтверждения линейности методики построены градуировочные графики циннаризина и кислоты янтарной (рис. 4, 5).
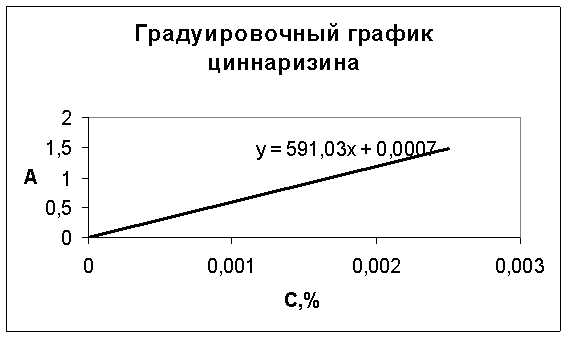
Рис. 4. Градуировочный график зависимости оптической плотности от концентрации циннаризина
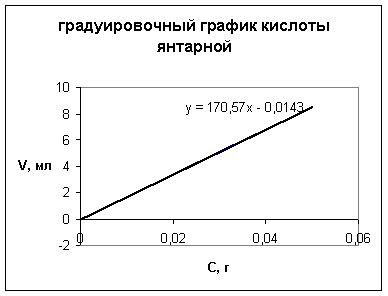
Рис. 5. Градуировочный график анализа кислоты янтарной алкалиметрическим методом
Рассчитаны уравнения градуировочных графиков и коэффициенты корреляции, равные 0,999, что подтверждает линейность разработанной методики.
Установлена прецизионность и правильность методик (табл. 3).
Таблица 3
Результаты определения прецизионности и правильности методик количественного определения компонентов
|
Показатель |
Циннаризин |
Кислота янтарная |
|
Прецизионность: относительное стандартное отклонение (RSD) |
2,81 |
1,72 |
|
Правильность: открываемость R, % |
99,75 |
99,55 |
Полученные результаты свидетельствуют о валидности методик и возможности их использования для анализа компонентов изучаемых суппозиториев.
Проведена стандартизация суппозиториев по показателям: описание, подлинность, средняя масса суппозиториев и отклонения от нее, время растворения, посторонние примеси, количественное содержание (табл. 4).
Таблица 4
Результаты стандартизации компонентов в суппозиториях
|
Показатели качества
|
Нормы качества |
Результаты |
|
описание |
суппозитории должны быть белого цвета, торпедообразной формы |
суппозитории белого цвета, торпедообразной формы |
|
подлинность |
на хроматограмме должно наблюдаться два пятна |
на хроматограмме наблюдается два пятна |
|
время растворения |
не более60 минут |
30-35 минут |
|
средняя масса суппозитория, г |
1,9-2,1 |
1,95-1,98 |
|
отклонение от средней массы, % |
±5 |
от +3,2-до -2,5 |
|
посторонние примеси |
на хроматограмме не должно быть дополнительных пятен |
на хроматограмме нет дополнительных пятен |
|
количественное содержание циннаризина, г |
0,0212-0,0287 |
0,0231-0,0262 |
|
количественное содержание кислоты янтарной, г |
0,09-0,11 |
0,097-0,101 |
Установлено, что приготовленные суппозитории по всем показателям качества соответствуют требованиям, предъявляемым к данной лекарственной форме (табл. 4).
Для установления срока годности суппозитории упаковывали в контурные упаковки из полимерных материалов и хранили их в холодильнике (4±1) ºС, подвергая контролю через 6, 12, 18, 24 месяца с помощью химических и физико-химических методов исследования. Оценку качества проводили по указанным выше показателям.
Результаты визуального контроля показали, что внешний вид суппозиториев не менялся в течение всего срока наблюдения, а суппозиторная масса оставалась однородной.
Установлено, что количество действующего вещества в процессе хранения суппозиториев практически не изменялось.
При испытании на подлинность на хроматограмме наблюдалось два пятна, соответствующие по значению Rf пятнам СО циннаризина и кислоты янтарной. Дополнительных пятен не обнаружено, что подтверждает отсутствие продуктов деструкции.
Время растворения суппозиториев не превышало 60 мин и составляло в процессе хранения 30–35 мин.
Средняя масса суппозиториев оставалась стабильной.
На основании проведенных исследований можно сделать заключение: разработанные суппозитории стабильны в течение 24 мес., что позволяет установить срок их хранения – 2 года.
Выводы. Разработана технология суппозиториев с циннаризином и кислотой янтарной, выбрана оптимальная основа и вспомогательное вещество. Разработана методика идентификации компонентов и продукта деструкции циннаризина методом хроматографии в тонком слое сорбента. Разработана методика количественного анализа циннаризина в суппозиториях спектрофотометрическим методом и кислоты янтарной – алкалиметрическим. Проведена стандартизация суппозиториев и установлен срок их хранения – 2 года.
Рецензенты:
Молчанов Г.И., д.фарм.н., профессор кафедры мировой экономики филиала РЭУ им. Г.В. Плеханова в г. Пятигорске, г. Пятигорск;
Кодониди И.П., д.фарм.н., доцент кафедры органической химии Пятигорского медико-фармацевтического института – филиала ГБОУ ВПО ВолгГМУ МЗ РФ, г. Пятигорск.



