За последние 10 лет количество больных с хронической почечной недостаточностью в терминальной стадии (ТХПН) в мире возросло более чем в 2 раза и составило около 2 млн человек, более 70 % из них лечение проводится посредством программного гемодиализа [4]. Для проведения сеансов гемодиализа у пациентов с ТХПН хирургическим путем формируют постоянный сосудистый доступ (ПСД), от качества которого напрямую зависят длительность и качество жизни гемодиализных пациентов. Общепризнано, что лучшим вариантом ПСД является нативная радиоцефалическая артериовенозная фистула (АВФ), которая обеспечивает адекватный кровоток для проведения гемодиализа, функционирует многие годы и имеет минимум осложнений [7]. Тем не менее эта сосудистая конструкция является нефизиологической из-за патологического прямого сброса артериальной крови в венозное русло. Наличие АВФ создает перманентный высокий сердечный выброс и повышает нагрузку на сердце [9]. При радиоцефалической АВФ у большинства пациентов вся кровь из лучевой артерии поступает в фистульную вену и не принимает участия в кровоснабжении тканей кисти [6].
Среди нефрологов и врачей гемодиализных отделений распространено мнение, что синдром «обкрадывания» у гемодиализных пациентов обычно проявляется при избыточном кровотоке по АВФ [3]. Однако детальное исследование кровотока по крупным сосудам предплечья у гемодиализных пациентов показывает, что ишемия тканей кисти достаточно часто выявляется у пациентов с кровотоком по фистульной вене в пределах среднестатистических величин [2]. Практика показывает, что данных допплеровского исследования кровотока по крупным сосудам предплечья недостаточно для формирования представления о механизмах развития критической ишемии в тканях ниже анастомоза. Для понимания причин развития синдрома «обкрадывания» необходима информация о кровотоке в сосудах микроциркуляторного русла (МЦР) тканей кисти руки с АВФ, однако подобных исследований крайне мало [5]. Вопросы о величине кровотока в сосудах МЦР тканей кисти у гемодиализных пациентов с радиоцефалической АВФ, механизмах его регуляции и зависимости от величины кровотока по артериовенозной фистуле остаются открытыми.
Материалы и методы исследования
С 2010 по 2013 г. в диализном центре Fresenius Medical Care (Санкт-Петербург) было проведено обследование в динамике 104 пациента с ТХПН. Всем пациентам для проведения программного гемодиализа была сформирована радиоцефалическая артериовенозная фистула по типу «конец головной вены – бок лучевой артерии» (49 мужчин и 55 женщин, средний возраст – 44,5 года). Обследование проводилось в следующей последовательности: 1-е – за 1–2 дня до операции по формированию АВФ, 2-е – по окончании операции, последующие – через 1 неделю, через 1, 2, 3, 6, 9 и 12 месяцев после формирования АВФ. Диаметр лучевой и локтевой артерий и головной вены, линейную и объемную скорость кровотока по этим сосудам измеряли с помощью стационарного УЗИ-сканера Vivid 3 (General Electric Medical Systems). Кровоток в сосудах МЦР исследовали в коже подушечки второго пальца руки методом лазерной допплеровской флоуметрии (ЛДФ) с помощью диагностического комплекса ЛАКК-М (Lazma) [1]. Публикации последних десятилетий свидетельствуют о том, что данные, полученные с помощью ЛДФ, адекватно отражают состояние кровотока в сосудах МЦР исследуемых тканей, в т.ч. и при ишемии тканей конечностей [8].
Нами было проведено исследование кровотока в коже подушечки второго пальца руки с АВФ. В этом участке кожи высокий уровень перфузии и представлены все виды сосудов МЦР (артериолы, метаартериолы, прекапиллярные сфинктеры, капилляры, венулы и артериоло-венулярные анастомозы). В стенке артериол и артериоло-венулярных анастомозов значительная плотность нервных окончаний и, соответственно, помимо эндотелий-зависимой и миогенной модуляции, выявляемых практически во всех сосудах, в сосудах МЦР кожи подушечки пальца хорошо представлена и нервная регуляция [1]. Диагностику микрокровотока проводили по утрам с 9 до 11 часов при температуре в помещении 22–23 °С. Кончик световодного зонда фиксировали к коже подушечки второго пальца с помощью штатного устройства и лейкопластыря. Для регистрации ЛДФ-грамм и их последующей обработки применяли прилагаемое к аппарату стандартное программное обеспечение версии 3.0.2.376, работающее в операционной системе Windows.
Полученные данные обрабатывали и анализировали с помощью программы «EXCEL 2003». При статистическом анализе материала применяли пакет программ StatSoftSTATISTICA 6.1.478, использовали методы параметрической и непараметрической статистики. Методы включали в себя оценку среднего арифметического (М), стандартное отклонение (±SD). Для оценки различий данных, полученных в разные сроки после формирования АВФ, применяли t-критерий Стьюдента и критерий Манна – Уитни. Для анализа корреляционных взаимосвязей рассчитывали коэффициент ранговой корреляции Спирмена (r). Различия считали статистически значимыми при р≤0,05.
Результаты исследования и их обсуждение
По итогам измерения объемной скорости кровотока в фистульной вене в общей массе пациентов было выделено 4 группы. Основанием для отнесения пациента в ту или иную группу служила величина объемного кровотока по фистульной вене через 3 месяца после формирования АВФ. Наши наблюдения и литературные данные свидетельствуют, что к этому времени в основном завершается ремоделирование стенок лучевой артерии и головной вены, фистула созревает и становится пригодной для проведения сеансов гемодиализа [6,7,13]. Первую группу составили пациенты с кровотоком менее 500 мл/мин (19 пациентов), вторую – с кровотоком 500–749 мл/мин (46 пациентов), третью – 750-999 мл/мин (28 пациентов) и четвертую – более 1000 мл/мин (11 пациентов).
На рис. 1 представлены данные о динамике кровотока в фистульной вене в четырех группах пациентов на протяжении 12 месяцев. Максимальный прирост кровотока у всех пациентов наблюдался на протяжении первой недели после формирования АВФ (от 10 мл/мин за сутки в первой группе до 27 мл/мин за сутки – в четвертой), затем скорость прироста кровотока снижалась (в интервале 1–3 месяца она составляла в разных группах от 4 до 7 мл/мин за сутки). По истечении 3 месяцев скорость прироста кровотока составляла от 0,2 до 0,4 мл/мин за сутки, т.е. кровоток по фистульной вене относительно стабилизировался. Исключение составили пациенты четвертой группы. По истечении трех месяцев средняя объемная скорость кровотока по фистульной вене в этой группе составила 1124±117,3 мл/мин и в интервале 3–6 месяцев после создания АВФ продолжала нарастать со скоростью около 1 мл/мин за сутки.
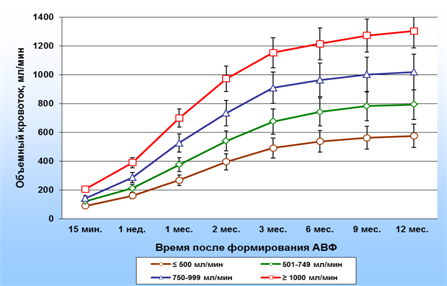
Рис. 1. Динамика кровотока по фистульной вене у пациентов с ТХПН на протяжении 12 месяцев после формирования АВФ. Представлены результаты исследования в четырех группах пациентов с кровотоком ≤500 мл/мин, 501-749 мл/мин, 750-999 мл/мин и ≥1000 мл/мин через 3 месяца после создания АВФ
По завершении обследования кровотока в сосудах предплечья у всех пациентов проводилось исследование микрокровотока в тканях кисти руки с АВФ. Показатель микроциркуляции (ПМ), характеризующий уровень перфузии в ткани, является произведением линейной скорости эритроцитов на их концентрацию и отражает объемный кровоток в 1 мм3 ткани. Результаты исследования кровотока в МЦР кожи подушечки второго пальца руки с АВФ пациентов с ТХПН на протяжении 12 месяцев после формирования АВФ представлены на рис. 2. На дооперационном этапе показатель микроциркуляции, характеризующий уровень перфузии, в коже подушечки второго пальца руки у пациентов с ТХПН составил в среднем 17,9±2,02 пф.ед. Формирование радиоцефалической АВФ приводило к выраженному снижению перфузии кожи пальца, что объясняется прекращением или существенным снижением притока артериальной крови в кисть по лучевой артерии, а также сбросом части крови из локтевой артерии в дистальную часть лучевой артерии и далее, в фистульную вену. Снижение ПМ составляло от 19,6 % до 24,3 % от его величины на дооперационном этапе.
Анализ данных, полученных через 15 минут после завершения операции по формированию АВФ, не выявил существенных различий в микровотоке в тканях кисти в разных группах пациентов. Но уже через неделю разница в перфузии тканей кисти в разных группах становилась заметной и в последующем продолжала возрастать. Уменьшение перфузии происходило в основном на протяжении первых трех месяцев наблюдения. На первой неделе средняя скорость снижения перфузии составила 0,597 пф. ед/сутки, а на двенадцатой – 0,004 пф. ед/сутки. В интервале 9–12 месяцев после формирования АВФ средняя скорость снижения перфузии составила 0,0009 пф. ед/сутки, т.е микрокровоток в тканях кисти стабилизировался. В то же время по абсолютной величине микрокровоток в разных группах пациентов существенно отличался. К концу наблюдения ПМ в первой группе составил 12,92±3,11 пф. ед. (72,4 % от дооперационного уровня), а в четвертой – 10,31±3,02 пф. ед (56,6 % от дооперационного).
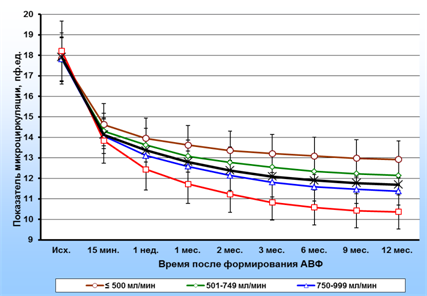
Рис. 2. Показатель микроциркуляции в коже подушечки второго пальца руки в четырех группах пациентов с ТХПН с разной величиной кровотока по фистульной вене на протяжении 12 месяцев после формирования АВФ. Черная кривая – динамика средней величины показателя микроциркуляции
Сопоставление данных о кровотоке по фистульной вене и микрокровотоке в сосудах кожи кисти (рис. 1 и 2) создает впечатление о существовании выраженной зависимости перфузии тканей, расположенных ниже анастомоза от кровотока по фистульной вене: чем больше кровоток по фистульной вене, тем меньше перфузия в тканях, расположенных ниже анастомоза. В ряде случаев это соответствует действительности, но детальный анализ показывает, что эта зависимость не является абсолютной. При одинаковом кровотоке по фистульной вене показатель микроциркуляции в тканях кисти может значительно отличаться. Так, через 6 месяцев после формирования АВФ кровоток по фистульной вене 750-850 мл/мин имели 17 пациентов из второй группы и 11 – из третьей. Средняя величина показателя микроциркуляции в коже подушечки второго пальца руки с АВФ составила у них 12,01±2,93 пф. ед., при этом наблюдались колебания от 9,4 до 14,3 пф. ед., т.е. разница в перфузии тканей кисти достигала 50 %.
Нами был проведен регресионный анализ связи между уровнем перфузии в тканях кисти руки с АВФ и величиной кровотока по фистульной вене с помощью пакета данных в Excel. В анализ были включены данные показателя микроциркуляции в коже второго пальца руки и объемного кровотока по фистульной вене через 3 месяца после формирования АВФ. На первом этапе анализа был построен точечный график зависимости показателя микроциркуляции в коже подушечки второго пальца руки от величины кровотока по фистульной вене с линией тренда (рис. 3). Далее были проведены расчеты, показавшие, что величина R2, называемая также мерой определенности, равна 0,2583. Из этой величины был рассчитан R (коэффициент множественной корреляции, выражающий степень зависимости одной величины от другой). Он оказался равным 0,51. Зависимость показателя микроциркуляции в тканях кисти от величины кровотока по фистульной вене у гемодиализных пациентов с радиоцефалической АВФ оказалась не высокой, а всего лишь умеренной.

Рис. 3. Зависимость величины показателя микроциркуляции в коже подушечки второго пальца руки от величины объемного кровотока по фистульной вене у гемодиализных пациентов с радиоцефалической АВФ (точечная диаграмма с линией тренда)
Таким образом, мы приходим к заключению, что данные ультразвукового исследования кровотока по крупным сосудам предплечья у гемодиализных пациентов с радиоцефалической АВФ (и в частности, объемный кровоток по фистульной вене) могут лишь относительно характеризовать перфузию в тканях кисти руки с АВФ. У значительной части пациентов микрокровоток в тканях кисти не коррелирует с объемных кровотоком по фистульной вене. Полученные нами результаты позволяют рекомендовать наряду с периодическим исследованием кровотока по крупным сосудам предплечья у гемодиализных пациентов проводить также исследование микрокровотока в тканях кисти методом ЛДФ. Данные ЛДФ-метрии позволяют выявить тенденцию к развитию ишемии тканей кисти и своевременно планировать и проводить реконструктивные операции на сосудах предплечья с целью недопущения развития критической ишемии и повреждения тканей кисти.
Рецензенты:
Пантелеев С.С., д.б.н., заведующий лабораторией кортико-висцеральной физиологии Института физиологии им. И.П.Павлова РАН, г. Санкт-Петербург;
Чурина С.К., д.м.н., профессор, заведующая лабораторией экспериментальной и клинической кардиологии Института физиологии им. И.П.Павлова РАН, г. Санкт-Петербург.



