Мелатонин – гормон эпифиза, является эндогенным антиоксидантом, липофильным по природе и играет важную роль во многих физиологических процессах [8]. Он обладает иммуномодулирующими, антиоксидантными и антипролиферативными свойствами [3,4,10]. Было показано, что мелатонин участвует в управлении клеточной пролиферацией и дифференцировкой [2]. Кроме того, пониженный уровень собственного мелатонина наблюдали при некоторых онкологических заболеваниях, что указывает на то, что мелатонин можно рассматривать как эндогенное онкостатическое вещество [4,6]. В целом, эффект мелатонина состоит в подавлении пролиферации клеток и индукции дифференцировки и апоптоза в ряде опухолевых линий клеток в диапазоне концентраций, от нано- до мили - молярных. [3,4,6,9].
В то же время, отмечаются разночтения в действующих концентрациях мелатонина. В работе на трансформированных клетках молочной железы (линии MCF-7), показано, что мелатонин в физиологических концентрациях (10-11 - 10-9М) на 75% подавляет пролиферацию клеток, но его эффект снимается при более высоких (10-7 - 10-5М) или более низких концентрациях (10-15 - 10-13М) [5]. На культуре клеток человеческой нейробластомы SK-N-MC выявлено, что мелатонин в высоких дозах (10-4 - 10-3М) ингибирует клеточную пролиферацию и стимулирует индукцию клеточной дифференцировки и клеточной гибели [4]. В работах других авторов на клетках человеческой нейробластомы SK-N-SH эффект мелатонина был отмечен в концентрациях от 10-11 до 10-9М. При этом, в этих экспериментах более низкие (10-13М) или более высокие концентрации (10-8 - 10-5М) мелатонина практически не влияли на клеточный цикл человеческой нейробластомы SK-N-SH [2]. В целом, можно отметить, что эффекты действия мелатонина на культуре клеток наблюдали в весьма широком диапазоне концентраций, что оставляет открытым вопрос определения оптимума его действия.
Задачей нашей работы было изучение динамики соотношения популяций клеток растущей культуры нейробластомы мыши N1E-115 под действием мелатонина в диапазоне концентраций 10-6 - 10-5М.
Материалы и методы исследования
Исследования проводили на культуре клеток нейробластомы мыши N1Е115 (клон С-1300). Клетки нейробластомы культивировали в среде DМЕМ (Sigma, США) с добавлением 10% эмбриональной сыворотки (fetal bovine serum, Flow Laboratories, Великобритания) при 37°С. В экспериментах в качестве контроля использовали среду DМЕМ без сыворотки и экспериментальную среду DМЕМ без сыворотки с добавлением мелатонина в разных концентрациях. Исследуемые препараты добавляли в культуру в логарифмической фазе роста через 24 часа после посева во флаконы. В контрольной и экспериментальной группе было не менее трех флаконов. Плотность посева в 50 мл пластиковых флаконах составляла 5х103 клеток /см 2 при объеме среды 5 мл. Методом прижизненного наблюдения c использованием микроскопа МБИ-13 (объектив ROW Rathenon 24/0.42, окуляр 7.) проводили морфологическое исследование клеток.
Определяли общее количество клеток, а также количество пролиферирующих, дифференцированных и гибнущих (отмирающих) клеток. Подсчитывали количество каждой группы клеток в 3-5 полях зрения микроскопа в каждом из трех флаконов. Критерием нейродифференцировки было появление клеток 2-х типов: клетки обычных размеров (20-30 мкм) с длинными аксоноподобными отростками (вдвое больше диаметра клетки нейробластомы) или увеличенные по размерам клетки (до 50—70 мкм) с многочисленными отростками. Гибнущие клетки определяются как клетки округлой формы или деформированные с фрагментированной структурой ядра и цитоплазмы, как правило, неадгезированные к поверхности флакона. Пролиферирующие клетки имели округлую или овальную форму, как правило, с короткими (не больше диаметра клетки) отростками или вообще без отростков [1]. Для статистического анализа брали среднее значение числа различных клеток, вычисленное по результатам трех экспериментов (по 9 флаконов для контрольной и экспериментальной группы). Статистическую достоверность считали с использованием t-критерия Стьюдента, для уровня достоверности - P < 0.05.
Результаты и их обсуждение
В работе было исследовано влияние мелатонина на пролиферацию и индукцию дифференцировки клеток нейробластомы мыши N1E-115 (клон С-1300). При культивировании клетки распределялись на три популяции – пролиферирующие, дифференцированные и гибнущие. На рис 1 представлены морфологические изменения клеток нейробластомы в процессе культивирования. В контроле со 2-х по 4-е сутки шло постепенное нарастание числа пролиферирующих клеток (см. рис.2), что характерно для перевиваемых культур [1]. На фоне мелатонина количество пролиферирующих клеток нейробластомы не увеличивалось, что указывает на торможение пролиферации под влиянием мелатонина. Общее число клеток в поле зрения микроскопа в контрольных флаконах на 3-и сутки составило 93±4,7, а в экспериментальных группах с мелатонином (10-5М) соответственно 72 ±5,5.
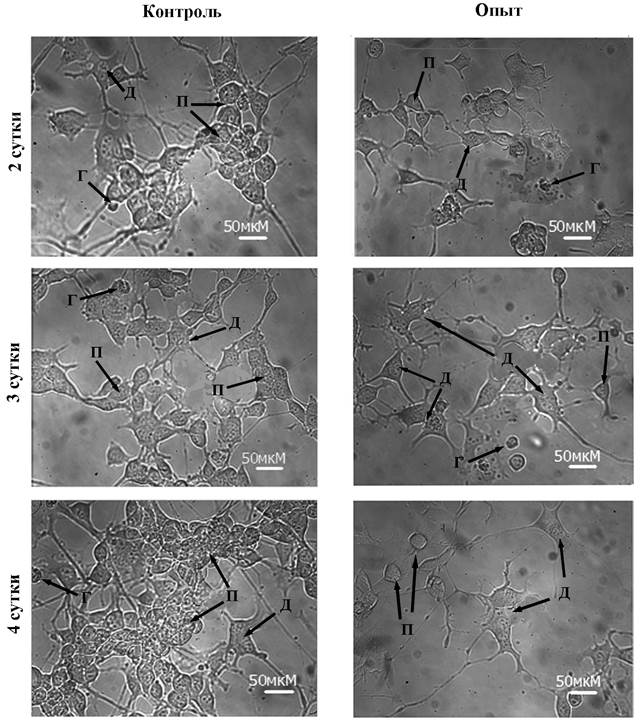
Рис. 1. Морфологический статус культуры нейробластомы мыши на фоне мелатонина (10-5М) на 2 – 4 сутки культивирования. Буквами обозначены: П – пролиферирующие, Д – дифференцированные, Г – гибнущие клетки.
Анализ сгруппированных отдельно по популяциям дифференцированных, пролиферирующих и гибнущих клеток нейробластомы мыши под действием мелатонина в диапазоне концентраций 10-6 - 10-5М представлен на рис. 2. Показано, что количество как пролиферирующих, так и гибнущих клеток росло по мере культивирования до 4 суток. В работах других исследователей также отмечалась гибель трансформированных клеток под действием мелатонина [4, 5, 6, 9].
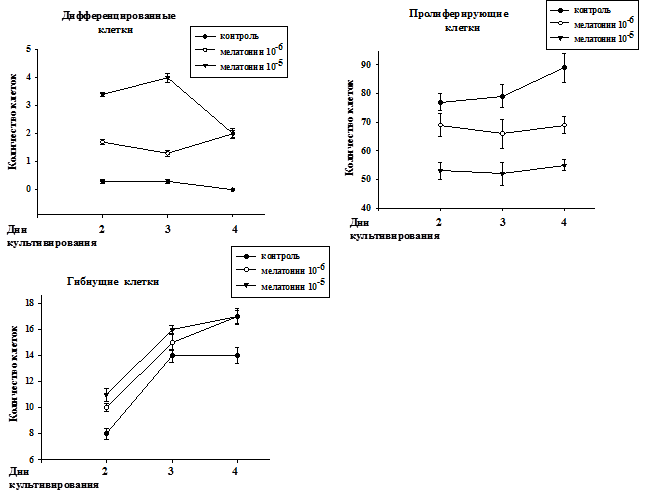
Рис. 2. Распределение клеток отдельно по популяциям (дифференцированные, пролиферирующие и гибнущие) при культивировании в контроле и под действием мелатонина в концентрациях 10-6 - 10-5М.
Количество дифференцированных клеток в контроле медленно падало по мере культивирования. Из литературы известно, что количество дифференцированных клеток в пролиферирующей культуре не увеличивается [1]. Мелатонин в концентрации 10-5М увеличивал количество дифференцированных клеток на 3-и сутки культивирования, а затем количество дифференцированных клеток уменьшалось к 4 дню культивирования. При этом под действием мелатонина в концентрации 10-6 М наблюдалось более медленное нарастание дифференцировки к 4-м суткам культивирования. Что касается контроля, то количество дифференцированных клеток не увеличивалось, а уменьшалось к 4-м суткам культивирования. Уменьшение количества дифференцированных клеток на 4 сутки при культивировании с мелатонином 10-5 М, по-видимому, связано с тем, что происходит гибель дифференцированных клеток по типу апоптоза. Используемые нами концентрации существенно выше концентраций, активных для клеток молочной железы [5] и клеток человеческой нейробластомы SK-N-SH [2], но ниже, чем для клеток другой человеческой нейробластомы SK-N-MC [4]. Мелатонин в исследованных концентрациях блокировал рост количества пролиферирующих клеток. Этот феномен торможения пролиферации, но при других концентрациях, описывался в цитированных выше работах [2, 4, 5].
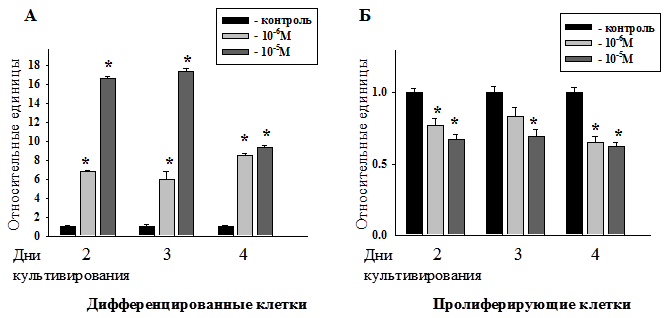
Рис. 3. Сравнение количества дифференцированных (А) и пролиферирующих (Б) клеток в относительных единицах при культивировании в контрольной среде и средах, содержащих мелатонин в концентрациях 10-6 - 10-5М.
На рис.3 приведены количества дифференцированных и пролиферирующих клеток при культивировании в контрольной среде и средах, содержащих мелатонин в концентрациях 10-6 - 10-5М, в относительных единицах. Как видно из графиков (рис.2) и диаграмм (рис.3), наибольшие изменения происходят в культуре, выращенной в среде с мелатонином в концентрации 10-5М на 3-и сутки культивирования (в частности, в культуре значительно снижается, по сравнению с контролем, количество пролиферирующих клеток и активно образуются дифференцированные клетки). Эти изменения пролиферации в культуре клеток под действием мелатонина говорят о противоопухолевых свойствах данного препарата [4, 5, 6, 7, 9], которые проявляются в конкретные временные интервалы и в определённых фармакологических концентрациях.
В целом, мелатонин в концентрациях 10-6 - 10-5М подавляет пролиферацию клеток нейробластомы мыши N1Е-115 (клон С-1300) на 27±3,7%, а дифференцировка достигает максимума при действии мелатонина в концентрации 10-5М на 3 сутки культивирования.
Заключение
Таким образом, мелатонин в диапазоне концентраций 10-6 - 10-5М вызывает изменения развития культуры нейробластомы мыши, которые проявляются в торможении пролиферации и индукции дифференцировки клеток. Действие мелатонина проявляется в изменении морфологии клеточной культуры, в изменении общего количества клеток и их распределения на пролиферирующие, дифференцированные и гибнущие. Нами впервые показано, что количество дифференцированных клеток при использовании мелатонина в концентрации 10-5М достигало максимума на 3-и сутки культивирования. Количество гибнущих клеток увеличивалось по мере культивирования в экспериментальных образцах к 4-м суткам, достоверно отличаясь от контроля.
Наши результаты подтверждают антипролиферативные и онкостатические свойства мелатонина и могут служить экспериментальным обоснованием для дальнейшего изучения онкопротекторного потенциала мелатонина и для разработки рекомендаций по применению мелатонина с целью профилактики злокачественных образований.
Работа выполнена при поддержке РФФИ, грант № 14-04-00625
Рецензенты:
Вихлянцев И.М., д.б.н., в.н.с. Федерального государственного бюджетного учреждения Института теоретической и экспериментальной биофизики Российской академии наук, г. Пущино;
Тирас Н.Р., д.б.н., в.н.с. Федерального государственного бюджетного учреждения Института теоретической и экспериментальной биофизики Российской академии наук, г. Пущино.



