Аутоиммунные свойства крови являются одним из важнейших для практической медицины разделов нормальной физиологии. Своевременная трансфузия компонентов крови ежедневно спасает жизни многих людей. К сожалению, не всегда удается избежать грозных осложнений, вызванных переливанием крови. Тем более важным в образовании врачей представляется глубокое проникновение в суть аутоиммунных процессов. Наибольшее число проблем, связанных с переливанием крови, обусловлено высоким полиморфизмом самой иммуногенной из 30 систем групп крови –системы группы крови резус. Представление об иммуногенетической характеристике резус-антигенов необходимо для понимания механизмов несовместимости переливаемой крови и позволит снизить число трансфузионных осложнений.
1. Номенклатура антигенов системы RH
Система группы крови RH (резус) была открыта в 1940 г. Карлом Ландштейнером и Александром Винером [21]. Система RH представлена несколькими десятками антигенов, многие из которых возникли вследствие генных мутаций. В наши дни в научной литературе в основном применяются две номенклатуры антигенов системы резус: Фишера-Рeйса (Fisher-Race) и Винера (Weiner). По Фишеру-Рeйсу [31] наиболее клинически значимые антигены системы Rh обозначаются литерами D, С, Е, си е, по Винеру– Rh0,rh΄,rh΄΄,hr΄и hr΄΄ соответственно [37]. По убыванию иммуногенности резус-антигены располагаются в следующей последовательности:D, c, E, C и e. Антиген D встречается у 85% европейцев, С – у 70%, с– у 85%, Е– у 30%ие– у 97%.
2. Гены. Структура антигенов
Клинически значимые резус-антигены кодируются двумя тесно связанными генами – RHD и RHСЕ. Эти гены располагаются в локусе RH 1-й хромосомы. Ген RHСЕ имеет аллели RHce, RHCe и RHcE [7]. Ген RHD парного аллеля не имеет. Отсутствие рецессивного аллеля гена RHD, связанное чаще всего с делециейэтого гена [32], принято обозначать прописной литерой d. Аллели локуса RH всегда наследуются вместе в различных комбинациях: DCE, DCe, DcE, Dce, dCE, dCe, dcE и dce [16]. Лица, у которых ген RHDприсутствуетна обеих гомологичных хромосомах или на одной из них, являются D-положительными.Люди, у которых ген RHD отсутствуетна обеих гомологичных хромосомах, считаются D-отрицательными. Среди европейцев D-отрицательных людей 15-17%, в Южной Африке – 5%, в Японии, Китае, Монголии и Корее – 3% [13; 33]. Напротив, у басков лишь 34%D-положительных лиц. Отметим, что у европецев основной причиной D-отрицательности является делеция гена RHD, в то время как у африканцев и азиатов часто выявляется неактивный (молчащий) ген RHD [25] или гибридный ген RHD-СЕ-D [16], не экспрессирующий антиген D [11]. 20%D-отрицательных японцев имеют резус-фенотип DEL, характеризующийся очень низким уровнем экспрессии антигена D.
Прорыв в понимании молекулярных основ системы резус произошел в 90-х годах прошлого века, когда были клонированы гены локуса RH – ген RHD и ген RHСЕ [22]. Выяснилось, что эти гены кодируют две белковые молекулы, встраивающиеся в мембрану эритроцитов, –белокRhD и белокRhCE[4]. Частью аминокислотной структуры одного из этих белков – белка RhD– является антиген D. Белок RhCE, в отличие от белка RhD, формирует два резус-антигена –антиген С(или с) и антиген Е (или е), наследуемых в блоке в разных комбинациях: СЕ, Се, сЕ или се. Наличие двух различных антигенных детерминант в одной молекуле белка подтверждается выработкой двух типов антител в ходе иммунного ответа, инициированного белком RhCE, – анти-С (или анти-с) и анти-Е (или анти-е) [5].
Белки RhD и RhCE на 92% идентичны по структуре (аминокислотному составу и конформации) в связи с высокой гомологичностью кодирующих их генов RHD и RHСЕ, обусловленной, вероятно, генной дупликацией [30]. Оба белка состоят из 416 аминокислот и отличаются лишь 35 аминокислотами. В мембране одного эритроцита содержится от 10 до 30 тысяч молекул ключевых резус-антигенов. Резус-протеины RhD и RhCE– это молекулы, 12 раз пересекающие мембрану эритроцитов в направлении от внутренней поверхности к наружной и затем вновь ко внутренней с С- и N-концами, ориентированными к цитоплазме [9] (рис. 1).
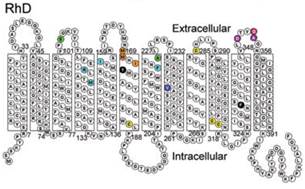
Рис. 1. Структурная организация протеина RhD
(из ConroyM. etal., BritishJournalofHaematology. 2005)
Некоторые участки этих белковых молекул, выступающие шестью петлями над наружной поверхностью мембраны эритроцитов, обладают свойствами эпитопов – детерминантных областей антигена [12]. Применение моноклональных антител, способных взаимодействовать с эпитопами лишь одного типа, позволило выявить в молекуле протеина RhDэпитопы 36 различных типов. Есть основания полагать, что в мембране эритроцитовD-положительных людей два ключевых резус-протеина RhD и RhCE образуют резус-комплекс с двумя молекулами резус-ассоциированного гликопротеина – RhAG. У D-отрицательных лиц резус-комплекс, возможно, содержит две RhCE субъединицы (обычно се) и две RhAG субъединицы [39].
Гликопротеин RhAG на 40% идентичен белкам RhD и RhCE, что указывает на его принадлежность к семейству резус-протеинов, и он, также как белки RhD и RhCE, 12 раз пересекает мембрану эритроцитов. Семейство резус-протеинов составляют ключевые резус-белки эритроцитов – носители антигенов D, С (или с), Е (или е) – и резус-ассоциированный гликопротеин RhAG [27]. С резус-семейством ассоциированы десятки дополнительных (accessory) гликопротеинов [17]. Очевидно, что столь значительное разнообразие антигенных белков системы резус, связанное с выпадением отдельных нуклеотидов, точечными нуклеотидными заменами в цепи ДНК, транслокацией, изменением экспрессии антигенов и пр., делает эту систему самой полиморфной из всех известных на сегодняшний день систем групп крови. Генетические исследования последних лет выявили случаи обменов между генами RHD и RHСЕ. Мутантные гены кодировали гибридные резус-протеины, у которых имелись RhD-специфические области в молекуле Rhсе-протеина и наоборот [8]. Эритроциты, содержащие гибридные резус-протеины Rhсе, могли взаимодействовать с некоторыми моноклональными антителами анти-D.
Показано, что для экспрессии белков RhD и RhCE в мембрану эритроцитов необходим гликопротеин RhAG [29]. В отсутствие протеина RhAG нарушается процесс сборки и переноса из цитоплазмы в мембрану эритроцитов ключевых белков резус-комплекса – белков RhD и RhCE. Это подтверждается одним из фенотипов системы RH – фенотипом резус-ноль (Rhnull). Rhnull может быть следствием мутации одного из генов большого комплекса резус-генов – гена RHAG, блокирующей образование резус-ассоциированного гликопротеина RhAG. Оказалось, что в мембране эритроцитов лиц фенотипа Rhnull отсутствуют не только молекулы протеинаRhAG, но и резус-протеиныRhD и RhСЕ [20]. При этом лица Rhnull могут передавать по наследству антигены семейства Резус своим детям (по аналогии с Бомбейским фенотипом). Имеются сведения о наличии у лиц фенотипа Rhnull естественных антител ко всем ключевым антигенам системы резус.
Важно отметить, что у носителей фенотипа Rhnull были выявлены морфологические и физиологические изменения эритроцитов [18]. В красных клетках крови повышалось осмотическое давление, они приобретали форму сфероцитов, уменьшалась продолжительность их жизни, наступал гемолиз [38]. Эти наблюдения, а также множество специальных исследований убеждают в том, что семейство резус-белков является существенной составляющей цитоскелета эритроцитов и участвует в транспорте воды и аммониячерез его мембрану [6; 19; 24].
Ключевые антигены системы RH начинают синтезироваться примерно с 6-й недели внутриутробного развития плода. Экспрессия белков с резус-антигенами в мембрану пронормобластов отмечается уже на 38-42-й день эмбриогенеза. Неэритроидные гомологи резус-белков обнаружены в печени, почках, головном мозге и коже. Эти белки осуществляют трансмембранный перенос аммония в клетках, составляющих эти органы [26].
3. Некоторые варианты антигена D, образовавшиеся в результате мутаций гена RHD
А. Dweak- слабый антиген D
У лиц фенотипа Dweak (от англ. weak – слабый), а они составляют 1,5% среди резус-положительных, вследствие точечной мутации гена RHD снижена экспрессия антигена D на мембране эритроцитов [40]. В связи с этим антиген Dweak не может быть идентифицирован рутинным методом – прямой агглютинацией с использованием сывороток анти-D. Во избежание ошибочного отнесения лиц фенотипа Dweak к числу D-отрицательных, кровь всех D-отрицательных доноров должна быть исследована специальными методами на наличие антигена Dweak[35].
Доноры с антигеном Dweak определяются как резус-положительные(D-положительные), т.к. их эритроциты могут стимулировать образование антител анти-D у D-отрицательных реципиентов. При переливании эритроцитов фенотипа DweakD-положительным реципиентам антитела анти-D не продуцируются. Синтез анти-D в противоположной ситуации – у реципиентов Dweakпри переливании им D-положительных эритроцитов – ранее считался маловероятным. Однако в последние годы появляются сведения о случаях иммунизации Dweakреципиентов D-положительными эритроцитами [14]. В связи с этим реципиентов с антигеном Dweak в трансфузионных процедурах рекомендуют вести как резус-отрицательных (D-отрицательных).
При определении резус-принадлежности лаборатории выдают лицам фенотипа Dweak комментарий: «Выявлен слабый резус-антиген (Dweak), рекомендуется при необходимости переливать резус-отрицательную кровь». Впрочем, вопрос об иммунных свойствах фенотипа Dweak продолжает активно обсуждаться в научных кругах [15].
Б. Dpartial– частичный антиген D
Частичный(парциальный, вариантный) антиген D–Dpartial– отличается от антигена Dотсутствиемодного или нескольких из известных 36-ти эпитопов[3]. При этом количество RhD-протеинов в мембране эритроцитов остается таким же, как у лиц с нормальным антигеном D. У реципиентов Dpartialвозможно образование антител против недостающих эпитопов антигена D при переливании им D-положительной крови или во время беременности [36]. В связи с этим реципиенты фенотипа Dpartialсчитаются D-отрицательными, а доноры – D-положительными. Некоторые Dpartialявляются результатом точечных мутаций в гене RHD, другие возникают вследствие гибридизации генов RHD и RHСЕ.
В. Фенотип DEL
Фенотип DEL широко распространен у азиатских этносов. В Китае и Японии он составляет до 17% от числа резус-отрицательных лиц, выявленных серологически. У европейцев встечается очень редко. Характеризуется исключительно низкой экспрессией антигена D. Несмотря на это обстоятельство, эритроциты фенотипа DEL могут вызывать иммунную реакцию у D-отрицательных реципиентов [41]. До сих пор нет серологических реагентов, которые определяли бы этот фенотип. Идентификация доноров DEL производится лишь генетическим скринингом [34]. Поскольку DEL принадлежит к числу слабых D-фенотипов, на представителей этого фенотипа распространяются те же рекомендации по поводу гемотрансфузии, что и на лиц Dweak: доноры считаются резус-положительными (D-положительными), а реципиенты – резус-отрицательными (D-отрицательными).
4. Антирезус антитела
Антитела антирезус являются иммунными антителами [23]. В отличие от естественных антител системы АВ0, антитела к антигенам системы резус вырабатываются в процессе иммунных реакций (изосенсибилизации).
Антитела к антигенам системы резус, образующиеся при первичном иммунном ответе, в основном принадлежат к иммуноглобулинам М, серологически определяются через несколько недель после встречи с антигеном (чаще всего), достигают максимальной концентрации через 1-2 месяца. Антитела, синтезированные при вторичном иммунном ответе, в значительной степени принадлежат к иммуноглобулинам G, появляются в крови через несколько дней после внедрения антигена и сразу в высокой концентрации.
IgM и IgG, связавшись с соответствующими антигенами эритроцитов, активируют комплемент по классическому пути и фагоцитирующие клетки крови.
5. Определение резус-совместимости при переливании крови
Резус-антигены могут быть выявлены рядом методов:
- реакцией агглютинации с моноклональными антителами анти-D, анти-С, анти-с, анти-E, анти-е;
- реакцией агглютинации с универсальным реагентом антирезусD;
- другими высокоэффективными и надежными методиками [1].
Длядоноров в наши дни чаще всего применяется следующий алгоритм определения резус-принадлежности. Универсальным реагентом антирезусD, содержащим антитела анти-D, в эритроцитах донора выявляется антиген D: агглютинация эритроцитов антителами анти-D указывает на наличие антигена D на поверхности эритроцитов, отсутствие агглютинации – на отсутствие антигена D. Если антиген D не обнаружен, эритроциты донора обследуются моноклональными антителами анти-С и анти-E на наличие антигенов C и E [1].
Доноры, в эритроцитах которых обнаружен хотя бы один из ключевых резус-антигенов, обозначаемых заглавными буквами (D, и/или C, и/или E), cчитаются резус-положительными. Лица, у которых отсутствуют антигены D, C и E (фенотип dce), являются резус-отрицательными донорами. У реципиентов определяется антиген D универсальным реагентом антирезусD.
В том случае, если все ключевые резус-антигены выявляются моноклональными антителами, важно иметь в виду, что МАО синтезируются invitro одним штаммом плазматических клеток [2]. Эти антитела комплементарны лишь к одному типу эпитопа антигена. Если, к примеру, в исследуемых D-положительных эритроцитах данная детерминанта отсутствует (как у Dpartial), кровь будет считаться D-отрицательной со всеми вытекающими отсюда последствиями. Во избежание подобных ошибок эритроциты, идентифицированные МКА как D-отрицательные, должны дополнительно типироватьсяполиклональными анти-D антителами, содержащимися в универсальном реагенте антирезусD. Это связано с тем, что один антиген может содержать несколько разных или/и одинаковых эпитопов, при этом всеэпитопы одного антигена способны связываться с антителами, синтезированными в организме (invivo) всеми штаммами плазмоцитов в ответ на внедрение данного антигена–поликлональными антителами.
Универсальный реагент антирезусD является сывороткой крови D-отрицательных лиц группы крови АВ (IV), сенсибилизированных к антигену D предыдущими беременностями и/или трансфузиями крови, а также искусственно иммунизированных доноров-добровольцев. В этой сыворотке содержатся антитела анти-D. Универсальной сыворотку делает отсутствие в ней естественных антител анти-А и анти-В, которые могут агглютинацией по системе АВ0 замаскировать специфическое взаимодействие антител анти-Dс антигеном D.
В особых случаях (пока еще) для определения резус-совместимости пар «донор – реципиент» на cтанциях переливания крови производится фенотипирование крови по резус-антигенам. Фенотипирование– это серологическое типирование эритроцитов по всем главным антигенам системы резус –D, C, c, Eи e. При необходимости также определяются некоторые слабые резус-антигены и парциальные антигены D. В трансфузиологическом сообществе России обсуждается вопрос о необходимости введения в нашей стране обязательного фенотипирования доноров по 9 трансфузионно значимым антигенам – А, В, D, с, Е, С, е, Кеllи Cw, – шесть из которых представляют самую иммуногенную из 30-ти систем групп крови – систему резус [10]. Только индивидуальный подбор пар «донор-реципиент», основанный на совместимости их резус-фенотипов, может обеспечить безопасность переливания крови.
6. Природа резус-несовместимости при гемотрансфузии
Резус-несовместимость может быть вызвана двумя причинами – иммунизацией реципиента отсутствующим в его эритроцитах резус-антигеном (антигенами) донора или введением эритроцитов аллоиммунизированному реципиенту [28]. Рассмотрим на нескольких примерах механизм иммунизации реципиентов в процессе трансфузии резус-несовместимых эритроцитов.
1. Предположим, по причине недостаточной оснащенности серологической лаборатории у донора не выявленсодержащийся в его эритроцитахслабый антиген D–Dweak. Констатация отсутствия антигена D позволяет ответственному лицу станции переливания крови сделать заключение о D-отрицательности исследуемой крови (в процессе фенотипирования в эритроцитах донора идентифицированы также антигены с и е).Таким образом, фенотип донора ошибочноопределен как dce. Эритроциты фенотипированного донора используются для трансфузии резус-отрицательному (D-отрицательному) реципиенту с «аналогичным» фенотипом. D-положительные эритроциты донора (Dweak), поступая в кровоток D-отрицательного реципиента, распознаются В-лимфоцитами как чужеродные. Активированные В-лимфоциты трансформируются в плазматические клетки, которые начинают синтезировать и секретировать в кровь антитела, комплементарные антигену Dweak эритроцитов донора – анти-Dweak. В крови реципиента анти-Dweakсвязываютсяс антигенами Dweakмембраны эритроцитов донора. Образование комплекса«антиген-антитело» на поверхности эритроцитов резус-несовместимого донора активирует комплемент по классическому пути, в результате чего мембраноатакующий комплекс разрушает мембрану эритроцитов донора.
2. Другой случай. Допустим, производится трансфузия D-положительных эритроцитов донора D-положительному реципиенту с не идентифицированным фенотипом Dpartial. В состав антигена D донора входят все детерминантные группы антигена –множество различных эпитопов, Dpartial реципиента лишен некоторых из них. Детерминанты D-антигена донора, отсутствующие в структуре Dpartial реципиента, запускают иммунную реакцию, направленную на разрушение и элиминацию эритроцитов донора.
Заметим, что далеко не каждая резус-несовместимая, по идее, ситуация разрешается образованием антирезус антител. Около 30%D-отрицательных людей не подвергаются аллоиммунизации даже при переливании им больших объемов D-положительной крови. Это связано с индивидуальными особенностями иммунных реакций, возможностью возникновения толерантности к определенным антигенам.
Рецензенты:
Лебедева А.Ю., д.м.н., профессор кафедры госпитальной терапии №1 ГБОУ ВПО «Российский национальный исследовательский университет им. Н.И. Пирогова» МЗ РФ, г.Москва;
Автандилов А.Г., д.м.н., профессор, заведующий кафедрой терапии и подростковой медицины Российской медицинской академии последипломного образования (ГБОУ ДПО «РМАПО»), г. Москва.
[1]Реакцией конглютинации с 10%-ным желатином, непрямым антиглобулиновым тестом, гелевым тестом.



