Геморрагическая лихорадка с почечным синдромом, вызываемая хантавирусами, занимает в Российской Федерации ведущее место среди зоонозных вирусных инфекций и одно из первых мест среди всех природно-очаговых болезней человека [3]. В связи с отсутствием лабораторной модели экспериментальных животных, чувствительных к размножению большинства хантавирусов, для выделения и культивирования этих вирусов активно используются клеточные культуры. Вместе с тем, хантавирусы, относящиеся к семейству Bunyaviridae, имеют характерные для большинства представителей этого семейства закономерности, связанные с трудностями их адаптирования к размножению в культурах клеток [2], прочной внутриклеточной ассоциацией и низким выходом вируса в культуральную жидкость. В обычных условиях культивирования хантавирусы не оказывают видимого цитопатического действия (ЦПД) на культуру клеток, в то время как в условиях искусственного закисления среды наблюдалось ЦПД в виде синцития [7].
Целью настоящего исследования явилось исследование морфологических характеристик вируса Пуумала, а также внутриклеточных структур клеток Vero E6, в процессе репликации в них вируса.
Материалы и методы
Исследования выполнены на модели хантавируса Пуумала, штамм K-27/Уфа-85. Вирус размножали в монослое клеток почки зеленой мартышки VeroE6 ( ATCC No. CRL-1586). Для роста клеток использовалась среда Игла MEM с добавлением 5% телячьей сыворотки и 200 мкг/мл канамицина. Титр вируса определяли методом индикации инфекционных фокусов в культуре Vero E6 [1].
Для морфологического исследования монослой клеток (зараженных, а также не зараженных) покрывали слоем фиксатора (глютеральдегид 2,5 % и параформальдегид 2,0% на буфере Хенкса) толщиной 1,5-2 мм и выдерживали в течение 30 минут. После ополаскивания буфером 3 раза по 5 минут стерильным шпателем клетки переносили в центрифужные пробирки и ресуспензировали в 1% растворе четырёхокиси осмия (OsO4) на буфере Хенкса для фиксации в течение часа. Клетки отмывали от фиксатора в трёх сменах буфера в течение 10 минут и обезвоживали в ацетоне восходящей концентрации (50%, 70%, 100%). Осадок клеток, полученный путём центрифугирования при 4000 об/мин в течение 10 минут, пропитывали в смеси эпоксидных смол эпон-аралдит с окисью пропилена, заключали в чистую смолу и полимеризовали при 55оС в течение 48 часов. С полученных блоков на ультрамикротоме изготавливали полутонкие срезы для светооптического изучения и ультратонкие срезы для исследования в электронном микроскопе JEM-100C. Полутонкие срезы окрашивали толуидиновым синим, а ультратонкие 1% раствором уранилацетата и цитратом свинца.
Результаты
Изучению патологических изменений культуры клеток при её заражении хантавирусом предшествовали исследования незаражённой культуры. При светооптическом исследовании полутонких срезов был выявлен клеточный полиморфизм, отражающий процессы созревания, инволюции и разрушения клеток (Рис. 1а).
Исследование зараженной культуры клеток в световом микроскопе на ранних сроках (3 суток) после инфекции, показало, что и в этом случае наблюдаются естественные процессы клеточной инволюции, практически не отличимые от таковых в незараженной культуре (Рис. 1б). При электронно-микроскопическом исследовании незараженных культур был обнаружен широкий спектр клеток, находящихся на разных стадиях жизненного цикла. Встречаются молодые небольшого размера клетки без признаков каких-либо нарушений и клетки на различных этапах деградации (деградация внутриклеточных структур, появление множественных вторичных лизосом (цитосегресом), набухание и изменение цитоплазмы, внутриклеточная гидратация в виде многочисленных вакуолей) (Рис. 2). Наряду с этим можно наблюдать клетки с полным разрушением цитоплазмы и клеточной оболочки.
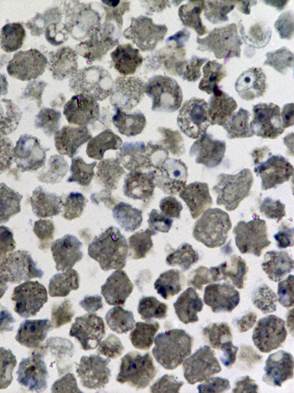
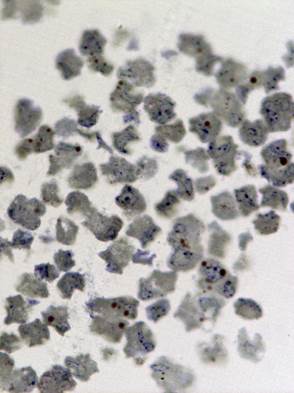
Рис. 1. Светооптическое исследование полутонких срезов культуры VeroE6.
а) нативная культура б) культура, зараженная вирусом Пуумала. Увеличение 20х60
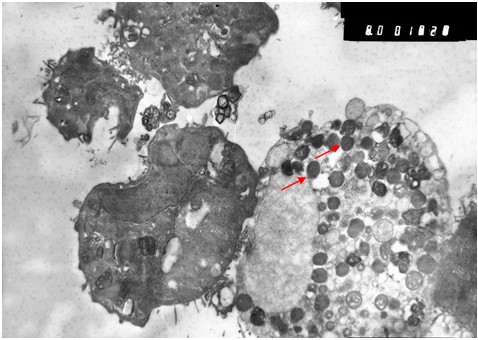
Рис. 2. Незараженная культура. Слева - молодая клетка, сверху стареющая клетка в процессе деградации, в цитоплазме которой множественные вторичные лизосомы (стрелка) и вакуоли. Увеличение х 6 тыс.
Таким образом, в незаражённой культуре клеток Vero E6 наблюдаются естественно протекающие процессы инволюции, которые при изучении заражённой культуры можно было бы принять за патологические изменения, вызванные хантавирусом.
При электронно-микроскопическом исследовании зараженной культуры, была получена картина, аналогичная картине при микроскопии незараженной культуры. Было отмечено, что на ранних сроках заражения встречаются молодые клетки, клетки в состоянии частичного распада и полной деградации у которых отмечается вакуолизация цитоплазмы, распад внутренней мембраны митохондрий, резкое просветление цитоплазматического матрикса и отсутствие рибосомального аппарата (Рис. 3).
При более длительном культивировании (7 суток) состояние заражённых клеток мало отличалось от 3-х суточной культуры. Вместе с тем, в этот период появлялись клетки с гораздо большим содержанием вирионов в цитоплазме (Рис. 4). Для сравнения следует указать, что титр вируса на 3 сутки составлял 3,6±0,4 lgФОЕ/мл, а на 7 сутки достигал максимальных показателей: 5,7±0,4 lgФОЕ/мл. В эти сроки наряду с вирионами в цитоплазме молодых и высокодифференцированных клеток обнаруживались вторичные лизосомы, состоящие преимущественно из миелиноподобных ламелл небольшого размера (150-200 нМ).
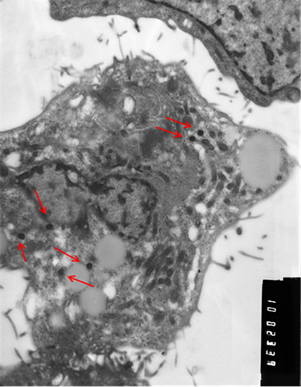
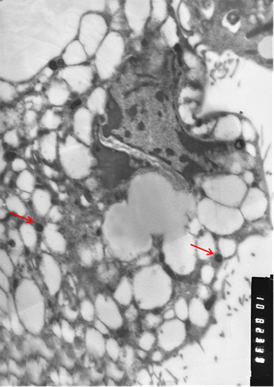
Рис. 3. Клетки, зараженные вирусом Пуумала. а) молодая клетка; б) разрушающаяся клетка. Вирионы хантавируса обозначены стрелкой. Увеличение х 10 тыс.
Визуально вирионы имели не только округлую, но и эллипсовидную форму размером около 90 нм в поперечнике и до 300 нм в длину. По абсолютно нормальной (без признаков патологии) картине клетки, представленной на иллюстрации, и большому количеству вирионов можно предположить, что в её цитоплазме вирус активно размножается. Следует отметить, что и при длительной инкубации заражённой культуры клеток инволютивные процессы протекают в культуре независимо от количества вирионов в цитоплазме и, скорее всего, не связаны с процессами вирусной репликации.
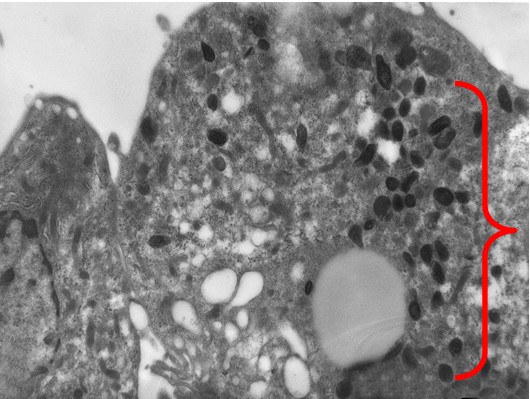
Рис. 4. Культура клеток Vero E6 на 7-е сутки после заражения. Большое количество вирионов хантавируса в цитоплазме (скобка). Увеличение х 10 тыс.
Обсуждение
Морфология хантавирусов впервые была описана для вируса Хантаан в 1982 году при негативном контрастировании вирусных частиц из вируссодержащей жидкости и лизата зараженных клеток, очищенных и сконцентрированных в градиенте плотности сахарозы [8, 10]. Применение этой методики позволило авторам представить описание вирионов, включая наличие шипиков на внешней оболочке и размеры вирионов от 90 до 120 нм, ставшие таксономическими характеристиками нового рода, получившего одноименное название. В последующих работах с применением электронной микроскопии основное внимание было уделено исследованиям, направленным на изучение морфологии вновь выделенных хантавирусов Нового света, включая механизмы созревания вирионов на клеточных мембранах [5, 9]. Позднее методом крио-электронной микроскопии вируса Хантаан было подтверждено, что вирионы имеют сферическую форму, однако средний диаметр их был определен в диапазоне от 120 до 154 нм (в среднем 130 нм) [4].
Результаты наших исследований выявили определенные отличия морфологии хантавируса Пуумала, вызывающего около 98 % случаев ГЛПС в России, от аналогичных характеристик, других патогенных хантавирусов, включая вирус Хантаан. Так, особенностью вирионов, наблюдаемых на ультратонких срезах зараженной культуры, является гетерогенность их формы (округлые и эллипсовидные) и размера (от 90 до 300 нм). Вариации в размере вирусных частиц могут объясняться особенностями методического подхода – диаметр вируса существенно больше толщины среза, поэтому размер вирусной частицы зависит от плоскости среза. Однако впервые были обнаружены вирионы хантавируса Пуумала вытянутой эллипсовидной формы с максимальным размером около 300 нм. Похожие результаты были получены ранее при электронной криотомографии вируса Тула, непатогенного хантавируса наиболее близкородственного вирусу Пуумала [6]. Было показано, что размер и форма вирионов вируса Тула значительно варьировали, наблюдались сферические частицы размером 120-160 нм и продолговатые вытянутые частицы с диаметром 80 нм в поперечнике и максимальной длиной около 350 нм. Можно предположить, что наличие вирионов вытянутой формы, длина которых почти вдвое превышает ранее описанный средний диаметр хантавирусных вирионов [4, 5, 8, 9, 10], является уникальной особенностью, присущей, по крайней мере, двум близкородственным хантавирусам – Пуумала и Тула, адаптированным к размножению в культуре Vero E6.
Впервые предпринята попытка охарактеризовать состояние клеточной культуры в процессе репликации в ней хантавирусов. Ранее было отмечено отсутствие цитопатических изменений, наблюдаемых in vitro в световом микроскопе при репликации вируса Пуумала в культуре Vero E6, на протяжении 57 дней культивирования с периодической сменой питательной среды. Количество накапливаемого в среде вируса после достижения пиковых значений на 7-9 сутки снижалось и поддерживалось до конца эксперимента на уровне 3,5±0,5 lg ФОЕ/мл (неопубликованные данные). При исследовании ультратонких срезов как незаражённой, так и зараженной культуры клеток Vero E6 наблюдаются естественно протекающие процессы инволюции, которые при изучении заражённой культуры можно принять за патологические изменения, вызванные хантавирусом.
Таким образом, методом электронной микроскопии ультратонких срезов культуры клеток Vero E6, инфицированной вирусом Пуумала показано, что проникновение в клетку и репликация в ней хантавируса не вызывают патологических изменений.
Рецензенты:
Ожерелков С.В., д.б.н., заведующий лабораторией вирусных препаратов и иммуномодуляторов, ФГБНУ «Институт полиомиелита и вирусных энцефалитов им.М.П. Чумакова», г. Москва;
Хапчаев Ю.Х., д.б.н., начальник отделения полиомиелитной вакцины ФГУП «ПИПВЭ им. М.П. Чумакова», г. Москва.



