Проблема лечения вентральных грыж до сих пор привлекает внимание хирургов всего мира. Это можно объяснить большой распространенностью данной патологии. Так, грыжи передней стенки живота встречаются у 6-7% мужчин и у 2,5% женщин всего мира. Внедрение принципа пластики грыжевых ворот без натяжения тканей с использованием эндопротезов позволило упростить оперативную технику герниопластики, уменьшить операционную травму, а также улучшить отдаленные результаты (снизить частоту рецидивов с 10-30% до 0,1-1% [4]. Применение имплантатов привело к возникновению новой клинической проблемы – увеличению количества случаев инфекционных осложнений [7; 10]. При использовании протеза количество осложнений со стороны раны, таких как нагноение, серома, гематома, отторжение протеза, может достигать, по разным источникам, от 18,6 до 67% [3-5; 8]. Послеоперационные осложнения являются основной причиной продолжительного течения послеоперационного периода и значительного увеличения материальных затрат на лечение.
В доступной литературе встречаются разрозненные и единичные данные об использовании в герниопластике эндопротезов с серебряным покрытием, но нет данных о применении этих эндопротезов в инфицированной условиях, о морфологических изменениях элементов тканей, окружающих имплантированный эндопротез [4].
Таким образом, несистематизированное и разнонаправленное количество данных по проблеме использования эндопротезов с антибактериальным покрытием при обычной и инфицированной герниопластике и определило цель нашего экспериментального исследования.
Цель исследования. Изучить особенности реакции соединительной ткани передней брюшной стенки в раннем послеоперационном периоде при использовании опытных образцов сетчатых эндопротезов с антибактериальным покрытием.
Материалы и методы. Эксперименты in vivo выполнены на 30 белых крысах-самцах линии Wistar массой 180,0±20,00 г. Для проведения исследования нами были взяты экспериментальные образцы двух эндопротезов, состоящих из ПВДФ-нитей и пролипропилена, с нанесенным на них антибактериальным покрытием из серебра, предоставленных нам ООО «Линтекс» г. Санкт-Петербург.
Для исследования отбирали животных без внешних признаков заболевания, прошедших карантин в условиях вивария КГМУ. Животные были разделены на 2 экспериментальные группы по 15 крыс в каждой. Оперативные вмешательства выполняли в вечернее время суток в течение 2 недель. Во всех 3 сериях опытов под эфирным наркозом в стерильных условиях оперблока всем животным проводили разрез по средней линии живота в верхней трети длиной 4 см; рассекали кожу и подкожную клетчатку. Тупо выделяли участок апоневроза прямых мышц живота размером 4х4 см. К этому участку мононитью 2/0 фиксировали сетчатый эндопротез размером 2×2 см, моделируя надапоневротическую пластику. Эндопротез фиксировали узловыми швами по всей его площади. После этого в послеоперационную рану вводили 0,1 мл физиологического раствора, содержащего 1 млрд взвеси микробных тел суточной культуры Staphylococcus aureus 592 и Е. coli. Послеоперационную рану ушивали. Выведение животных из эксперимента проводили на 7, 14, и 21-е сутки путем передозировки средств для наркоза. После выведения животных из эксперимента забирали фрагмент брюшной стенки вместе с эндопротезом из центральной части имплантата размером 1x1 см. Далее изъятый материал фиксировали в 10%-ном растворе нейтрального формалина в течение 10 суток, затем образцы тканей обезвоживали и заливали в парафин по стандартной методике. С парафиновых блоков изготавливали срезы толщиной 5-7 мкм и окрашивали их гематоксилином и эозином, методом Ван-Гизона, PAS-реакция + альциановый синий с докраской ядер гематоксилином.
После юстировки оптической системы микроскопа Leica-CME с помощью окулярной фотонасадки DCM-510 были сфотографированы интересующие участки препаратов при ×40 и ×100-кратных увеличениях. Для определения преобладания воспалительных или репаративных тенденций производили подсчет качественного состава клеточных инфильтратов возле нитей эндопротезов и между ними. Выраженность воспалительной реакции оценивалась путем определения площади инфильтрата вокруг нитей эндопротеза.
Далее подсчет клеток производился в стандартном поле зрения в непосредственной близости к нити эндопротеза в расположенном рядом с нитью клеточном инфильтрате на увеличении х400. Расчет процентного состава производился на 100 клеток. Считали клетки резиденты (фиброциты, фибробласты и макрофаги) и нерезиденты (лимфоциты, нейтрофилы, эозинофилы и моноциты). С целью подтверждения статистической значимости расхождений средних величин в 2 сериях эксперимента нами в соответствии со стандартами ИСО 3534-3-99, а также ГОСТ Р 50779.10-2000 (ИСО 3534-1-93) после определения типа распределения данных был выбран метод оценки достоверности отличий Вилкоксона-Манна-Уитни. Все вычисления выполнялись с помощью аналитического пакета приложения Excel Office 2010.
Полученные результаты и их обсуждение
При изучении микропрепаратов с использованием эндопротезов двух образцов на 7-е сутки эксперимента было выявлено, что волокнистая соединительная ткань дермы резко отечна, кровеносные сосуды полнокровны. Нити окружены воспалительным инфильтратом, в котором преобладают сегменто- и палочкоядерные нейтрофилы, макрофаги и лимфоциты. Степень выраженности выявленных изменений больше в препаратах с использованием полипропиленового эндопротеза (рис. 1).
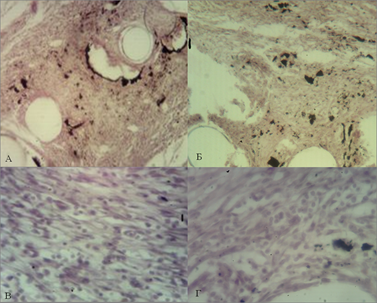
Рис. 1. Микрофотография области имплантации эндопротеза из ПВДФ-нитей (А), (В) и полипропилена (Б), (Г) на 7-е сутки эксперимента. Ув. х40 - А и Б, ув. х100 - В и Г. Окр. Г+Э.
На 14-е сутки эксперимента в препаратах с использованием ПВДФ-эндопротеза вокруг нитей имплантата сформирована хорошо выраженная двухслойная соединительнотканная капсула. Круглоклеточная инфильтрация частично сохранялась только в участках, расположенных между пучками нитей эндопротеза. Капсула хорошо васкуляризована. При использовании полипропиленового эндопротеза продолжала сохраняться отечность и лейкоцитарно-макрофагальная инфильтрация. Соединительнотканная капсула образована коллагеновыми волокнами, которые собраны в пучки, богата клеточными элементами, среди которых преобладают фибробласты и единичные гранулоциты, четкой границы между наружными и внутренними слоями капсулы нет (рис. 2).
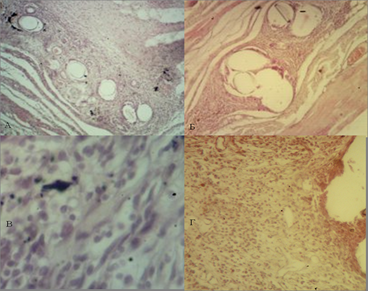
Рис. 2. Микрофотография области имплантации эндопротеза из ПВДФ-нитей (А), (В) и полипропилена (Б), (Г) на 14-е сутки эксперимента. Ув. х40 - А и Б, ув. х100 - В и Г. Окр. Г+Э.
На 21-е сутки в препаратах с использованием эндопротеза из ПВДФ-нитей среди клеток фибробластического ряда наблюдалось прорастание всех ячеек сетки эндопротеза волокнистой соединительной тканью с признаками организации волокон в пучки. На поверхности нитей сплошным слоем располагались фибробласты. При использовании полипропиленового эндопротеза продолжали сохраняться единичные очаги воспалительных изменений вокруг нитей эндопротеза. В окружающей соединительной ткани дермы в поле зрения встречалось большое количество гигантских клеток инородных тел. Вокруг нитей эндопротеза отмечается формирование хорошо выраженной соединительнотканной капсулы, от которой происходило врастание молодых соединительнотканных волокон в ячейки эндопротеза (рис. 3).
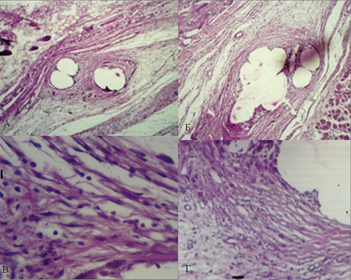
Рис. 3. Микрофотография области имплантации эндопротеза из ПВДФ-нитей (А), (В) и полипропилена (Б), (Г) на 21-е сутки эксперимента. Ув. х80 - А и Б, ув. х 400 - В и Г. Окр. Г+Э.
При определении площади инфильтрата нами были получены следующие результаты (таблица 1).
Таблица 1 - Динамика изменения площади воспалительно-клеточного инфильтрата, M±m, кв. мм
|
Образец Сутки |
7 |
14 |
21 |
|
Полипропиленовый |
1,23±0,021 |
0,94±0,042 |
0,84±0,02 |
|
ПВДФ-нити |
1,24±0,013 |
1,17±0,034,5 |
0,65±0,026 |
Примечание: различия клеточных индексов достоверны (p<0,05) 1 – по отношению к полипропиленовому эндопротезу на 14-е сутки, 2 – по отношению к полипропиленовому эндопротезу на 21-е сутки, 3 – по отношению к ПВДФ-эндопротезу на 14-е сутки,4 – по отношению к ПВДФ-эндопротезу на 21-е сутки, 5 - по отношению к полипропиленовому эндопротезу на 14-е сутки, 6 - по отношению к полипропиленовому эндопротезу на 21-е сутки.
Как видно из таблицы 1, динамика морфологических изменений вокруг нитей полипропиленового и ПВДФ-эндопротезов была сходной. Происходит снижение площади инфильтрата на 21-е сутки на 36,3 и 54,8% соответственно по отношению к начальным срокам эксперимента. Несмотря на то что у ПВДФ-эндопротеза на 7-е сутки имеется большая выраженность воспалительной реакции, в итоге на 21-е сутки площадь инфильтрации оказывается ниже по сравнению с полипропиленовым эндопротезом.
Аналогичную картину течения репаративного процесса подтверждают показатели подсчета клеточных элементов в воспалительном инфильтрате вокруг нитей эндопротеза (рис. 4).
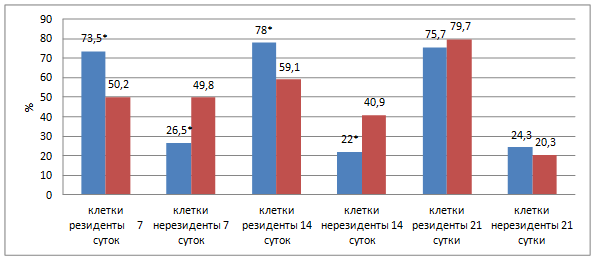
Рис. 4. Динамика изменения клеточного состава воспалительно-клеточного инфильтрата.
Примечание: *- различия значений клеточного состава достоверны (p<0,05) по отношению к группе с использованием полипропиленового эндопротеза.
На данной диаграмме представлена динамика изменения клеточного состава ткани вокруг нитей эндопротезов с антибактериальным покрытием из серебра на основе полипропилена и ПВДФ-нитей. На всех сроках эксперимента отмечалось увеличение количества клеток резидентов. Максимальное количество нерезидентных клеток выявлено на 7-е сутки с использованием полипропиленового имплантата (49,8%), в то время как с использованием ПВДФ-имплантата в 1,8 раза меньше - 26,5%. С использованием ПВДФ-эндопротеза максимальное количество резидентных клеток наблюдалось уже на 14-е сутки (78%), а с использованием полипропиленового эндопротеза максимальное значение было достигнуто только к 21-м суткам (79,7%). Численность нерезидентных клеток на 14-е сутки составляла 40,9 и 22% соответственно. На 21-е сутки при использовании полипропиленового эндопротеза количество клеток-нерезидентов снизилось почти в 2 раза и составило 20,3%, а при использовании ПВДФ-эндопротеза уменьшилось на 2,2% и составило 24,3%.
Выводы. Таким образом, при использовании сетчатого ПВДФ-эндопротеза с антибактериальным покрытием регенеративные процессы протекают более активно по сравнению с сетчатым полипропиленовым эндопротезом с антибактериальным покрытием.
Степень выраженности воспалительных изменений вокруг нитей эндопротезов обратно пропорциональна срокам эксперимента и наименее выражена в препаратах с использованием сетчатого ПВДФ-эндопротеза с антибактериальным покрытием.
Следовательно, наилучшей биосовместимостью и антибактериальными свойствами обладает имплантат с антибактериальным покрытием из серебра на основе ПВДФ-нитей.
Рецензенты:
Бежин А.И., д.м.н., профессор, заведующий кафедрой оперативной хирургии и топографической анатомии им. профессора А.Д. Мясникова, ГБОУ ВПО «КГМУ» Минздрава России, г. Курск;
Липатов В.А., д.м.н., профессор кафедры гистологии, эмбриологии, цитологии, доцент, ГБОУ ВПО «КГМУ» Минздрава России, г. Курск.



