Таким образом, воздействие на сниженную активность клеток иммунитета с помощью иммунотропных препаратов позволяет достичь не только прямого лимфоцитотропного эффекта [2], но и оказывать опосредованное воздействие за счет модуляции продукции каскада цитокинов, что расширяет спектр противоопухолевого воздействия, приобретающего интегральный системный характер.
Помимо иммунологических показателей, актуальным является изучение неспецифической составляющей терапии цитокинами, позволяющее продемонстрировать реакцию организма на терапевтическое воздействие как целого и включающее оценку нейроэндокринных механизмов поддержки и регуляции неспецифической резистентности организма.
Открытие закономерности развития различных типов ответных общих неспецифических адаптационных реакций (ОНАР) при действии слабых, промежуточных (средних) и сильных раздражителей легло в основу теории адаптационной деятельности организма [3,4,8].
Не менее информативным представляется изучение морфологии неклеточной жидкости крови, так как доказано, что сыворотка достоверно отражает патофизиологический статус организма и изменения его гомеостаза [7]. Это сравнительно новое научное направление функциональной морфологии биологических жидкостей определило дифференциальный подход в отношении диагностики состояния организма по структурным признакам самоорганизации жидкости при переходе в твердотельное состояние. Данная диагностическая информация позволяет существенно дополнить сведения об интегральной реакции организма.
Цель исследования
Изучить изменения структуры ОНАР и морфологии сыворотки крови у больных с ранними рецидивами и рефрактерным течением ЛХ на этапах полихимиотерапии в сочетании с рекомбинантным интерлейкином-2 и интерфероном-α2b.
Материалы методы
Материалом для исследования стали 30 больных с ранними рецидивами (РР)и резистентной ЛХ, в возрасте 22-58 лет, которые были разделены на 2 группы в зависимости от метода лечения: основную (n=15), в которой проводилась полихимиотерапия (ПХТ) II линии по схеме DHAP в сочетании с экстракорпоральной иммунотерапией (ЭИТ) рекомбинантным интерлейкином-2 (РИЛ-2) и интерфероном α2b (ИФН), и контрольную (n=15), где больные получалитолько стандартную ПХТ IIлинии. Методика ЭИТ заключалась в том, что после введения филграстима за 24 часа до процедуры с целью стимуляции выброса в периферический кровоток функционально активных клеток крови проводили сеанс лейкоцитаферезана сепараторе крови MCS «Haemonetics» (США). Лейкомассусобирали в стерильные пластикатные контейнеры «Гемакон», делили на 2 порции и инкубировали в течение 24 часов при температуре 370С: 1-ю порцию с РИЛ-2 в дозе 5 тыс. МЕ/мл, 2-ю порцию с ИФН в дозе 10 тыс. МЕ/мл, реинфузию проводили внутривенно капельно за сутки до проведенияи через сутки после завершения 2 и 4циклов ПХТ. Исследование структуры адаптационных реакций (АР) на этапах лечения проводили методом Гаркави по составу клеточных элементов формулы крови и сигнальному критерию лимфоцитов, подсчитанных на 200 клеток в мазках, окрашенных по Романовскому-Гимзе.
У каждого пациента проводили идентификацию типов ОНАР, включающих патологические – стресс в острой и хронической форме и физиологические типы – тренировку, спонтанную и повышенную активацию, а также переактивацию. В полученном массиве данных определяли общегрупповые кластеры одноименных ОНАР и их относительный объем, формируя общегрупповую структуру ОНАР на каждом этапе исследования. Для определения доминирующих ОНАР, как неспецифической основы эффективности лечения, использовали расчетный коэффициент соотношения сумм антистрессорных и стрессорных реакций [8], позволяющий объективно оценить влияние иммуномодулирующего фактора полихимиотерапии.
Для анализа системной организации фаций сыворотки кровь забирали путем пункции вены в центрифужную пробирку в объеме 1,0-1,5 см3, центрифугировали при 3000 об/мин в течение 10 минут. После отделения сыворотки от форменных элементов ее раскапывали 15-20 мкл микропипеткой-дозатором на предметное стекло с лецитиновой подложкой. Препараты высушивали при температуре 20-25 градусов по Цельсию и относительной влажности не более 70% в условиях отсутствия потоков воздуха в течение 20-24 часов. Микроскопирование осуществляли в проходящем свете, а также используя темновой и поляризационный оптические режимы микроскопа «LeicaDMLS2» с компьютерным программным обеспечением «Морфотест». Для характеристики системной организации сыворотки крови изучали частоту встречаемости разных типов фаций, к которым относят радиальный, частично-радиальный, иррадиальный, циркулярный и двойную фацию.
Статистическую обработку данных проводили с использованием пакета прикладных программ Statistica 6.0 (Statsoft, USA) и определением значимости различий по t-критерию Стьюдента для независимых выборок.
Результаты исследования
Анализ структуры ОНАР в крови больных до лечения выявил, что доминирующими типами реакций были стрессорные, частота выявления острого стрессапревышала в 1,2 встречаемость хронического стресса, и в сумме величина кластера стресса достигала 73%. В контрольной группе на фоне проведения стандартной ПХТ наблюдались разновекторные изменением структуры АР. Увеличилась в 1,5 раза по сравнению с фоном частота развития острого стресса за счет перехода из хронической формы этой реакции. Вместе с тем, уменьшение кластера хронического стресса в 4,5 раза было связано и с переходом в антистрессорные реакции, главным образом в тренировку, частота выявления которой у больных контрольной группы увеличилась в 3,9 раза. Кроме того, в 20% случаев были идентифицированы реакции спокойной и повышенной активации. В основной группе после завершения 4 курсов ПХТ в сочетании с ЭИТ доля стрессорных реакций уменьшалась в 4 раза, за счет увеличения частоты формирования реакций физиологического типа, что указывало на корригирующую, иммуномодулирующую и биоадаптивную роль использованного метода ЭИТ с использованием РИЛ-2 и ИФН.
Проведение стандартной ПХТ в обеих группах приводило к повышению биоадаптивного потенциала за счет формирования реакций тренировки и спокойной активации. Однако в основной группе коэффициент соотношения антистрессорных реакцийпревысил контрольные значения в 1,7 раза.
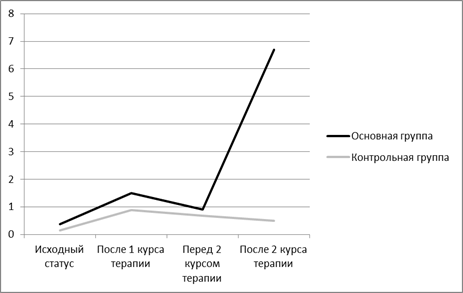
Рис.1. Динамика соотношения антистрессорных реакций и стрессов на этапах лечения больных лимфомойХоджкина с применением экстракорпоральной иммунотерапии на этапах полихимиотерапии II линии в сравнении с контрольной группой (стандартная полихимиотерапияII линии)
При изучении фаций сыворотки крови было установлено, что у больных в исходном состоянии не идентифицировались нормотипы, такие как радиальные и частично-радиальные. Напротив, практически во всех случаях было установлено формирование патологических типов фаций: иррадиального, циркулярного, двойной фации, что говорило о серьезном дисбалансе внутренней среды организма.
После завершения курсов полихимиотерапии без использования иммуномодуляторов в фациях сыворотки крови больных лимфомойХоджкина наблюдалось образование широких неравномерных трещин с нарушенной пространственной симметрией (рисунок 2)
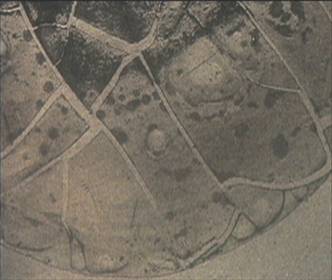
Рис.2. Фрагменты фаций сыворотки крови у больных лимфомойХоджкина после окончания полихимиотерапии. Частичное восстановление пространственной структуры I и II уровней самоорганизации. Формирование иррадиальных типов фаций с полиморфными отдельностями и конкрециями. Пигментно-липидные комплексы в центральной и промежуточной зонах как признаки глубоких гепато-дуоденальных нарушений. Ув. х 40.
Наблюдалось образование редких полиморфных отдельностей и конкреций, которые смещались от края фации к центру. Это отражало нарушения в системе белок-соль из-за высоких концентраций патологических белков, включая токсические, воспалительные и другие фракции, а также липопротеиновых и пигментных ингридиентов. Кроме того, конкреции в фациях сыворотки крови характеризуют энергетическую активность белковых молекул.Судя по этому признаку, были идентифицированы редкие, частично завершенные и несформированные конкреции, что позволило судить о снижении энергетического потенциала белковой субстанции сыворотки крови пациентов контрольной группы.Также глубокие нарушения первого уровня самоорганизации, касающиеся пространственной симметрии трещин, отмечались прежде всего у пациентов контрольной группы при неэффективной полихимиотерапии – стабилизации опухолевого процесса и прогрессировании.
В случаях, когда удавалось достичь частичной ремиссии, процессы самоорганизации приобретали выраженную тенденцию к формированию структуры фации с частично-радиальной симметрией, появлению редких, но длинных трещин с равномерным образованием крупных секторов от центра до краевой зоны фации. Наличие незначительно встречающихся краевых отдельностей и конкреций свидетельствовало о возможности незначительного упорядочивания белково-солевых отношений в биосистеме жидкости. В целом фации сыворотки крови демонстрировали незавершенный тип структурирования.
При анализе морфоструктуры фаций сыворотки крови у больных основной группы при полном ответе опухоли на проводимое лечение прослеживалась выраженная направленность формирования нормотипов фаций с радиальной и частично радиальной симметрией трещин. На препаратах визуализировалась относительно выровненная густая система радиальных трещин по всей поверхности фации, что свидетельствовало о процессах восстановления системных ритмов биожидкости, ликвидации глубоких нарушений молекулярного состава белков и солей, связанных с метаболизмом опухоли и привнесения ею чужеродной структурной и волновой информации. Было отмечено появление круговых концентрационных аутоволн, как одного из первых признаков нормализации закономерностей клиновидной дегидратации в отношении соблюдения ауторитмов градиентной концентрации определенной группы ассоциированных молекул, близких по своим физико-химическим параметрам к норме.
В отношении формирования структур II уровня – отдельностей и конкреций, их количество, размеры и формы продолжали варьировать в широких пределах. Мелкие, четкие, мономорфные структуры формировались, как правило, в краевой зоне фации, что характеризовало восстановление морфогенеза биожидкости. В центральной зоне было отмечено преимущество крупных полиморфных конкреций, отражающих незавершенный характер гомеостатической регуляции нарушений белкового и минерального обмена при иммуннохимиотерапиилимфомыХоджкина. Однако эти зональные отличия отмечались в фациях сыворотки крови больных с частичной регрессией опухоли, а при полной регрессии – преобладали завершенные формы I и II уровней самоорганизации биожидкости.
Выводы
У больных с РР и резистентной ЛХ до начала терапии среди общих неспецифических АР доминируют патологические типы реагирования. Проведение ПХТ II линии сопровождается высоким стрессогенным влиянием, которое сводится к минимуму при включении в схему лечения ИТ.Отмечено выраженное модулирующее влияние предложенного метода лечения на молекулярные системы крови в процессе фазового перехода из жидкого в твердотельное состояние. Очевидно, противоопухолевая эффективность иммуномодулируемой химиотерапии определяется не только угнетением роста злокачественной опухоли, но и ослаблением патофизиологических механизмов ее влияния на внутреннюю среду организма. Это демонстрируется процессами упорядочивания структуры системного и подсистемного уровня самоорганизации сыворотки крови.
Рецензенты:Голотина Л.Ю., д.м.н., профессор, акушер-гинеколог отделения онкогинекологии, ведущий научный сотрудник отдела опухолей репродуктивной системы ФГБУ «Ростовский научно-исследовательский онкологический институт» Министерства здравоохранения РФ, ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону;
Каймакчи О.Ю., д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону.



