Цель исследования
Изучить влияние терапии вилдаглиптином на морфофункциональное состояние почек геминефрэктомированных крыс со стрептозотоцин-индуцированным сахарным диабетом, получавших высокожировое питание.
Материалы и методы исследования
Модель диабетической нефропатии у крыс. Все эксперименты были одобрены локальным этическим комитетом. Животные содержались в стандартных условиях вивария при естественном освещении, имели свободный доступ к воде и пище. Пилотное исследование выполнено на половозрелых самцах крыс стока Wistar массой 180–210 г, подвергшихся правосторонней нефрэктомии, которым моделировали экспериментальный СД согласно методике Zhang M. и соавт. посредством введения в рацион говяжьего сала с последующим двукратным внутрибрюшинным введением стрептозотоцина (СТЗ) в дозе 30 мг/кг с интервалом 7 дней [10]. Геминефрэктомированным крысам из группы здорового контроля (n=5), получавшим стандартный пищевой рацион, вместо СТЗ внутрибрюшинно был введен натриевый цитратный буфер (10 ммоль/л, pH 4,5) из расчета 2,5 мл/кг в те же сроки с аналогичным интервалом. СД диагностировали в ходе проведения орального глюкозотолерантного теста через 2 недели после первой инъекции СТЗ при выявлении гликемии выше 12,0 ммоль/л, предварительно разделив крыс случайным образом на три равные по численности группы.
Протокол эксперимента. Через 8 недель после манифестации СД животным трех групп на последующие 8 недель были назначены следующие препараты (ежедневно):
1) вилдаглиптин в дозе 8 мг/кг/сутки с питьевой водой – группа вилдаглиптина (n=5);
2) подкожные инъекции изофан-инсулина по 2 ед/сутки — группа гликемического контроля (n=5) на инсулинотерапии.
Контрольная группа крыс в сроки назначения лекарственных препаратов получала крахмал (50 мг/кг) с питьевой водой (группа плацебо-контроля (n=5)).
Исследуемые показатели. С интервалом в 1 неделю измеряли массу тела, потребление корма и воды, после индукции СД – глюкозу и ацетон в моче. По окончании эксперимента оценивали уровни креатинина (Cr) и мочевины сыворотки, гликированного гемоглобина (НbA1c), общего холестерина и триглицеридов, последние 2 показателя – также по окончании 4-недельного высокожирового питания. Перед выводом из эксперимента животные на 24 ч помещались в индивидуальные метаболические камеры. Определяли объем выделившейся мочи, концентрацию альбумина в моче и креатинина (Cr), рассчитывали уровень экскреции альбумина с мочой и клиренс креатинина. Морфологический анализ и морфометрия. Для светооптической микроскопии парафиновые срезы толщиной 3–4 мкм окрашивали гематоксилин-эозином и проводили ШИК-реакцию. С помощью инвертированного микроскопа Leica DMI6000 полученные срезы исследовались не менее чем в 20 полях зрения. Степень экспансии мезангиального матрикса и гломерулосклероза оценивали полуколичественным методом путем расчета индекса, описанного Raij и соавт. [9]. Для этого были рассмотрены все клубочки, пригодные для анализа (диапазон от 20 до 42), которые были классифицированы от 0 до 4 баллов. Также оценивались изменения почечных сосудов (склероз мелких артерий и артериол, их гиалиноз).
Реактивы и методы лабораторного анализа. Креатинин мочи и сыворотки, мочевину определяли на анализаторе Cobas Integra 400 plus (США) с использованием коммерческих наборов фирмы Roche, Германия. Альбумин в моче — иммуноферментным методом на автоматическом фотометре для микропланшет ELx 800 Bio TEK, США (ИФА-набор фирмы AssayPro, США). HbA1c исследовали методом высокоэффективной жидкостной хроматографии на анализаторе BioRad D10, США.
Стрептозотоцин, цитрат натрия и хлоралгидрат приобретены в Sigma Aldrich, США; вилдаглиптин – Novartis PHARMA STEIN AG, Швейцария, инсулин изофан — Фармстандарт, Россия.
Результаты и обсуждение
Значения определяемых по окончании эксперимента показателей в исследуемых группах сведены в таблицу 1. В использованной модели диабетической нефропатии дисфункция почек наступила в результате 50%-й редукции функционирующей массы почечной ткани и поражения нефронов вследствие длительной (16 недель) гипергликемии.
Таблица 1
Значения определяемых по окончании эксперимента (24-я неделя) показателей в исследуемых группах (M ± СКО)
|
Определяемый показатель |
Экспериментальные группы, n= 5 в каждой |
|||
|
|
Плацебо |
Инсулин |
Вилдаглиптин |
Здоровый контроль |
|
Масса тела, г |
262 ± 17,4# |
298 ± 8,12# |
275 ± 14,3# |
490 ± 23,8 |
|
Общий холестерин, ммоль/л |
2,2 ± 0,34 |
2,45 ± 0,27 |
2,34 ± 0,36 |
1,89 ± 0,19 |
|
Триглицериды, ммоль/л |
2,14 ± 0,35# |
1,9 ± 0,42# |
1,94 ± 0,32# |
0,83 ± 0,29 |
|
Гликированный гемоглобин, HbA1c, % |
12,8 ± 1,42# |
10,7 ± 1,26*# |
11,02 ± 0,88*# |
4,7 ± 0,15* |
|
Креатинин сыворотки, мкмоль/л |
93,2 ± 6,7# |
90,75 ± 7,3# |
84,7 ± 5,9* |
76,5 ± 3,8* |
|
Клиренс креатинина, мл/мин |
1,71 ± 0,31# |
2,07 ± 0,35# |
2,2 ± 0,3* |
2,48 ± 0,27* |
|
Мочевина сыворотки, ммоль/л |
21,03 ± 3,64# |
23,3 ± 4,7# |
5,8 ± 0,8* |
|
|
Уровень экскреции альбумина с мочой, мг/24 ч |
26,9 ± 6,0# |
23,16 ± 3,97# |
10,5 ± 2,39*# |
4,2 ± 1,96* |
Примечание: * — значимое (р<0,05, ANOVA) различие в сравнении с группой плацебо
# — значимое (р<0,05, ANOVA) различие в сравнении с группой здорового контроля
Показатели массы тела и углеводного обмена. Темпы набора массы тела на протяжении 4-недельной высокожировой диеты значимо опережали физиологическую прибавку веса, наблюдаемую у крыс контрольной группы, получавших стандартный пищевой рацион, и к концу 4-й недели составили соответственно 432 ± 22,4 г и 315 ± 11,7 г, p = 0,023. Однако после двукратной инъекции СТЗ и индукции диабета у набравших вес животных наблюдалось постепенное снижение набранной массы тела вплоть до завершения эксперимента на 24-й неделе, отражая декомпенсацию заболевания. Натощаковый уровень глюкозы плазмы значимо повысился после 4 недель высокожирового питания (6,12 ± 0,42 ммоль/л) по сравнению с крысами контрольной группы, находившихся на стандартном рационе (4,2 ± 0, 3 ммоль/л, р=0,031), достигнув максимума через 6 недель после первой инъекции СТЗ (12,8 ± 2,64 ммоль/л, p=0, 0012). Назначенные на 16-й неделе эксперимента сахароснижающие препараты достоверно не повлияли на натощаковый уровень глюкозы плазмы, который оставался стабильно высоким вплоть до окончания исследования. При этом показатели углеводного обмена приближались к значениям, описанным разными авторами в моделях крыс с абсолютной инсулиновой недостаточностью [2]. По окончании эксперимента в диабетических группах уровень НвА1с был в среднем в 2,5 раза выше в сравнении со здоровыми животными, с наибольшими значениями у крыс группы плацебо. Интересно отметить, что показатели углеводного обмена были статистически неразличимы в группах терапии инсулином и вилдаглиптином. Предположительно, сравнимый по силе с инсулином сахароснижающий эффект вилдаглиптина был связан с описанным ингибированием апоптоза бета-клеток поджелудочной железы, и, как следствие, с увеличением образования и секреции инсулина [1] (однако уровень инсулина в нашем пилотном исследовании не определялся).
Показатели липидного профиля. Общий холестерин и триглицериды значимо повысились к окончанию высокожировой диеты (3,3 ± 0,17 ммоль/л и 2,1 ± 0,42, соответственно) по сравнению с группой здорового контроля (1,72 ± 0,13 ммоль/л и 0,59 ± 0,12 ммоль/л соответственно), р<0,05 для всех. По завершении экспериментального протокола (24-я неделя) достоверная разница в уровне холестерина по сравнению с контрольной группой, получавшей стандартный пищевой рацион, отсутствовала, при этом уровень триглицеридов остался на прежнем уровне, на поздних этапах отражая активацию липолиза и синтеза триглицеридов из свободных жирных кислот вследствие дефицита инсулина.
Показатели почечной функции
У контрольных экспериментальных животных с СД по сравнению с группой здорового контроля через 24 недели после произведенной правосторонней нефрэктомии было отмечено снижение клиренса креатинина, сопровождающееся увеличением концентрации креатинина и мочевины в сыворотке крови (табл. 1), что соответствовало развитию 1-й стадии экспериментальной почечной недостаточности. Другим маркером дисфункции почек являлся значимо повышенный уровень экскреции альбумина с мочой, указывающий на повреждение клубочкового аппарата нефрона диабетического генеза. Наблюдаемое выраженное и статистически между собой неразличимое повышение уровня мочевины сыворотки во всех диабетических группах крыс отражало, по всей видимости, не степень прогрессирования почечной недостаточности (поскольку другие маркеры ренальной дисфункции в этих группах значимо различались), а являлось проявлением чрезмерного катаболизма белка вследствие инсулинопении и нарушения выведения мочевины, развивающегося при диабетическом кетоацидозе, наблюдаемом в нашем эксперименте у всех крыс с диабетом.
Тем не менее, несмотря на значительные метаболические изменения, отмечавшиеся у крыс с СД, 8-недельная терапия вилдаглиптином значимо уменьшала уровень креатинина сыворотки и экскрецию альбумина с мочой (рис. 1).
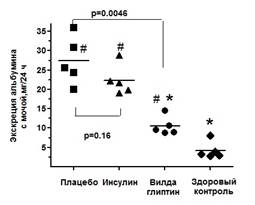
Рис. 1. Уровень экскреции альбумина с мочой по окончании эксперимента (24-я неделя) в исследуемых группах. * — значимое (р<0,05, ANOVA) различие в сравнении с группой плацебо; # — значимое (р<0,05, ANOVA) различие в сравнении с группой здорового контроля
Кроме того, в группе крыс, получавших вилдаглиптин, наблюдалось достоверное, сопоставимое с показателями в недиабетической группе, улучшение клиренса креатинина по окончании эксперимента (рис. 2).
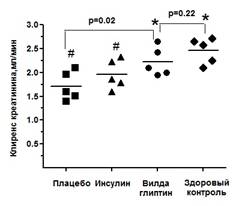
Рис. 2. Уровень клиренса креатинина по окончании эксперимента (24-я неделя) в исследуемых группах. * — значимое (р<0,05, ANOVA) различие в сравнении с группой плацебо; # — значимое (р<0,05, ANOVA) различие в сравнении с группой здорового контроля
Результаты морфологического исследования
У контрольных крыс без СД по результатам светооптической микроскопии почечной ткани состояние гломерулярного аппарата и интерстиция соответствовало ранее описанным незначимым структурным изменениям, развивающимся после геминефрэктомии (рис. 3а) [8]. В контрольной группе крыс с СД, получавших плацебо, были обнаружены закономерные диабетические изменения почечной ткани: в сравнении с крысами из группы здорового контроля наблюдали 1,5-кратное увеличение размера клубочков, расширение мезангиального матрикса, образование спаек между стенками гломерулярной капсулы и петлями капилляров, сосудистые изменения (рис. 3б-г).
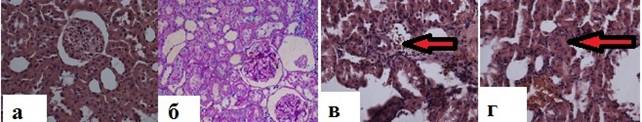
Рис. 3. Результаты светооптической микроскопии почечной ткани крыс контрольных групп. а Состояние клубочкового аппарата почек в группе здорового контроля: Светооптическая микроскопия, окраска гем. – эоз., ×200. Отсутствие диабетических изменений. б-г — специфические диабетические изменения, наблюдаемые в почечной ткани крыс с СД, получавших плацебо: б — Светооптическая микроскопия, ШИК-окраска, ×100. Экспансия мезангиального матрикса, мезангиальная гиперклеточность. Очаговые отложения ШИК-позитивного вещества в мезангиальном матриксе; в — светооптическая микроскопия, окраска гем.-эоз., ув. ×400. Утолщение стенки артериолы (отмечено стрелкой); г — Светооптическая микроскопия, окраска гем.-эоз., ув. ×400. Артериологиалиноз (отмечено стрелкой)
При этом в группе крыс, получавших инсулин, также отмечались все вышеперечисленные изменения диабетического генеза (рис. 4а), и рассчитанный индекс мезангиальной экспансии (38,8 ± 5,3) был сопоставим с показателем в группе плацебо (43,1 ± 4,9 ), р=0,68, тогда как у животных, получавших вилдаглиптин, наблюдаемые диабетические изменения почечной ткани оказались менее выраженными (рис. 3а), а индекс мезангиальной экспансии оказался значимо ниже в группе контрольных крыс с СД ( 29,2 ± 3,2 , р=0,038). Достоверной разницы в значениях рассчитанного индекса гломерулосклероза в диабетических группах обнаружено не было.
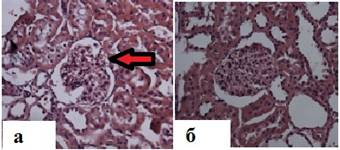
Рис. 3. Результаты светооптической микроскопии почечной ткани крыс, получавших сахароснижающие препараты: а — морфологические изменения почечного клубочка в группе инсулина. Светооптическая микроскопия, окраска гем. – эоз., ×200. Отложение «фибриновых шапочек» (эозинофильных масс, содержащих фибриновые волокна и липидные включения, в пространстве капсулы, прилежащих к капиллярным петлям клубочка – отмечено стрелкой); б — морфологические изменения почечного клубочка в группе терапии вилдаглиптином
Полученные нами результаты не противоречат мировым литературным источникам. Так, в работе Liu и соавт. было показано, что терапия вилдаглиптином в дозе 8 мг/кг, назначенная сразу после манифестации стрептозотоцинового СД 1-го типа у крыс Sprague-Dawley, приводила к улучшению ренальной функции к 24 неделе эксперимента. При этом значимые структурные изменения в почечной ткани авторам удалось обнаружить только при проведении электронной микроскопии [6]. Обнаруженные нефропротективные свойства препарата не зависели от сахароснижающего эффекта вилдаглиптина и были ассоциированы со снижением гиперпродукции трансформирующего ростового фактора β-1 (TGF- β 1), выполняющего функцию контроля клеточного роста, клеточной пролиферации, дифференцировки и апоптоза клеток и рассматривающегося, по современным представлениям, в качестве одного из ключевых медиаторов повреждения почек при СД. [6, 4]. В нашем исследовании вилдаглиптин улучшал морфофункциональные сдвиги в менее продолжительные сроки (8-недельная терапия), будучи назначенным экспериментальным животным по прошествии 8 недель пребывания крыс в состоянии гипергликемии. Кроме того, за счет редукции 50% массы функционирующей почечной паренхимы происходило ускорение наступления структурных и функциональных признаков ДН, нефропротективные свойства вилдаглиптина удалось доказать при проведении светооптической микроскопии.
Выводы
У получавших высокожировое питание геминефрэктомированных крыс со стрептозотоцин-индуцированным сахарным диабетом терапия ингибитором ДПП-4 вилдаглиптином значимо уменьшала уровни рутинных маркеров повреждения почек и выраженность морфологических диабетических изменений. Полученные результаты могут свидетельствовать о наличии у вилдаглиптина, помимо сахароснижающего действия, нефропротективных свойств, что требует дальнейших исследований в этой области, в том числе выясняющих патогенетические механизмы нефропротекции.
Исследование проведено с использованием оборудования ресурсного центра «Развитие молекулярных и клеточных технологий» СПбГУ и при поддержке гранта РФФИ N 15-04-08138/15. Авторы выражают благодарность руководителю НИЛ клинической эндокринологии ФГБУ СЗ ФМИЦ д.м.н. А.А. Байрамову за содействие в проведении исследования.
Рецензенты:Власов Т.Д., д.м.н., проф., заведующий кафедрой патологической физиологии с курсом клинической патофизиологии, декан лечебного факультета ПСПбГМУ им. акад. И.П. Павлова, г. Санкт-Петербург;
Митрейкин В.Ф., д.м.н., проф. кафедры патологической физиологии с курсом клинической патофизиологии ПСПбГМУ им. акад. И.П. Павлова, г. Санкт-Петербург.



