Физические свойства
В свободном состоянии монооксид азота (NO) – это бесцветный газ без запаха, обладающий высокой реакционной способностью. Его молекулярная масса составляет 30,01 г/моль, растворимость в воде – 74 см3/дм3, показатель преломления – 1,0002697, температура плавления – 163,6 °С, температура кипения – 151,7 °С [5].
Основным природным источником NO являются электрические разряды молний в грозу. При сгорании топлива примерно 90% оксидов азота превращается в NO, а оставшиеся 10% – в диоксид азота [20]. В ходе химических реакций значительная часть монооксида азота превращается в N2O. Это бесцветный газ со сладковатым вкусом, большие количества которого приводят к притуплению болевой чувствительности и потере сознания, благодаря чему в смеси с кислородом (80% N2О+20% О2) он иногда применяется для наркоза.
Обнаружено, что оксид азота вырабатывается различными клетками организма – эндотелиоцитами, эпителиоцитами, мезангиоцитами, миоцитами, лимфоцитами, нейтрофилами, тромбоцитами, макрофагами, моноцитами, фибробластами, нейронами, гепатоцитами, тучными клетками – и контролирует в них многие функции и биохимические процессы [21; 22]. Одно из наиболее удивительных открытий последнего десятилетия – установление роли NO как внутриклеточного мессенджера.
Открытие
Профессор доктор биологических наук А.Ф. Ванин в 1965 году обнаружил в биологических объектах с помощью электронного парамагнитного резонанса радикалы неизвестной природы, показав их гипотензивное действие. В 1985 г. он получил данные, что открытые радикалы имеют отношение к окиси азота [16].
В 1980 году фармаколог из Университета штата Нью-Йорк Р. Фарчготт в эксперименте показал, что ацетилхолин расширяет кровеносные сосуды в тех случаях, когда стенка сосудов не повреждена. Р. Фарчготт пришел к выводу, что неповрежденные эндотелиальные клетки продуцируют сигнал, расслабляющий гладкую мускулатуру сосудов. Этот сигнал молекулы был назван EDRF (эндотелиум-получательно-распределяющий фактор).
Независимо от Р. Фарчготта в поисках неизвестной сигнальной молекулы принимал участие доктор Л. Игнарро из Калифорнийского университета в Лос-Анджелесе. В 1986 году Л. Игнарро заключил, что EDRF идентичен окиси азота.
В 1977 году врач-фармаколог Ф. Мюрад из Медицинской школы Техасского университета в Хьюстоне установил, что нитроглицерин и другие родственные сосудорасширяющие вещества освобождают окись азота, которая расширяет гладкую мускулатуру клеток.
В июле 1986 года Р. Фарчготт и Л. Игнарро получили аналогичные данные. Это вызвало лавину исследований в различных лабораториях во всем мире. 10 декабря 1998 г. в Стокгольме (Швеция) трем ученым из США: Р. Ферчготту, Л. Игнарро и Ф. Мюраду, была присуждена Нобелевская премия по физиологии и медицине за открытие роли оксида азота как сигнальной молекулы в сердечно-сосудистой системе [12].
Синтез монооксида азота в организме
Образование монооксида азота происходит в результате окисления атомом кислорода L-аргинина в присутствии специфического фермента NO-синтазы [1].
2L-аргинин + 3НАДФН + 4O2 + 3H+ → 2L-цитруллин + 2NO + 3НАДФ+ + 4H2O
В зависимости от структуры и локализации различают следующие изоформы NO-синтаз (NOS): эндотелиальные (eNOS), нейрональные (nNOS) и макрофагальные (mNOS). Активность nNOS имеет максимальное значение около 300 нмоль/мг/мин, mNOS – до 1000 нмоль/мг/мин, eNOS – около 15 нмоль/мг/мин. Молекула nNOS (161 kDa) состоит из 1434 аминокислотных остатков, mNOS (131 kDa) – 1153, eNOS (133 kDa) –1203. nNOS и mNOS содержатся, главным образом, в цитоплазме клетки, eNOS связана с клеточными мембранами [9; 22; 23]. В активный центр NOS входит железопорфириновый комплекс, содержащий цистеин или метионин. В синтез монооксида азота посредством NO-синтаз включаются шесть кофакторов: никотинамидадениндинуклеотидфосфат (НАДФ-Н), флавинадениндинуклеотид (ФАД), флавинмононуклеотид (ФМН), тетрагидробиоптерин, гем и кальмодулин.
Изоформы NOS отличаются по механизму действия и биологическому значению для организма. Поэтому их подразделяют на конститутивную (cNOS) и индуцибельную (iNOS). Нейрональная NOS является только конститутивной, mNOS –индуцибельной формой, eNOS в 80% является конститутивной и в 20% – индуцибельной ферментативной формой (табл. 1).
Активность cNOS зависит от концентрации Са2+ и кальмодулина. Механизм действия eNOS и nNOS имеет сходный характер. Под влиянием вазодилятаторных агентов (ацетилхолина, аденозина, 5-оксиптриптамина, глутамата, брадикинина, гистамина и других) в цитозоле эндотелиальных клеток возрастает уровень Са2+, который соединяется с кальмодулином. Комплекс Ca-кальмодулин выступает как кофактор, активирующий NOS. Под влиянием ингредиентной NOS образуются малые количества NO, который осуществляет местную регуляцию. Он диффундирует к прилегающим гладким мышцам, вызывая последовательную активацию гуанилатциклазы, протеинкиназы G, протеинфосфатазы. В результате дефосфорилируется одна из субъединиц К+ мембранного канала, приводя к усилению калиевой проводимости через плазматическую мембрану миоцитов. Вследствие конформационных изменений, вызванных гиперполяризацией мембраны, снижается проницаемость кальциевых каналов и падает уровень свободного Са2+ в клетках. Это вызывает расслабление миофибрилл и является причиной снижения тонуса кровеносных сосудов [13; 22; 24; 26; 32].
Таблица 1
Сравнительная характеристика NOS [1]
|
Характеристики |
nNOS |
iNOS |
eNOS |
|
Клеточная экспрессия |
Нейроны, эпителиоциты, эндотелиоциты, миоциты скелетных мышц и сосудов, нейтрофилы, тромбоциты, f3-клетки поджелудочной железы |
Макрофаги, нейтрофилы, эпителиоциты, кардиомиоциты, глиальные клетки, миоциты сосудов, эндотелиоциты, нейроны |
Эндотелиоциты, кардиомиоциты, тромбоциты, нейроны |
|
Гены |
NOS1 (12q24.2-12q24.3) |
NOS2 (17q11.2-q12) |
NOS2 (7q35-7q36) |
|
Основные регуляторные механизмы |
Ca2+зависимый Ca-дистрофин |
Ca2+-независимый |
Ca2+зависимый (Ca-кальмодулиновый), Ca2+-зависимый (фосфорилирование) |
|
Субклеточная локализация |
Цитоплазма, эндоплазматический ретикулум, сарколемма |
Фагосомы, пероксисомы, мембрана, ядро клетки, митохондрии |
Аппарат Гольджи, мембрана клетки в области маленьких инвагинаций, которые содержат трансмембранный кавеолин, ядро клетки, митохондрии |
Активация сNOS наблюдается при гипоксических состояниях организма, при вазоконстрикции сосудов, под влиянием фактора активации тромбоцитов (ФАТ) через ФАТ-рецепторы на клетках эндотелия [2; 6; 12]. Монооксид азота, продуцируемый под влиянием nNOS и eNOS, при некоторых формах патологии, наряду с регуляторным, оказывает и протективное действие [10; 11; 21].
iNOS появляется в клетках (макрофагах, нейтрофилах, кератиноцитах, фибробластах, хондроцитах, остеокластах) только после индукции их бактериальными эндотоксинами и некоторыми медиаторами воспаления (гамма-интерфероном, ИЛ-1, ИЛ-2, фактором некроза опухоли), активными формами кислорода, а также гормонами, которые воздействуют на синтез циклического аденозинмонофосфата (адреналин, глюкагон). iNOS участвует в реакциях неспецифического иммунитета [12; 15; 18; 20-23; 26].
Физиологическая роль и механизмы действия NO
Все многообразие физиологических эффектов NO можно разделить на 3 типа:
• регуляторное влияние;
• защитное действие;
• повреждающее действие [17; 19].
Центральная и периферическая нервная система. Наиболее хорошо изучена роль NO в нервной системе, где окись азота активирует процесс выброса нейромедиаторов из нервных окончаний во время синаптической передачи. Более того, молекула NO сама может играть роль нейромедиатора [4; 12; 20; 21; 22; 26].
nNOS регулирует рост и дифференцировку клеток ЦНС и, предположительно, их восстановление после локальных ишемических повреждений головного мозга [11; 12; 17]. В ишемизированном участке мозга глутаматергические нейроны вместо физиологической порции нейротрансмиттера выделяют поток глутамата, который обрушивается на NO-синтезирующие нейроны, – происходит так называемый глутаматный каскад. В результате повышается поступление Ca2+ в клетку и, как следствие, возрастает синтез и выделение из нейрона NO [23]. Ингибиторы синтеза оксида азота (нитроаргинин, гемоглобин) защищают нейроны, снижая их гибель на 73% [4; 7; 26].
NO участвует в процессах долговременной синаптической потенциации, связанной с образованием памяти. Таким образом, в мыслительной деятельности окись азота является и непосредственным участником, и косвенным регулятором [11; 15; 23].
Сердечно-сосудистая система. NO поддерживает вазодилатацию, регулирует кровоток и контролирует базальное артериальное давление [7; 12; 16]. Окисленные липопротеины низкой плотности (ЛПНП) подавляют синтез оксида азота в тромбоцитах, стимулируют их агрегацию, образование тромбоксана А2 и серотонина, способствуя дисфункции эндотелия и нарушению структуры сосудов, ведущих к развитию атеросклероза [11; 12].
В случае инфаркта миокарда оксид азота стимулирует ангиогенез [12]. NO способствует синтезу эндотелиального фактора роста, тормозит пролиферацию и миграцию гладкомышечных клеток [11], гипертрофию сосудов [1], подавляет синтез внеклеточного матрикса, поддерживая всем этим нормальную структуру сосудистой стенки.
Пищеварительный и урогенитальный тракты, дыхательная система. Оксид азота участвует в обеспечении моторной функции желудочно-кишечного тракта, при этом некоторые заболевания (болезнь Гиршспрунга, ахалазия кардии, хроническая псевдообструкция кишечника) обусловлены снижением числа внутрикишечных нейронов, вырабатывающих NO [12]. NO регулирует поступление желчи в кишечник и является одним из важных факторов защиты слизистой желудка путем воздействия на её кровоснабжение.
NO, вырабатываемый в гепатоцитах, защищает эти клетки от действия ряда токсичных веществ, включая этанол и парацетамол. Эндогенный оксид азота подавляет синтез белка в печени, ингибирует ряд ферментов энергетического обмена, в том числе митохондриальную аконитазу, НАДН-дегидро-геназу и сукцинатдегидрогеназу (комплексы I и II дыхательной цепи). При поражении гепатотоксичными окислителями NO может действовать как антиоксидант, сохраняя клеточные запасы восстановленного глутатиона. Оксид азота замедляет распад глюкозы, ингибируя глицеральдегидфосфатдегидрогеназу. Таким образом, защитное действие NO может быть обусловлено замедлением обменных процессов и сохранением запасов энергии в печени.
В различных отделах почки представлены все три изоформы NOS. Оксид азота активно участвует в её физиологических процессах: регулирует почечную гемодинамику, гломерулярную фильтрацию, ингибирует транспорт Na+ и увеличивает его экскрецию.
NO играет важную роль в регуляции функций легких и в патофизиологии заболеваний системы дыхания. Активные радикалы азота увеличивают продукцию муцина и эпителиальной слизи, ускоряют движения ресничек реснитчатого эпителия, индуцируют активность апикальных анионных и базолатеральных калиевых каналов эпителиоцитов, способствуя механической элиминации инфекционных агентов.
При цилиарной дискинезии, муковисцидозе, дефиците α1-антитрипсина, легочной артериальной гипертензии наблюдается снижение содержания NO в выдыхаемом воздухе [1].
Иммунонейроэндокринная система. Установлена важная роль оксида азота в регуляции иммунонейроэндокринной системы [8; 9; 15]. Запуск стресс-реакции происходит за счет активации гипоталамо-гипофизарно-надпочечниковой и симпатоадреналовой систем [27]. Торможение активности nNOS способствует увеличению концентрации вазопрессина и окситоцина [29]. NO ингибирует активацию гипоталамо-гипофизарно-надпочечниковой системы, вызываемую вазопрессином, обладая стресслимитирующим действием [9; 13; 15; 29].
Аксоны NO-ергических нейронов надпочечников контактируют с хромаффинными клетками, продуцирующими катехоламины. Выделение оксида азота происходит одновременно с норадреналином. В небольших концентрациях NO угнетает высвобождение катехоламинов из надпочечников и симпатических нервных окончаний, приводя к ограничению стресс-реакции [28].
Оксид азота выполняет функцию медиатора воспаления. Каждая фаза асептического воспаления ассоциирована с определенными изоформами NOS. На ранней фазе воспалительной реакции под действием медиаторов (гистамина, брадикинина, простагландинов и лейкотриенов) [30] происходит стимуляция продукции оксида азота с помощью nNOS. Параллельно усиливается активность еNOS. В клетках сосудистого эндотелия NO активирует растворимую гуанилатциклазу, что приводит к усиленному образованию цГМФ, который вызывает релаксацию гладкомышечных клеток сосудов, увеличивая сосудистую проницаемость [17]. сNOS и iNOS имеют отношение к продукции оксида азота в ранней фазе воспаления.
В развитие поздней фазы воспаления вносит вклад только оксид азота, продуцируемый с помощью iNOS, локализованной в лейкоцитах. На этой стадии воспалительного процесса NO стимулирует синтез и высвобождение провоспалительных цитокинов – ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-6, лейкотриенов, хемокинов, которые, в свою очередь, стимулируют миграцию лейкоцитов в очаг воспаления. NOS контролирует биосинтез ИЛ-4, ИЛ-10, ИЛ-11 и ИЛ-13, которые относятся к противовоспалительным цитокинам [17; 30].
Действие высоких и низких концентраций оксида азота
Действие оксида азота опосредовано его концентрацией (рисунок). Малые физиологические концентрации NO (<10-6 М), которые сопровождают функционирование конститутивных эндотелиальных и нейронных изоформ NOS, оказывают цито- и нейропротекторное действие. Его нетоксические уровни обладают выраженной антиапоптотической активностью, вероятно, за счет непосредственного нитрозилирования внутриклеточных цистеиновых протеаз (каспаз-3, -8) и других проапоптотических белков [3; 25]. Показано, что в больших концентрациях он индуцирует апоптоз клеток определенного типа – макрофагов, тимоцитов, клеток островков поджелудочной железы, некоторых нейронов и опухолевых клеток. Повреждение ДНК активными радикалами азота приводит к накоплению p53, которое считают индикатором NO-опосредованного апоптоза [1].
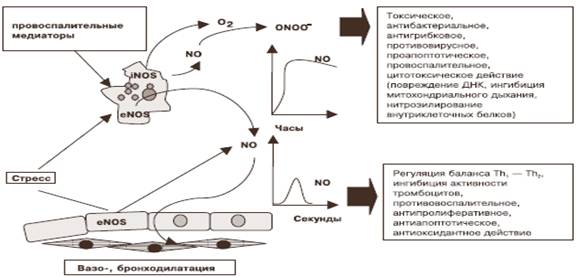
Действие высоких и низких концентраций оксида азота [1]
Высокие концентрации оксида азота, которые возникают при работе iNOS, вызывают цитотоксическое, антибактериальное, противовирусное, противогрибковое действие, а также активируют воспалительный процесс [7; 12]. Показано, что NO, вступая в реакцию с железо- и тиолсодержащими участками ферментов митохондриального дыхания, репликации ДНК инфекционных агентов, проявляет прямое бактерицидное действие. Он ингибирует многие вирусные протеиназы и факторы транскрипции, необходимые для вирусной репликации, а также усиливает противовирусный эффект интерферона-γ. NO уменьшает или препятствует размножению вируса HIV [31].
Опосредованное влияние на инфекционные агенты связано с ингибированием каталазы, которое приводит к накоплению перекиси водорода и гидроксильного радикала, образованию пероксинитрита, более токсичного, чем оксид азота, для большинства бактериальных, вирусных и грибковых инфекционных агентов. Показано, что NO и пероксинитрит оказывают выраженное бактерицидное действие на Streptococcus группы B, Staphylococcus aureus, Mycoplasma pneumonia, Chlamydia, Leishmania, Mycobacterium tuberculosis.
Пролонгированная во времени высокая концентрация может привести к нарушению баланса активности внутриклеточных сигнальных путей. Активные радикалы азота активируют или ингибируют белки ионных каналов, ядерные факторы транскрипции, киназы, каспазы, металлопротеиназы, метилтрансферазы, фосфодиэстеразы.
Заключение
Таким образом, разнообразие эффектов оксида азота обусловлено образованием физиологически активных метаболитов NO и его взаимодействием с различными молекулярными мишенями, а также носит дозозависимый характер. Анализ литературы показал, что многие аспекты NO еще до конца не изучены и зачастую противоречивы. Тем не менее выяснение механизма действия оксида азота заслуживает пристального внимания и дальнейшего исследования, поскольку способствует решению многих фундаментальных проблем биологии и имеет большое практическое значение для медицины.
Рецензенты:
Буйлова Т.В., д.м.н., профессор, директор Института реабилитации и здоровья человека ННГУ им. Н.И. Лобачевского г. Нижний Новгород;
Перетягин С.П., д.м.н., профессор, президент Ассоциации российских озонотерапевтов, г. Нижний Новгород.



