Присутствие трофобластов в кровотоке беременных женщин было показано еще в 1893 году [8]. Удивительный феномен не привлекал внимания исследователей до второй половины прошлого века, когда в медицине сформировалась необходимость диагностики наследственных заболеваний еще до рождения ребенка. В любом случае для осуществления пренатальной диагностики требуется наличие ткани плода, получаемой при проведении инвазивной процедуры (биопсия ворсин хориона, амниоцентез, кордоцентез), сопряженной с определенным риском прерывания беременности [9]. Альтернативным вариантом получения информации о генетическом статусе развивающегося плода является исследование циркулирующих в крови беременных женщин клеток плодной природы (лейкоциты, эритробласты, трофобласты), поскольку забор образца периферической венозной крови матери не несет угрозы прерывания беременности [3].
Было показано, что в 1 мл крови беременной женщины содержится 1–6 клеток плода, и большая часть этих клеток имеет трофобластную природу [4,5]. Крайне низкое содержание плодных клеток в материнском кровотоке является причиной нелегкого поиска оптимального способа выделения клеток плода из образца материнской крови. Одним из способов «обогащения» исследуемого образца клетками плодной природы является градиентное центрифугирование [2].
Цель исследования
Целью данного исследования явилась оценка возможности анализа генетического материала трофобластов, выделенных из периферической крови с помощью градиентного центрифугирования, в рамках проведения модельного эксперимента.
Материалы и методы исследования
Материалами для данного исследования послужили 29 образцов искусственно созданных (артифициальных) смесей. Артифициальные смеси получали путем добавления 0,5 мл клеточной суспензии ворсин хориона, полученных из абортного материала замерших беременностей, к 1 мл гепаринизированной периферической венозной крови взрослых индивидуумов с нормальным кариотипом. Таким образом, создавалась имитация состава крови беременной женщины, содержащей клетки трофобласта. Кариотипы каждого образца клеток хориона и периферической крови были известны и установлены при проведении стандартного цитогенетического исследования.
Выделение клеток трофобласта из артифициальной смеси осуществлялось с помощью центрифугирования в ступенчатом градиенте растворов Перколл (GEHealthcareBio-Science, Швеция) различной плотности (рисунок 1). Кроме того, в работе был использован второй вариант ступенчатого градиента, для приготовления которого применяли растворы Перколл с плотностями 1,077 и 1,066 г/мл в объеме 1 мл каждый. Для 22 образцов артифициальных смесей после градиентного центрифугирования использовали этап магнитно-активированной клеточной сортировки (МАКС) с моноклональными антителами (МКАТ) к панлейкоцитарному антигену CD45 (MiltenyiBiotec, Германия). Полученные фракции клеток наносились на покрытые полимерной PEN-мембраной предметные стекла (CarlZeiss, Германия) в виде клеточного монослоя в ходе цитоцентрифугирования с последующей фиксацией клеток в смеси метанола и ацетона 1:1.
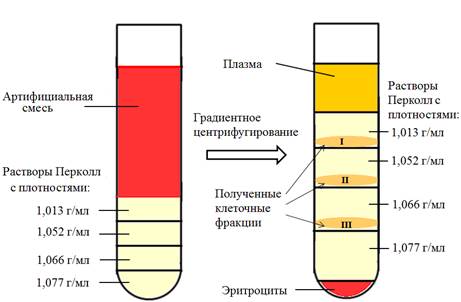
Рис.1. Схематическое изображение формирования градиента плотности растворов Перколл и клеточных фракций, полученных в результате центрифугирования
Детекция клеток цитотрофобласта на полученных цитологических препаратах проводилась посредством иммуноцитохимического окрашивания меченными щелочной фосфатазой МКАТ к цитоплазматическому белку цитокератину 7 (CK7) с использованием набора EnVision+ System-HRP(Dako, Дания). Единичные СК7-положительные клетки изолировались с цитологических препаратов с помощью системы лазерной микродиссекции CarlZeissPALMMicroBeam (CarlZeiss, Германия). Диссектированный материал собирался в пробирки-коллекторы объемом 0,5 мл, непосредственно в которых далее проводился этап полногеномной амплификации генетического материала единичных клеток с использованием набора WGA4-50RXNGenomePlexSingleCellWholeGenomeAmplificationKit (SIGMA-ALDRICH, США). Анализ генетического материала полученных клеточных образцов проводили методом метафазной сравнительной геномной гибридизации (CGH) [1]. Анализ изображения производился с помощью программы «LUCIACGH», установленной в комплексе с эпифлюоресцентным микроскопом «eclipse 90i» (Nikon, Япония) и CCD камерой «ProgResMF» (JENOPTIK, Германия).
Результаты исследования и их обсуждение
На первом этапе работы был произведен поиск оптимальных значений плотностей растворов Перколл для выделения трофобластов из 7 образцов артифициальных смесей. Основываясь на данных, полученных Manoussaka с соавторами [6], для формирования ступенчатого градиента было выбрано четыре значения плотности растворов Перколл- 1,013 г/мл, 1,052 г/мл, 1,066 г/мл и 1,077 г/мл, на границах которых могут сепарироваться клетки с различным удельным весом (рисунок 1).
Трофобласты являются клетками эпителиальной природы, в которых экпрессируются цитокератины – семейство цитоплазматических белков промежуточных филаментов эпителиальных клеток. В частности, цитокератин 7 (CK7) присутствует как в цитоплазме клеток нормального и неопластического железистого и переходного эпителия [7], так и в цитоплазме трофобластов [6]. Поэтому для детекции клеток трофобласта в полученных после градиентного центрифугирования фракциях использовали МКАТ к CK7.
При микроскопическом исследовании цитологических препаратов после иммуноцитохимического окрашивания было выявлено, что клеточные фракции, полученные на границах растворов Перколл с плотностями 1,013/1,052 г/мл (клеточная фракция I) и 1,052/1,066 г/мл (клеточная фракция II), содержали СК7–положительные клетки, тогда как в клеточной фракции IIIСК7 – положительные клетки отсутствовали. Кроме того, было обнаружено, что в клеточной фракции II наблюдалось большее количество СК7-положительных клеток по сравнению с фракцией I. Но при этом во фракции II было отмечено и наличие большого числа лейкоцитов, что затрудняло визуализацию и дальнейший анализ клеток интереса. В связи с этим было принято решение об объединении выделяемых трофобластных клеток в одной клеточной фракции и последующей отрицательной сортировке лейкоцитов.
Для формирования ступенчатого градиента в 22 образцах артифициальной смеси использовали растворы Перколл с плотностями 1,066 и 1,077 г/мл. Мы предположили, что CК7 – положительные клетки должны максимально сконцентрироваться в клеточной фракции на границе плазмы и раствора Перколл с плотностью 1,066 г/мл, тогда как клеточная фракция на границе растворов Перколл с плотностями 1,066 и 1,077 г/мл не должна содержать СК7-положительных клеток, как было показано ранее. После градиентного центрифугирования клеточная фракция, отобранная на границе плазмы и раствора Перколл плотностью 1,066 г/мл, подвергалась отрицательной МАКС с использованием МКАТ к панлейкоцитарному антигену CD45. В результате удалось значительно сократить число лейкоцитов и получить преимущественно отдельно лежащие трофобласты, что обеспечило удобство не только их микроскопии, но и последующей микродиссекции. После иммуноцитохимического окрашивания цитологических препаратов, полученных из каждой клеточной фракции, было подтверждено наличие CК7-положительных клеток в клеточной фракции, образованной на границе плазмы и раствора Перколл с плотностью 1,066 г/мл. Клеточная фракция на границе растворов Перколл с плотностями 1,066 г/мл и 1,077 г/мл трофобластов не содержала (рисунок 2).
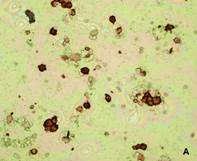
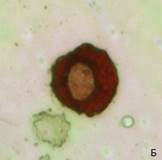
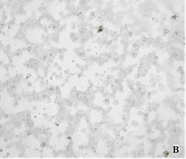
Рис.2. Фотографии цитологических препаратов, полученных после градиентного центрифугирования и окрашенных с помощью антител к цитокератину 7. А: клеточная фракция, отобранная на границе плазмы и раствора Перколл с плотностью 1,066г/мл, 100х увеличение. Б: цитотрофобласт, 400х увеличение. В: клеточная фракция, отобранная на границе растворов Перколл с плотностями 1,066 г/мл и 1,077 г/мл, отсутствие в ней цитокератин 7-положительных клеток, 100х увеличение
Таким образом, было показано, что обогащение артифициальной смеси трофобластами возможно путем центрифугирования с использованием ступенчатого градиента плотности растворов Перколл. Применение растворов Перколл с плотностями 1,066 и 1,077 г/мл позволило получить одну клеточную фракцию, содержащую трофобласты, и при этом избавиться от более тяжелых клеток стромы ворсин хориона. Большое число лейкоцитов, содержащихся в клеточной фракции интереса, было успешно удалено из образца при помощи отрицательной МАКС.
Для проведения лазерной микродиссекции и последующего анализа генетического материала единичных клеток были выбраны цитологические препараты, содержащие трофобласты плода с нормальным мужским кариотипом (46,XY), плода с нормальным женским кариотипом (46,XX) и плода женского пола с трисомией по 13 хромосоме (47,XX,+13). В результате проведенной полногеномной амплификации диссектированных единичных CK7-положительных клеток среднее значение концентрации ДНК в образцах составило 1105 нг/мкл. Таким образом, полногеномная амплификация явилась важным этапом, благодаря которому удалось получить многократное увеличение количества ДНК в образце, достаточное для последующего анализа.
Сравнительная геномная гибридизация была проведена в образцах амплифицированной геномной ДНК, полученной из одной диссектированной клетки. Анализ полученных профилей гибридизации показал, что виртуальный кариотип клеток во всех трех случаях соответствовал результатам стандартного цитогенетического исследования (рисунок 3). На основании приведенных выше данных можно утверждать, что выделенные из артифициальной смеси СК7-положительные клетки являются плодными по происхождению.
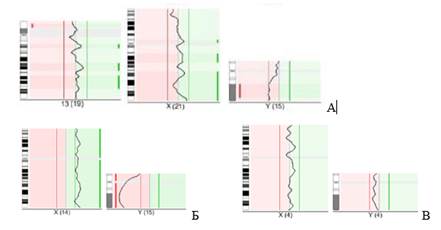
Рис.3. Результаты сравнительной геномной гибридизации генетического материала одной клетки, изолированной из артифициальной смеси, содержащей трофобласты плода: А –женского пола с трисомией по 13 хромосоме; Б – с нормальным женским кариотипом; В – с нормальным мужским кариотипом (представлены профили гибридизации половых хромосом (А, Б,В) и хромосомы 13 (А))
Заключение
С помощью метода градиентного центрифугирования удалось «обогатить» исследуемый образец плодными клетками. Последующее применение МАКС с панлейкоцитарными МКАТ к CD45 позволило удалить из исследуемой клеточной фракции лейкоциты, затруднявшие изоляцию единичных клеток для их последующего анализа. Таким образом, в условиях модельного эксперимента удалось исследовать молекулярный кариотип выделенных из артифициальных смесей СК7-положительных клеток и сделать вывод об их плодном происхождении. Успешное выполнение всех этапов модельного эксперимента является основой для продолжения работы по выделению и анализу трофобластов из образцов нативной крови беременных женщин. Однако этапы выделения, детекции и анализа единичных трофобластов в рамках экспериментов с кровью беременных женщин должны выполняться с учетом крайне низкого содержания плодных клеток в образце и возможного изменения их антигенных характеристик.
Рецензенты:
Зинченко Р.А., д.м.н., профессор, заведующая лабораторией генетической эпидемиологии ФГБНУ «МГНЦ», г. Москва;
Костюк С.В., д.б.н., заведующая лабораторией молекулярной биологии ФГБНУ «МГНЦ», г. Москва.



