Актуальность. По-прежнему существует точка зрения, что различные патогенные микроорганизмы связаны с риском увеличения рака [19, 39, 41, 46, 48, 49]. Одним из первых ассоциированных с раком заболеваний был шистосомоз, провоцирующий развитие рака печени, а позднее TeodorBilhiarz была показана связь возбудителя с раком мочевого пузыря [4]. Бактериальная инфекция с Helicobacterpylori является фактором риска развития язвы желудка и раком желудка [36, 50]. Однако главными виновниками среди инфекционных причин рака, как для человека, так и для животных являются вирусы, которые ассоциируются с 20% раковых заболеваний [1, 13, 17]. Очень строгие критерии, используемые для выявления их онкогенных свойств, позволили классифицировать в качестве онкогенных только шесть человеческих вирусов. Антивирусная стратегия основана на современных представлениях об онкогенных вирусах, анализе механизмов, лежащих в основе инфекционных причин рака. Принята концепция патологического изменения локального клеточного гомеостаза под влиянием микроорганизмов, увеличивающих вероятность онкогенных трансформаций камбия ткани с последующим приобретением ими фенотипа стволовых раковых клеток. После этого происходит инвазия мутировавших раковых клеток в подлежащие или окружающие ткани. При этом инфекционное происхождение рака иллюстрируется примерами по исходу инфекции гепатита С, что авторы связывают с высокой долей гепатоцеллюлярной карциномы. Вирус гепатита С (ВГС, hepatitis C virus — HCV) не только приводит к хроническому заболеванию печени, но также имеет и внепеченочные проявления [3, 5, 15, 16, 20, 31]. В мире 150 миллионов человек являются хронически больными HCV, ежегодно заражаются 3-4 миллиона, что свидетельствует о высокой актуальности изучаемой проблемы [4, 22].
По мнению Rodríguez-NóvoaS, MorelloJ, González M, et al (2008), применение противовирусных препаратов вызавает гемолиз и повышает гипербилирубинемию [37]. По их данным, лечение ВИЧ / гепатит-С инфицированных пациентов, привело к увеличению гипербилирубинемии с 9% до 45% после начала лечения гепатита C. В целом, по данным многих авторов, эффективность стандартного противовирусного лечения не превышает 50-80%, поэтому актуален поиск новых cредств и схем лечения с учётом того, что препараты с прямым внутриклеточным разрушением вируса стоимостью на курс лечения $8000 вряд ли могут быть эффективны, если метод PCR показал отсутствие вируса в гепатоцитах, а инфекция признаётся многими авторами генерализованной, часто начинающейся с клинических проявлений, свидетельствующих о поражении других органов [11, 16]. Внепечёночную патологию связывают со способностью репликации вируса вне гепатоцитов. Кроме этого, противовирусные препараты настолько токсичны для организма человека, что иногда вследствие этого их необходимо отменять [1, 7, 8, 14, 24, 30].
При HCV-инфекции заболевания почек включают в себя смешанные криоглобулинемии, лимфопролиферативные заболевания и сопровождаются различными гистологическими формами гломерулонефрита почек. Преобладающим типом HCV-ассоциированных гломерулонефритов является мембранопролиферативный гломерулонефрит (МПГН), который одни авторы считают связанным с криоглобулинемией II типа, другие утверждают, что механизм мембранопролиферативного гломерулонефрита связан с циркуляцией в крови антител и частиц вируса гепатита С и их оседанием в почках с повреждением структур мочекровяного барьера [1].
Встречаются и менее распространенные формы гломерулонефрита у VHC 1,2 инфицированных пациентов: они включают МПГН без криоглобулинемии, мембранозный гломерулонефрит (МГН), фокальный сегментарный гломерулосклероз, пролиферативный гломерулонефрит, фибриллярные и иммунотактоидные гломерулопатии. Отдельные сообщения касаются и HCV-ассоциированных IgA-нефропатий, быстро прогрессирующего гломерулонефрита и тромботической микроангиопатии, связанной с криоглобулинемическим МПГН [7]. В целом, почечный прогноз является неблагоприятным [20], заболевание почек с нарушением структуры почечных телец остается ведущей причиной повреждения почки и заболеваемости/смертности у больных с гломерулонефритом на фоне гепатита С [7]. Однако, существует ли причинная связь между этими гломерулярными заболеваниями и вирусным гепатитом С, до сих пор неизвестно [35].
У большинства больных гепатитом С, включая ВИЧ-инфицированных, развивается стойкая анемия [12, 25, 26, 32, 34], усугубляющаяся приёмом токсических препаратов. Анемия на современном этапе не имеет исчерпывающего патофизиологического обоснования, как и раскрытия механизмов снижения гемоглобина в крови больных гепатитом С и ВИЧ-инфицированных, предполагается, что анемия имеет многофакторную природу [6, 38], что объясняет случаи неудачных попыток эмпирического применения эритропоэтина в лечении больных гепатитом С и ВИЧ-инфицированных [2, 18, 40].
Учитывая неблагоприятный прогноз, изучение механизмов развития почечной патологии, цирроза и канцерогенеза печени на фоне гепатита С в связи с анемией и аноксией является на современном этапе наиболее актуальным.
Материал и методы исследования. В работе использован материал печени, почки и лёгких больных гепатитом С, в том числе ВИЧ-инфицированных в возрасте 30-38 лет, полученный в соответствии с приказом Минздравмедпрома РФ от 29.04.94 N 82 "О порядке проведения патологоанатомических вскрытий", по правилам регламентирующей инструкции о порядке вскрытий трупов в лечебных учреждениях. Группу контроля составили 14 пациентов, погибших в результате травм, несовместимых с жизнью, предположительно без соматической патологии в возрасте от 24 до 76 лет. Биопсийный материал фиксировался по прописи для подготовки к гистологическим исследованиям сразу после забора. Исключение возможных артефактов основано на данных, полученных при специальном исследовании на собаках, свидетельствующих, что при сохранении трупов при температуре 7°С до 4-6 часов в морфологии различных систем органов микроскопически видимых изменений не наблюдается, кроме некоторого снижения интенсивности специфических реакций на ферментативную активность.
Использованы классические гистологические методы исследования с окрашиванием гематоксилин-эозином для получения общей морфологической картины. Анализ материала проведён с помощью микроскопа Olympus – Bx82 и цифровой камеры CDх82 с фирменным программным обеспечением.
Результаты собственных наблюдений и их обсуждение. Распределение материала по возрасту, полу и внепечёночным проявлениям представлено в таблице 1.
Таблица 1
Распределение материала
|
№ |
Возрастные группы |
Контроль |
Патология |
Материал |
||||
|
печень |
лёгкие |
почки |
||||||
|
Гепатит С |
Гепатит С + ВИЧ инфекция |
ВИЧ инфекция |
||||||
|
1 |
30-33 года |
3 |
7 |
4 |
3 |
14 |
14 |
14 |
|
2 |
34-35 лет |
3 |
3 |
3 |
3 |
9 |
8 |
9 |
|
3 |
36-38 лет |
8 |
3 |
5 |
4 |
12 |
12 |
12 |
|
ИТОГО |
49/104 |
14 |
13 |
12 |
10 |
35 |
34 |
35 |
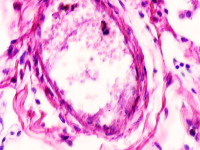
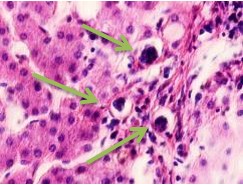
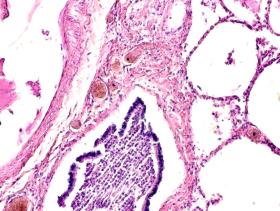
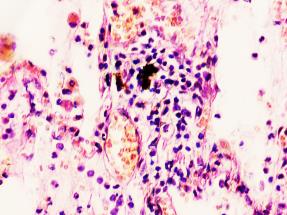
Установлено, что в печени человека, инфицированного вирусом гепатита С в системе оттока крови идентифицируются макрофаги, содержащие в цитоплазме фагоцитированный пигмент коричневого цвета (рис. 1). Цвет пигмента в цитоплазме фагоцитов или внутри сосудов варьирует от красно- до тёмно-коричневого (рис. 1 а, б, в). Эндотелий сосудов может быть сохранён частично, при этом гипертрофированным, с ядрами, расположенными перпендикулярно базальной мембране, но на большей части поверхности сосуда разрушен. Коричневый пигмент может располагаться диффузно в просвете или вблизи эндотелия сосудов (рис. 1 г, д). На фоне диффузно располагающегося пигмента идентифицируются макрофаги с тёмными включениями в цитоплазме (рис. 1 д).
 а
а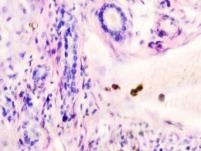 б
б
 в
в 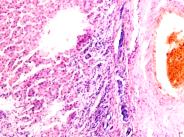 г
г
 д
д
Рис. 1. Печень человека. А) 33 года, б) 35 лет, в) 36 лет; г) 38 лет. А, б, в) макрофаги с пигментом в цитоплазме в просвете сосудов; г, д) пигмент в просвете сосуда; д) пигмент в цитоплазме макрофагов и диффузно расположенный в просвете сосуда. Окраска г/э. Микрофото. Ув. х 200
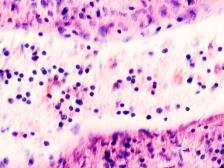
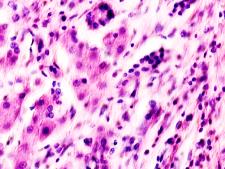
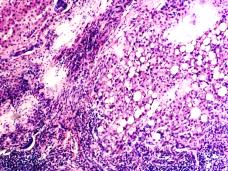
В паренхиме печени морфологическая картина острого гепатита С и его исходов: лейкоцитарная инфильтрация междольковой ткани (рис. 2 а, б, в), расширение желчных протоков (рис. 2 г), апоптоз гепатоцитов, жировая дистрофия печени (рис. 2 д, е), цирроз (рис. 2 ж).
 а
а 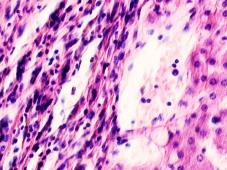 б
б
 в
в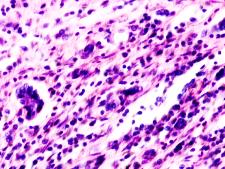 г
г
 д
д 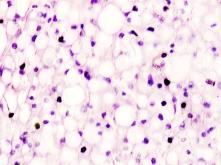 е
е
 ж
ж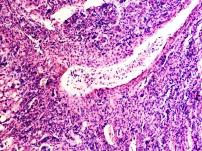 з
з
 к
к 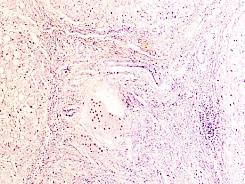 л
л
Рис. 2. Паренхима печени больных с гепатитом С. Псевдодолька печени. А, б) лейкоциты в просвете выносящего сосуда; в, г) лейкоцитарная инфильтрация междольковых структур; д, е) стеатоз; ж, з) цирроз; к) тельца Councilman; л) цирроз и некроз паренхимы печени. Отсутствует центральная вена. Апоптоз. Окраска г/э. Микрофото. Ув. а-з, л) х 200; к) х 400
Tельца Councilman одни авторы считают скоплением звездчатых ретикулоэндотелиоцитов, лимфоцитов, макрофагов, нейтрофилов в некротических массах, сформировавшихся при вирусном гепатите в печени в результате апоптозагепатоцитов, другие – микроскопическими гомогенными эозинофильными тельцами, обнаруживаемыми в перисинусоидных пространствах печени при некрозе гепатоцитов, встречающимися как результат апоптоза при различных заболеваниях.
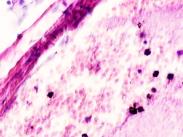
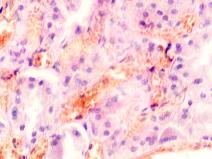
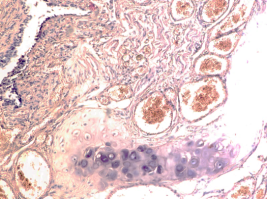
Гистологическое исследование почечных биоптатов обычно указывает на присутствие инфильтрации клубочков активированными макрофагами. При этом макрофаги нагружены пигментом тёмно-коричневого цвета, морфологически соответствующего комплексам белка с железом, трансферрину. Гломерулярная базальная мембрана имеет двойные контуры, что способствует проникновению моноцитов между базальной мембраной и эндотелием. Васкулит малых почечных артерий присутствует в 30% случаев. В наших исследованиях процесс нарушений в фильтрационном барьере почки связан с разрушением эритроцитов и выходом гемоглобина в паренхиму почки, захват его макрофагами с последующей эвакуацией через мочекровяной барьер в выделительный тракт. Часть паренхимы почки характеризуется гиперемией в системе почечного сосудистого клубочка (рис. 3 а, б). Часть почечных телец носит картину некроза (рис. 3 в). Большая часть паренхимы представлена почечными тельцами с признаками нарушений в системе мочекровяного барьера, гломерулонефрита и расширения в выносящих артериях, заполненных пигментом и макрофагами с фагоцитированными пигментными включениями в цитоплазме (рис. 3 г, д, е).
 а
а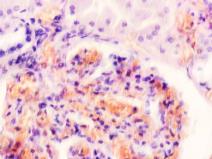 б
б
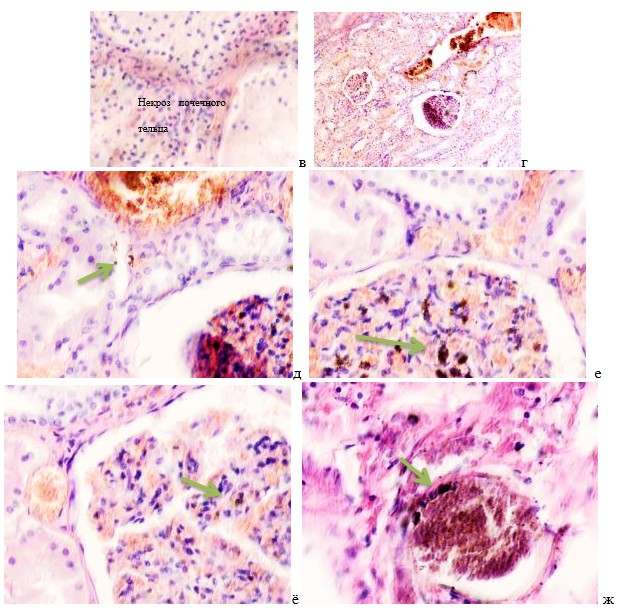
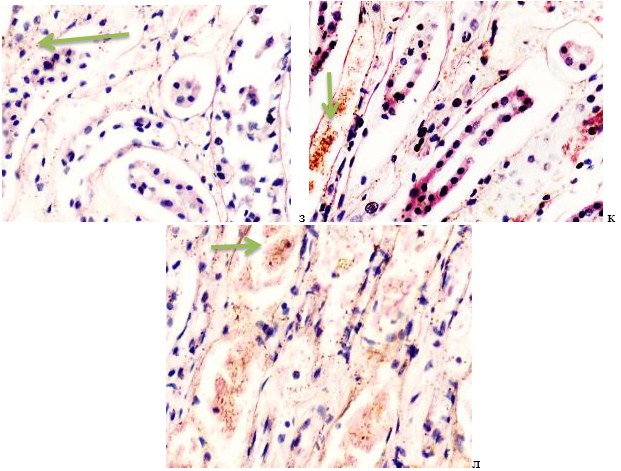
Рис. 3. Почка человека. Гепатит С, ВИЧ инфекция. А-е) корковое вещество; ж-к) мозговое вещество. А, в, д, ж, ё) гепатит С ; б, г, е, з, к, л) гепатит С и ВИЧ-инфекция. Окраска г/э. Микрофото. Ув.х 200
Нами установлено, что в паренхиме коркового и мозгового вещества почки сосуды гиперемированы. В сосудистых клубочках приносящая артериола и капиллярная сеть расширены, в системе выносящей артериолы в расширенных просветах наблюдается гемолиз эритроцитов, захват железа макрофагами, а также наличие пигмента в стенке проксимальных канальцев (рис. 3 ж, з, к). Наличие характерных признаков в морфологической картине повреждения почки, проявляющихся гиперемией, васкулитами, разрушением эритроцитов, диффузией трансферрина и захват его макрофагами, по нашему мнению, может свидетельствовать об одинаковом механизме патогенеза почечной и печёночной патологии на фоне ВИЧ и гепатита С.
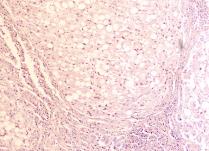
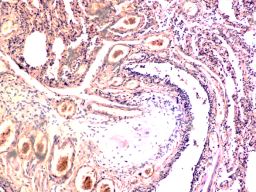
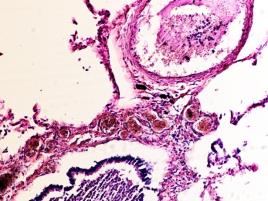
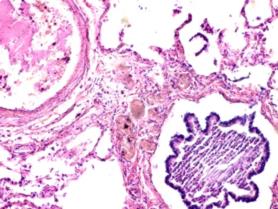
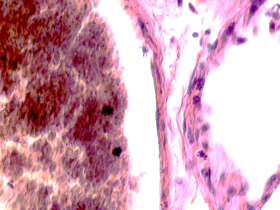
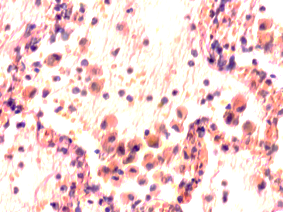
В лёгких пациентов с ВИЧ инфекцией и гепатитом С на фоне развившейся бластоцистной пневмонии наблюдается гибель альвеолярного эпителия, гиперемия кровеносных сосудов, инфильтрация ткани лёгкого бластоцистами (рис. 4). В просвете кровеносных сосудов идентифицируется диффузно рассеянный пигмент и макрофаги с цитоплазмой, заполненной тёмным пигментом, альвеолы спавшиеся или некротизированы (рис. 4 а-е). В просвете кровеносных сосудов идентифицируются макрофаги с цитоплазмой, заполненной коричневым пигментом (рис. 4 а-н). Поражена как паренхима лёгких, так и эластическая хрящевая ткань внутрилёгочных бронхов. Во фрагментах хряща выявлен не только процесс апоптоза хрящевых клеток, но и очаги некроза (рис. 4 а, в, г). В паренхиме легкого бластоцисты располагаются в просвете расширенных альвеол (рис. 4 п, р, с), в просветах бронхов и лёгочных ходов.
 а
а  б
б
 в
в 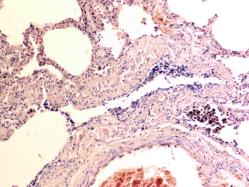 г
г
 д
д 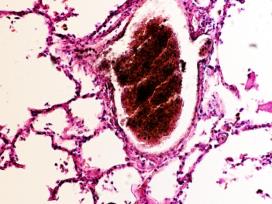 е
е
 ж
ж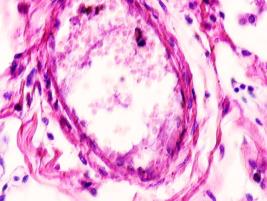 з
з
 к
к 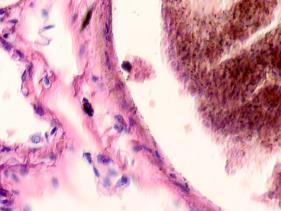 л
л
 м
м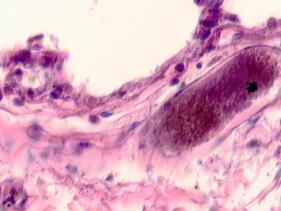 н
н
 п
п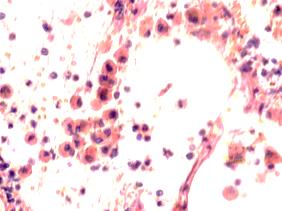 р
р
 с
с 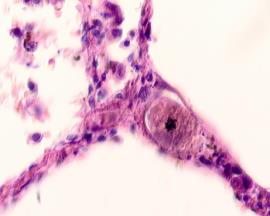 т
т
Рис. 4. Лёгкое Вич-инфицированного с гепатитом С 34 лет. А-н) гиперемия сосудов, дегенеративные процессы в фрагментах хряща в стенке бронхов; з, м, н) макрофаги с пигментом в цитоплазме; п , р, с) бластоцистная пневмония; с) макрофаги в области инфильтрации с трансферрином в цитоплазме; т) макрофаги в стенке альвеол с фагоцитированным трансферрином. Окраска г/э. Микрофото. Ув.х 200
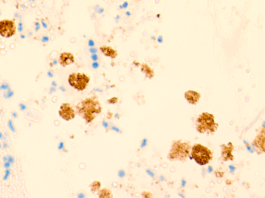
В просвете кровеносных сосудов идентифицируются макрофаги, цитоплазма которых заполнена трансферрином (рис. 5).
 а
а 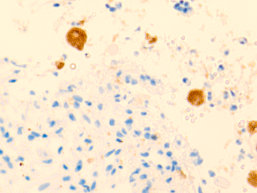 б
б
Рис. 5. Макрофаги с трансферрином в просвете выносящих сосудов печени больного гепатитом С на фоне ВИЧ-инфицирования. Микрофото. Окраска г/э. Ув.х400
Обсуждение результатов. Нами установлена идентичная морфологическая картина патологических изменений в печени, почке и лёгких больных при гепатите С и гепатите С на фоне ВИЧ-инфекции, связанная с разрушением гемоглобина, гемолизом эритроцитов и развившейся в связи с этим процессом клеточной аноксией. У части больных отмечены признаки острого гепатита С, характеризующиеся типичной картиной с вокруг дольковой инфильтрацией и зоны тетрад, но с сохранением структуры печёночных долек; у других пациентов выявлен переход острого гепатита в хронический, с признаками формирования ложных печёночных долек, расширением системы оттока желчи, апоптозом гепатоцитов, укладывающимся в рамки общих представлений о патогенетических изменениях структур.
Кроме уже известных и представленных многими авторами признаков патоморфологических изменений в органах, связанных с гиперемией паренхимы, апоптозом и дегенерацией, фиброзом и циррозом с локальными некротическими изменениями, лейкоцитарной инфильтрацией [23, 42], установлено общее для всех органов накопление коричневого пигмента в системе оттока крови. Гистологическое исследование почечных биоптатов обычно указывает на присутствие инфильтрации клубочков активированными макрофагами. При этом макрофаги нагружены пигментом чёрного цвета, морфологически соответствующего комплексу белка с железом – трансферрину. Гломерулярная базальная мембрана имеет двойные контуры, что способствует проникновению моноцитов между базальной мембраной и эндотелием. Мы предполагаем, что тёмный пигмент накопления в цитоплазме макрофагов соответствует трансферрину, продукту метаболизма гемолизированных эритроцитов и разрушенного гемоглобина. Это косвенно подтверждается многочисленными исследованиями, показавшими снижение уровня гемоглобина в периферической крови больных гепатитом С и ВИЧ инфицированных, но не объяснивших механизм анемии.
Методом иммунофлюоресценции выявлены субэндотелиальные депозиты IgM, IgG и компоненты комплемента. При электронной микроскопии видны большие субэндотелиальные депозиты. Васкулит малых почечных артерий присутствует в 30% случаев. Японская группа исследователей продемонстрировала осаждения ядерного антигена вируса гепатита С у больных с МПГН в клубочках [47].
По нашему мнению, патологический процесс в печени, лёгких и почке при заражении вирусом гепатита С начинается с гипоксии, обусловленной кислородным взрывом, необходимым для индукции фагоцитоза моноцитами возбудителей, а затем апоптических и некротизированных клеток вследствие аноксии, связанных с агрессивным разрушением эритроцитов и выходом гемоглобина в плазму кровеносных сосудов лёгких, печени и почки. При этом высвобождается трансферрин с последующим захватом его макрофагами. Вследствие невозможности передачи кислорода тканям, а также не выполнения второй функции гемоглобина – переноса углекислого газа, клетки органов вынужденно переходят на использование свободного растворённого в плазме кислорода. С поступлением гемоглобина в кровь, с учётом его высокой токсичности именно при интраваскулярном распаде и попадании в плазму крови, начинается массовая гибель клеток вследствие ишемии/аноксии и интоксикации. Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — нарастающим ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии при гибели гепатоцитов, а также закупоркой почечных канальцев крупными молекулами гемоглобина/трансферрина с развитием некроза почечных канальцев и острой почечной недостаточности.
Второе патогенетическое звено воздействия вируса гепатита С связано с тем, что стволовые клетки и ранние клетки-предшественницы эритропоэза в норме подчиняются близкодейстующей регуляции, обеспечиваемой их взаимодействием с соседними кроветворными клетками и клетками стромы красного костного мозга. Поздние клетки-предшественницы относятся к поэтинчувствительным и регулируются гуморальными факторами дистанционно. При этом пролиферация и дифференцировка стволовых и промежуточных клеток эритрона находятся под влиянием не только стромальных клеток, но и кроветворных клеток — ближайшего потомства стволовой клетки — и клеток лимфатической и макрофагальной природы.
Анемия, ассоциированная с неблагоприятным прогнозом, при хронической форме гепатита С, при ВИЧ-инфекции отмечена многими авторами [24, 33, 38, 40, 43, 44, 45]. Найденный в печени профактор эритропоэтина представлен эритрогенином, в совокупности с эритропоэтиногеном почки, вырабатываемыми пренатально, соответственно, клетками Купфера и подоцитами почки. У взрослого Купферовские клетки вновь начинают продуцировать эритропоэтин в условиях регенерирующей печени [Naughtonetal., 1979]. На фоне незначительной аноксии в кровь выбрасывается дополнительно небольшое количество эритропоэтина, концентрация которого достаточна лишь для стимуляции КОЕЭ. При тяжелой аноксии адаптивно выброс зритропоэтина должен быть увеличен, и его концентрации было бы достаточно для стимулирования уже и более ранних предшественников эритропоэза, что позволило бы увеличить конечную продукцию эритроцитов на 1—2 порядка. Но при ишемии альвеолярного эпителия, гепатоцитов и уротелия и, как следствие, их гибели, происходит снижение выработки всех составляющих эритропоэтина, нарушается механизм регуляции эритропоэза и регенерации, контроля за выведением метаболитов. Аноксия ведёт к снижению энергетических процессов клетки, апоптозу, некрозу и развитию цирроза в печени, гломерулонефриту. Можно предположить, что таков же механизм повреждения нейронов головного мозга при гепатите С, так как имеются данные об обнаружение вируса гепатита С в эндотелии кровеносных сосудов головного мозга. Повреждённые в результате ишемии клетки подвергаются апоптозу, вероятность их мутаций в раковые клетки невозможна. Дефект ткани заполняется стволовыми клетками крови, для дифференцировки которых в эффекторные для соответствия физиологическому запросу необходимо микроокружение, но оно апоптозировало и не выполняет необходимых функций. Сохраняется пролиферирующий бесконтрольно нерегулируемый пул клеток, частично, но не полностью дифференцирующийся, который и составляет пул раковых клеток. Подобного мнения придерживаются Speeckaert R., Colebunders B, Boelaert J Retal. (2011), предложившие патогенетические механизмы, связанные с гемоглобинопатией, для саркомы Капоши у ВИЧ-инфицированных [39]. На связь патогенетических механизмов нарушения метаболизма гемоглобина при туберкулёзе на фоне ВИЧ и гепатита С, с развитием цирроза печени и снижением фильтрационной функции почек, указали Puzzonale C., Vecchia M., Zona S., еt al., (2014), а также Minchella P.A., Doncor S., McDermid J.M., (2015) [29, 35].
Ключевым фактором в механизмах системного повреждения стенки кровеносных сосудов, в том числе участников гематотканевых барьеров, могут быть макрофаги с фагоцитированным трансферрином агрессивно разрушающие эндотелий для выхода в кровяное русло. Ключевые факторы патогенеза не связаны непосредственно с печенью, о чём свидетельствуют неэффективность трансплантации больным гепатитом С, в том числе и ВИЧ-инфицированным, донорской печени. При этом имеются данные о попытках применения эритропоэтина для профилактики развития цирроза и гломерулонефрита после трансплантации печени больным гепатитом С [40]. Эти факторы патогенетического механизма развития патологии в печени и внепечёночных проявлений необходимо учитывать не только при пересадке печени и почек нуждающимся в трансплантации больным гепатитом С и ВИЧ-инфицированным, но и использовать для профилактики развития молниеносной формы гепатита С, ведущей к летальному исходу, раку печени, а также перехода острой формы гепатита в хроническую и цирроз. Регулярные измерения гемоглобина крови больных гепатитом, особенно ВИЧ-инфицированных, могли бы помочь определить, какие ВИЧ-пациенты подвергаются наибольшему риску прогрессирования заболевания для проведения терапевтического вмешательства.
Особенно высок риск для развития таких процессов, как цирроз печени, гломерулонефрит и канцерогенез у больных гепатитом С и ВИЧ-инфицированных при отсутствии патогенетически обоснованного лечения и понимания механизмов патогенеза, что и приводит к нежелательным осложнениям.
Таким образом, существует необходимость разработки рандомизированных исследований высокого методологического качества для оценки стратегических воздействий на анемию у лиц, инфицированных вирусом гепатита С и иммунодефицита человека.
Исследование выполнено при поддержке научного фонда ДВФУ, в рамках государственного задания 2014/36 от 03.02.2014 г. и Международного гранта ДВФУ (соглашение № 13-09-0602-м от 6 ноября 2013 г.)
Рецензенты:
Храмова И.А., д.м.н., профессор, врач акушер-гинеколог, Приморский краевой диагностический центр, г. Владивосток;
Шульгина Л.В., д.б.н., профессор, заведующая лабораторией микробиологии ФГУП "ТИНРО-Центр", г. Владивосток.



