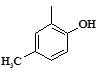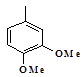По данным Всемирной организации здравоохранения, сердечно-сосудистые заболевания (ССЗ) являются основными причинами преждевременной смертности, ранней инвалидизации и снижения качества жизни людей, особенно в условиях современного общества (стресс, экологические факторы и т.д.) [5]. На сегодняшний день установлено, что практически все сердечно-сосудистые, эндокринные аутоиммунные и др. заболевания сопряжены с эндотелиальной дисфункцией (ЭД) [4], которая является неблагоприятным прогностическим фактором в развитии сердечно-сосудистых осложнений [7]. В этой связи эндотелий сосудов становится самостоятельной мишенью терапевтического воздействия.
Известно, что в регуляции специфических функций эндотелия: противовоспалительной, вазодилатационной, антитромботической и антипролиферативной, участвует универсальный модулятор - эндогенный оксид азота [2; 3; 10]. Ключевую роль в выработке оксида азота выполняет эндотелиальная NO-синтаза (eNOS), в регуляции которой важную роль отводят эстрогеновым стероидным гормонам [8].
Таким образом, актуальным становится вопрос коррекции ЭД и сердечно-сосудистых заболеваний, в том числе тех, которые ассоциированы с недостаточностью эстрогеновых половых гормонов (НПГ). Многие факторы влияют на активность NOS и, учитывая значительную роль в регуляции активности NOS протеинкиназы С [9], можно предположить, что фармакологическое воздействие на этот вид ферментов представляет собой большой научно-практический интерес.
Протеинкиназы представляют собой ферменты, осуществляющие перенос фосфатной группы от нуклеозид трифосфата на остатки таких аминокислот, как серин, треонин и тирозин. Фосфорилирование белка приводит к активации путей сигнальной трансдукции, а изменение активности протеинкиназ нарушает этот процесс, который связан с развитием большого числа болезней, включающих и сердечно-сосудистые заболевания [6].
Таким образом, поиск соединений, обладающих выраженным влиянием на активность протеинкиназы С, является перспективным направлением в создании препаратов для терапии сердечно-сосудистых патологий.
Цель исследования: молекулярное конструирование и изучение влияния прогнозируемых соединений на вазодилатирующую функцию эндотелия при недостаточности половых гормонов.
Материалы и методы
Исследуемые вещества представляют собой 2-стирилзамещенные производные 4-оксопиримидина, синтезированные на кафедре органической химии ПМФИ филиала ВолгГМУ. Вероятность проявления различных видов биологической активности определена с помощью программы PASS, обновленная версия которой (Version 2006-09-28) позволяет прогнозировать не только фармакологические свойства моделируемых соединений, но и возможные молекулярные механизмы их действия.
Дальнейшее выявление эндотелиопротекторной активности у прогнозируемых соединений основано на их тропности к активным центрам ПКС, выявленной с помощью моделирования молекулярной динамики системы лиганд-фермент. В качестве макромолекулы-мишени была использована модель фермента протеинкиназы-C-η, полученная методом рентгеноструктурного анализа. Моделирование молекулярной динамики осуществлялось в области сайта связывания АТФ в субъединице С3. Трехмерные модели молекул лигандов были построены с помощью программы HyperChem 8.0. Оптимизация геометрии молекул лигандов осуществлялась с использованием метода ab initio (UHF/3-21G*). Далее заряды рассчитывались методом ab initio DFT (B3LYP/6-31G(d,p)). Моделирование 196 нс времени системы «лиганд-фермент» в водном окружении осуществлялось при температуре 300 К в программе «Биоэврика».
Фармакологический эксперимент проводился на 66 крысах-самках, рандомизированных по массе (230-270 г) и возрасту (половозрелые – 4 месяца). Животные были разделены на 6 групп. Первая группа - ложнооперированные самки (14 крыс), 2-я группа - самки с моделью НПГ (12 крыс). Препарат сравнения Вессел Дуо Ф (сулодексид) вводили 3-й группе животных. Исследуемые вещества вводили 4-й группе (в-во № 1, 10 крыс), 5-й группе (в-во № 2, 10 крыс) и 6-й группе животных (в-во № 3, 10 крыс) (табл. 1). Для моделирования НПГ у самок осуществлялась экстерпация матки с придатками под наркозом (хлоралгидрат, 350 мг/кг).
Исследуемые вещества вводили внутрибрюшинно в виде эмульсии (дистиллированная вода и твин) в дозе 50 мкг/кг (доза основана на ЛД50) на 7-й день после экстерпации матки. Группам № 1 и № 2 вводили раствор твина в дистиллированной воде. Группе № 6 сулодексид (Весел Дуэ Ф) (Аlfa Wassermann, Италия) вводился в дозе 30 ЕВЛ (единицы высвобождения липопротеинлипазы). Все вещества вводили в течение 3 недель.
На четвертой неделе, т.е. через месяц от начала эксперимента, измеряли скорость церебрального кровотока (СК) в теменной области головного мозга крыс. Для этого осуществляли вскрытие черепной коробки с помощью бормашины, периодически охлаждая поверхность с помощью физиологического раствора. Регистрацию кровотока осуществляли с помощью ультразвукового доплерографа, датчика УЗОП-010-01 с рабочей частотой 25 МГц и рабочей компьютерной программы ММ-Д-К-Minimax Doppler v.1.7. (Санкт-Петербург, Россия). Для оценки функционального состояния эндотелия сосудистого русла СМА осуществлялось стимулирование выброса эндогенного оксида азота с помощью анализатора - ацетилхолина (АХ (sigma, США)), в дозе 0,1 мг/кг [4].
Результаты опытов обрабатывали методом вариационной статистики. Вычисляли среднее значение и стандартную ошибку среднего значения. Полученные данные проверяли на нормальность распределения с использованием критерия Колмогорова-Смирнова. В случае нормального распределения данных использовали параметрический t-критерий Стьюдента. При ненормальном распределении результатов эксперимента дальнейшую статистическую обработку данных проводили с использованием U-критерия Манна-Уитни.
Результаты и их обсуждение
Предварительный анализ фармакологических свойств виртуальных структур программой PASS не является основополагающим и имеет лишь прогностическое значение для сужения круга соединений, для последующего молекулярного конструирования.
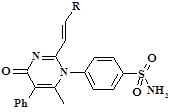
Таблица 1
Прогноз биологической активности 2-стирилпроизводных 4-(2,6-диметил-4-оксо-5-фенил-4H-пиримидин-1-ил)-бензсульфамида
|
Вид биологической активности |
Заместитель |
Соединение |
||
|
№ 1 |
№ 2 |
№ 3 |
||
|
R |
|
|
|
|
|
Pa характеризует вероятность проявления активности |
||||
|
Агонист D4-рецептора |
0,88 |
0,83 |
0,82 |
|
|
Ингибитор ЦОГ |
0,74 |
0,67 |
0,72 |
|
|
Мембраностабилизирующая |
0,64 |
0,60 |
0,69 |
|
|
Нейропротекторная |
0,56 |
0,50 |
0,56 |
|
|
Антагонист простагландина |
0,47 |
0,37 |
0,45 |
|
|
Ингибитор нитрат редуктаз |
0,41 |
0,41 |
0,39 |
|
Исходя из данных, приведенных в таблице 1, видно, что все соединения ряда 2-винилензамещенных производных 6-метил-4-оксо-5-фенилпиримидина с фрагментом п-аминобензсульфамида в положении № 1 могут обладать широким спектром фармакологических свойств. Наиболее характерными для большинства структур являются возможное влияние на дофаминергическую систему, ингибирование ЦОГ и нитрат редуктаз, а также проявление мембраностабилизирующей активности.
С целью повышения достоверности молекулярного конструирования структур, влияющих на активность протеинкиназ, осуществлен молекулярный докинг лиганд-биологическая мишень.
Результаты молекулярного докинга наиболее перспективных БАС показывают, что связывание лигандов с активным центром происходит различными способами. Одна из конформаций соединения № 1 в активном центре протеинкиназы C, полученная путем моделирования молекулярной динамики, приведена на рисунке 1.
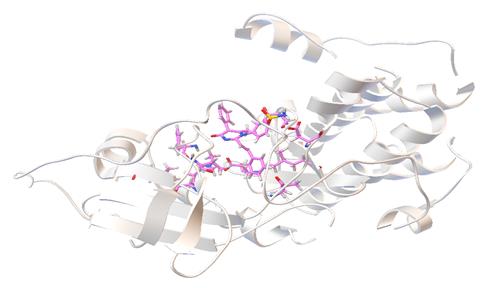
Рис. 1. Расположение вещества № 1 в активном центре протеинкиназы C-η.
По результатам анализа молекулярных траекторий оценивалась средняя длительность связывания лигандов с аминокислотами активного центра протеинкиназы-C-η (табл. 1).
Таблица 2
Результаты моделирования молекулярной динамики лиганд-ферментного взаимодействия для исследуемых веществ
|
Вещество |
Длительность связывания, нс |
|
№ 1 |
0,576 |
|
№ 2 |
0,416 |
|
№ 3 |
0,416 |
Данные, приведенные в таблице 2, свидетельствуют о возможности проникновения в сайт связывания в центре протеинкиназы C-η всех исследуемых соединений. При этом наибольшим временем удерживания характеризуются соединения № 1.
На основании результатов прогноза фармакологической активности БАС можно предположить, что соединение № 1 будет проявлять выраженную эндотелиопротекторную активность.
Таблица 3
Изменение скорости кровотока при введении АХ различным группам животных
|
Группа |
Исх. Кровоток, см/с |
АХ, см/с |
% изменения |
|
1. ЛО |
4,23+0,15
|
6,01+0,22 |
42,99+4,81 |
|
2. НПГ |
2,61+0,08 |
3,29+0,11 |
26,11+0,77* |
|
3. НПГ+Сулодексид |
4,5+0,27 |
6,01+0,38 |
33,72+3,06**,# |
|
4. НПГ+В-Во № 1 |
4,22+0,2 |
5,6+0,25 |
33,05+2,91**,# |
|
5. НПГ+В-во № 2 |
3,14+0,28 |
3,95+0,34 |
25,66+1,25*, α |
|
6. НПГ+В-во № 3 |
2,95+0,29 |
3,69+0,35 |
25,58+1,25*, α |
* - P≤0,01; ** - P≤0,05, достоверно по отношению к аналогичному показателю ЛО – группы животных;
# - P≤0,05, достоверно по отношению к аналогичному показателю НПГ- группы крыс;
α - P≤0,05, достоверно по отношению к аналогичному показателю 6 группы крыс (НПГ+Сулодексид).
В группе № 1 у ЛО-животных исходная линейная средняя систолическая скорость кровотока (СК) составляла 4,23+0,15 см/с. Введение специфичного стимулятора выброса вазодилатирующих веществ эндотелием (основным из которых является оксид азота) АХ приводило к увеличению СК до 6,01+0,22 см/м, что превышает исходные показатели на 42,99+4,81%. Такой ответ на введение АХ характерен для интактных животных и согласуется с литературными данными [4].
В группе № 2 у животных с НПГ исходная СК составляла 2,61+0,08 см/с, а введение АХ приводило к увеличению кровотока до 3,29+0,11 см/с, т.е. на 26,11+0,77%, что в 1,65 раза достоверно ниже такового прироста у ЛО-группы. Т.о., у животных с НПГ недостаток эстрогенов может приводить к нарушению вазодилатирующей функции эндотелия [8], выраженной в снижении СК в ответ на введение АХ [1; 4], что, вероятнее всего, связано с уменьшенным выбросом эндотелием сосудорасширяющих веществ (в том числе и оксида азота).
В группе № 3 животным с НПГ, которым вводили препарат сравнения – Весел Дуо Ф, исходная СК составляла 4,5+0,27 см/с, а кровоток, стимулированный введением АХ, составлял 6,01+0,38 см/с, т.е. на 33,72+3,06% превышающий исходные показатели. Прирост кровотока в ответ на введение АХ у животных, которым вводили Вессел Дуо Ф, достоверно выше в 1,3 раза, чем у негативного контроля (группа № 2), что может говорить об эндотелиопротекторной активности препарата, выраженной в улучшении эндотелиозависимой вазодилатации при стимулировании выброса сосудорасширяющих веществ с помощью АХ [4].
В группе № 4 животным с НПГ, которым вводили исследуемое вещество № 1, при введении АХ кровоток увеличивался на 33,05+2,91%, что в 1,3 раза достоверно выше, чем у крыс группы № 2. Причем прирост кровотока близок к показателям группы № 3 (т.е. с препаратом сравнения). Улучшение способности сосудов к эндотелий-зависимому расширению, выраженному в увеличении СК, стимулированной АХ, может говорить о наличии эндотелиотропной активности вещества № 1.
В группах № 5 и № 6 животным с НПГ, которым вводили вещества № 2 и № 3, соответственно, прирост кровотока в ответ на введение АХ достоверно не отличался от группы негативного контроля, что может говорить об отсутствии или наличии слабой эндотелиопротекторной активности данных соединений.
Выводы
В результате проведенных исследований можно сделать следующие выводы.
1. Недостаточность половых гормонов может приводить к эндотелиальной дисфункции, выраженной в изменении вазодилатирующей функции эндотелия, проявляющейся в снижении кровотока при введении АХ в 1,7 раза, по сравнению с ложнооперированной группой.
2. Вессел Дуо Ф, как препарат сравнения, обладает эндотелиопротекторной активностью, выраженной в увеличении скорости кровотока при введении АХ в 1,3 раза, по сравнению с группой негативного контроля.
3. Исследуемое вещество № 1 приводит к улучшению эндотелиальной функции, выраженной в увеличении СК, стимулированной АХ, аналогично препарату сравнения (в 1,3 раза), что может указывать на наличие выраженной эндотелиотропной активности у данного соединения.
4. Результаты фармакологических исследований в значительной мере подтвердили обоснованность результатов молекулярного конструирования.
Рецензенты:
Черников М.В. д.м.н., профессор, зав. кафедрой биологии и физиологии ГБОУ ВПО «Пятигорский медико-фармацевтический институт - филиал Волгоградского государственного медицинского университета», г. Волгоград;
Погорелый В.Е. д.б.н., профессор кафедры фармакологии с курсом клинической фармакологии ГБОУ ВПО «Пятигорский медико-фармацевтический институт - филиал Волгоградского государственного медицинского университета», г. Волгоград.