В настоящее время рак шейки матки в большинстве стран мира продолжает оставаться наиболее частой злокачественной опухолью женских половых органов. Одним из направлений в химиотерапии первично выявленного местно-распространенного рака шейки матки (МРРШМ) является применение ее в качестве неоадъювантной. Методы терапии сопровождения также нашли применение в комплексном лечении онкологических больных. Среди них особое место занимают эфферентные методы и применение иммуномодуляторов.
По мнению немецких исследователей, лекарственный плазмаферез (ПА) способен повысить эффективность лечения за счет снижения резистентности к химиопрепаратам, неизбежно развивающейся в процессе лечения, особенно в условиях раковой интоксикации [8]. В исследованиях, проведенных в Ростовском научно-исследовательском онкологическом институте, доказано, что проведение ПА перед неоадъювантной полихимиотерапией (ПХТ) у больных распространенным раком яичников способствует нормализации или существенному улучшению состояния общей реактивности организма, обеспечивая компенсацию эндогенной интоксикации и позволяя сохранять дозовую интенсивность ПХТ у больных с высоким риском развития осложнений [4, 6]. Исследована и проанализирована переходная динамика реагирования организма на детоксикационные, цитостатические и иммуномодулирующие воздействия при проведении неоадъювантной химиотерапии больным МРРШМ IB-IIIB стадий. Выявлено, что включение в программу лечения плазмафереза и иммуномодуляции обеспечивает синергизм и пролонгирование активности механизмов антистрессорной защиты, а также повышение противоопухолевой сопротивляемости организма больной [7].
Препараты интерферонов давно известны и применяются в онкологии как самостоятельно, так и в качестве терапии сопровождения. В настоящее время привлекает все больший интерес возможность эффективного использования индукторов интерферонов, особенно при заболеваниях с доказанной вирусной этиологией. Авторы исходят из того, что своевременная санация очагов папилломавирусной инфекции может приводить к снижению заболеваемости онкологической патологией, в частности, при поражении шейки матки и слизистой гортани [2]. Представляет несомненный интерес оценка эффективности подобных препаратов при их включении в комплексное лечение рака шейки матки. Подходы, объединяющие химиотерапию, детоксикацию и иммуномодуляцию могут оказаться плодотворными для лечения данной патологии.
Целью данной работы является оценка иммунного статуса у больных раком шейки матки в динамике неоадъювантной ПХТ, включающей использование плазмафереза (ПА) и иммуномодулятора аллокина-альфа (АА).
Материалы и методы
Под наблюдением находились 72 больных РШМ T1b2-2bN0-1M0 стадий в возрасте от 25 до 48 лет, проходивших лечение в отделении онкогинекологии Ростовского научно-исследовательского института онкологии в период с 2009 по 2015 год. Первым этапом лечения у всех пациенток применялась неоадъювантная ПХТ по схеме: цисплатин (75мг/м2в 1 день введения) и блеомицетин (20 мг/м2в 1 и в 5 дни химиотерапии). Пациентки были разделены на 2 группы в зависимости от модификации инициального лечения: I (контрольную) группу составили 19 больных, получавших стандартную внутривенную ПХТ; II (основную) группу составили 48 больных, разделенных на 2 подгруппы: 22 больным проведен сеанс гравитационного ПА, через сутки после которого начинали курс неоадъювантной ПХТ; 26 больным проведен сеанс гравитационного ПА, через сутки после которого начинали курс цитостатической терапии. На следующий день после окончания первого курса химиотерапии начинали курс иммуномодуляции препаратом «Аллокин-альфа» (6 инъекций препарата подкожно через день в суммарной дозе 6 мг).
Оценку иммунного статуса проводили в следующей динамике: до начала лечения, после ПА+ПХТ, через 3 недели после начала лечения; у больных, получавших АА, дополнительно через 6 недель после начала лечения. Кровь брали из локтевой вены в пробирку с антикоагулянтом (ЭДТА), в ней определяли популяционный и субпопуляционный состав лимфоцитов на проточномцитометре FACSCantoII (BD) с панелью моноклональных антител T-, B-, NK (CD45, CD3, CD4, CD8, CD19, CD16/56); дополнительно изучали количественное содержание активированных Т-лимфоцитов обеих основных субпопуляций, экспрессирующих маркеры ранней (CD38) и поздней (HLA-DR) активации, а также Т-регуляторных (T-regs) клеток (CD4+CD25+CD127dim). Результаты выражали в процентах от общего количества лимфоцитов, для T-regs в процентах от CD3+CD4+ клеток, для активированных – в процентах от CD3+CD4+ и CD3+CD8+ клеток. Рассчитывали также абсолютные значения показателей клеточного иммунитета.
Содержание цитокинов TNF-α, IL-1ß, IL-2, IL-6, IL-8, IL-10 в сыворотках определяли методом ИФА с тест-системами производства «Вектор-Бест» (Новосибирск), результаты выражали в пг/мл.
Статистическую обработку данных выполняли с помощью параметрических и непараметрических методов (t-критерий Стьюдента, критерий Уилкоксона, метод непрямых разностей).
Результаты и их обсуждение
Результаты представлены в табл. 1–2 и на рис. 1–4.
Таблица 1
Динамика некоторых показателей иммунного статуса у больных РШМ, получавших стандартную ПХТ(n=19)
|
Сроки исследования |
Показатели (%) |
||||||||||||
|
Лимфоциты |
CD3+ |
CD3+CD4+ |
CD3+CD8+ |
CD19+ |
CD16/56+ |
CD3+CD38+ |
CD4+ CD38+ |
CD8+ CD38+ |
CD3+ HLA DR+ |
CD4+ HLA DR+ |
CD8+HLA DR+ |
T-reg |
|
|
Доначалалечения
|
25,7 ±1,72 |
76,2 ±1,67 |
47,2 ±1,91 |
24,9 ±2,1 |
11 ±0,82 |
11,96 ±1,28 |
20,9 ±2,09 |
24,8 ±2,32 |
11,16 ±1,55 |
11,08 ±1,72 |
8,14 ±1,2 |
15,74 ±2,23 |
7,1 ±0,56 |
|
После 1-й ПХТ
|
12,27 ±1,24* |
68,76±1,65* |
39,2 ±1,81 |
25,3 ±2,22 |
14,33 ±1,01 |
16,04 ±1,6 |
17,11 ±2,11 |
20,04 ±2,27 |
10,00 ±1,72 |
11,64 ±1,73 |
8,81 ±1,08 |
16 ±2,33 |
7,44 ±0,36 |
|
3 нед. после начала лечения |
26,56 ±0,25 ** |
77,2 ±1,96** |
47,1 ±2,27 |
25,96 ±2,27 |
8,76 ±0,61* |
12,86 ±1,6 |
30,45 ±3,23* ** |
31,36 ±2,51* ** |
24,5 ±4,35* ** |
15,1 ±3,91 |
12,1 ±4,02 |
20,78 ±3,95 |
8,89 ±0,96 |
Примечание. * – статистически достоверные отличия от исходного показателя; ** – статистически достоверные отличия от срока после 1-й ПХТ (р<0,05).
Таблица 2
Динамика некоторых показателей иммунного статуса у больных РШМ, получавших ПА + ПХТ + аллокин-a(n=26)
|
Сроки исследования |
Показатели (%) |
||||||||||||
|
Лимфоциты |
CD3+ |
CD3+CD4+ |
CD3+CD8+ |
CD19+ |
CD16/56+ |
CD3+CD38+ |
CD4+CD38+ |
CD8+ CD38+ |
CD3+HLA DR+
|
CD4+ HLA DR+
|
CD8+HLA DR+ |
T-reg |
|
|
До начала лечения
|
27,0 ±1,86 |
76,6 ±1,39 |
45,7 ±1,93 |
26,21 ±1,86 |
10,68 ±0,81 |
11,66 ±1,12 |
24,17 ±2,77 |
27,37 ±2,77 |
17,2 ±3,78 |
14,28 ±2,03 |
8,53 ±1,48 |
17,8 ±2,87 |
6,54 ±0,99 |
|
После ПА+ ПХТ
|
16,01 ±2,0* |
72,35 ±0,2* |
40,54 ±1,97 |
26,6 ±2,19 |
12,84 ±1,4 |
13,95 ±1,76 |
20,98 ±2,48 |
23,84 ±2,45 |
13,95 ±2,38 |
10,76 ±1,47 |
7,17 ±0,89 |
14,2 ±2,02 |
6,4 ±0,71 |
|
3 нед. после начала лечения |
27,06 ±1,64** |
78,65 ±1,49** |
47,24 ±2,18 |
25,8 ±1,84 |
9,41 ±0,86 |
10,9 ±1,29 |
24,8 ±2,93 |
28,24 ±2,91 |
17,25 ±2,78 |
12,1 ±1,4 |
7,37 ±0,84 |
17,37 ±2,16 |
7,5 ±0,85 |
|
6 нед. после начала лечения |
27,45 ±3,13 |
78,5 ±2,24 |
47,9 ±2,67 |
25,73±2,65 |
7,35 ±0,67* |
13,1 ±2,01 |
30,1 ±4,68 |
32,9 ±4,78 |
21,19 ±3,61 |
11,42 ±1,52 |
8,78 ±1,69 |
17,9 ±2,36 |
6,34 ±0,47 |
Примечание. * – статистически достоверные отличия от исходного показателя; ** – статистически достоверные отличия от срока ПА+ПХТ (р<0,05).
При анализе динамики показателей клеточного иммунитета у больных сравниваемых групп выявлен ряд общих тенденций и ряд различий, представленных в табл. 1 и 2.
Общими для них иммунологическими изменениями являются транзиторное снижение количества лимфоцитов и зрелых Т-лимфоцитов (CD3+) после 1-го курса ПХТ с последующим восстановлением до исходного уровня, а также статистически достоверное снижение процентного и абсолютного содержания В-лимфоцитов.
У больных контрольной группы через 3 недели после проведения курса ПХТ отмечено статистически значимое повышение процента Т-клеток с маркером ранней активации CD38+, относящихся к обеим субпопуляциям (CD3+CD4+ и CD3+CD8+) (табл. 1, рис. 1); при этом экспрессия маркера поздней активации (HLA-DR) не меняется. При вычислении исследуемых показателей в абсолютных значениях у больных данной группы также определяется транзиторное снижение ряда показателей (лимфоцитов, CD3+, CD3+CD4+, CD38+, HLA-DR+ T-клеток, T-reg) с последующим восстановлением до исходного уровня; одновременно отмечается снижение абсолютного уровня В-лимфоцитов (с 0,25±0,04 до (0,14±0,01)х109/л) (р<0,05).
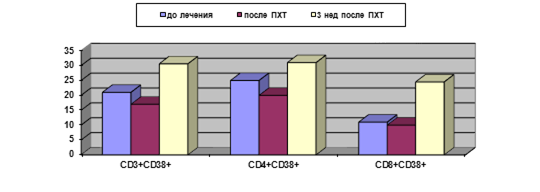
Рис. 1. Уровень активированных T-лимфоцитов у больных РШМ в динамике проведения ПХТ (%)
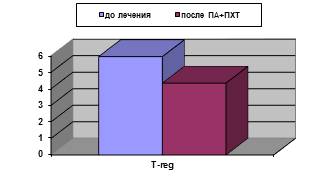
У больных, получавших ПА+ПХТ, по завершении неаодъювантного этапа лечения не наблюдалось статистически значимых изменений исследованных параметров иммунного статуса, вычисленных в процентах, кроме снижения уровня T-regс 5,95±0,65 до 4,35±0,15% (р<0,05), (рис. 2А). Абсолютные значения демонстрировали снижение содержания уровня лимфоцитов (с 2,15±0,23 до (1,53±0,13)х109/л), CD3+ (с 1,5±0,1 до (1,1±0,11)х109/л), CD3+CD8+ (с 0,46±0,05 до (0,33±0,04)х109/л), а снижение количества T-reg оказалось двукратным: с 0,12±0,001 до (0,065±0,02)х109/л (рис. 2Б). Для данных параметров различия статистически достоверны (р<0,05).
 А
А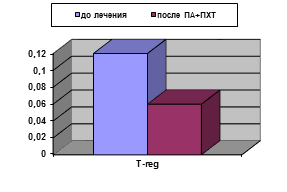 Б
Б
Рис. 2. Уровень T-reg у больных РШМ до и после проведения ПА+ПХТ: А - %; Б - х109/л
Как видно из табл. 2, у больных, получавших ПА+ПХТ+АА, при вычислении в относительных значениях не выявлено статистически достоверных отличий от исходных показателей, кроме временного снижения уровней лимфоцитов и Т-клеток. В финале неоадъювантного лечения у них регистрировалось снижение абсолютных показателей содержания CD19+ (с 0,2±0,01 до (0,12±0,03)х109/л), CD3+CD8+ (0,48±0,03 до (0,31±0,05)х109/л), и CD3+HLA-DR+ (с 0,30±0,0 до (0,14±0,02)х109/л) клеток (во всех случаях р<0,05).
При сравнении исследованных параметров больных различных групп после завершения неоадъювантного курса ПХТ наблюдался статистически достоверно более низкий уровень Т-reg у больных обеих подгрупп основной группы по сравнению с контрольной (6,34±0,47 и 4,35±0,15 против 8,89±0,96 % в контрольной группе; р<0,05). Кроме того, выявлены статистически достоверно более низкие уровни CD3+ клеток у больных, получавших ПА без АА, по сравнению как с контролем, так и с подгруппой, получавшей его, которые составили 72,1±2,22 % после проведения ПА+ПХТ, 78,5±2,24 % после дополнительного применения АА и 77,2±1,96 % в контрольной группе. Остальные изученные показатели, вычисленные в процентах, не имели различий.
При сопоставлении абсолютных уровней исследованных параметров по окончании лечения общее количество Т-лимфоцитов, экспрессирующих маркер поздней активации (CD3+HLA-DR+), оказалось выше после применения ПА+ПХТ, чем при дополнительном использовании АА (0,24±0,02 против (0,14±0,02)х109/л), однако, уровень активированных цитотоксических Т-клеток CD8+HLA-DR+, напротив, был выше в подгруппе больных, получавших АА (0,27±0,05 и (0,15±0,01)х109/л соответственно, р<0,05). Последнее позволяет предположить активацию цитотоксического звена иммунной системы, важного для реализации противоопухолевого ответа, под действием аллокина-альфа. Возможно, такие изменения являются компенсаторными, поскольку развиваются на фоне снижения общего количества CD3+CD8+ клеток.
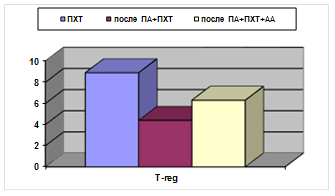
В обеих подгруппах основной группы отмечены более низкие абсолютные уровни Т-reg(0,12±0,01 в контроле, 0,06±0,02 после применения ПА+ПХТ; 0,09±0,01 после применения ПА+ПХТ+АА; р<0,05) (рис. 3).
 А
А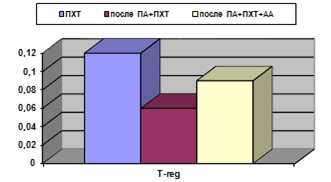 Б
Б
Рис. 3. Процентное и абсолютное содержание Т-reg клеток у больных РШМ после различных видов лечения. А - %; Б - х109/л
Результаты изучения сывороточных уровней цитокинов у больных сравниваемых групп представлены на рис. 4, из которого виден ряд различий между ними.
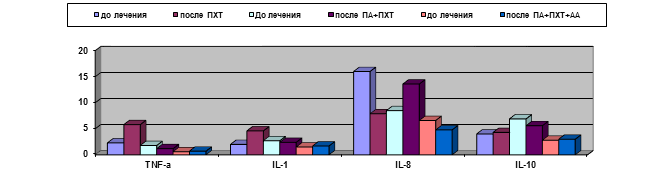
Рис. 4. Динамика уровней некоторых цитокинов у больных РШМ при различных методах лечения (пг/мл)
Так, уровень IL-8 нарастал в подгруппе, получавшей ПА+ПХТ, с 8,5±1,7 до 13,6±3,2 пг/мл и, напротив, снижался при дополнительном применении АА и в контрольной группе. При этом если в контрольной группе его снижение происходило с 16,1±5,5 до 7,9±1,5 пг/мл, то снижение после лечения с использованием ПА и АА наблюдалось с исходно более низких цифр (с 6,6±1,9 до 4,8±1,7 пг/мл) и в финале оказывалось статистически достоверно ниже, чем после применения ПА, а также в контроле (р<0,05). В контрольной группе отмечено нарастание уровней провоспалительных цитокинов IL-1ß и TNF-α, которые по завершении неаодъювантного этапа лечения оказывались выше, чем у больных обеих подгрупп основной группы. Содержание IL-10, обладающего иммуносупрессивными свойствами и нарастающего при неблагоприятном течении злокачественных опухолей, было минимальным у больных, получавших ПА+ПХТ+АА (2,9±0,26 пг/мл против 5,6±1,3 в подгруппе с ПА+ПХТ и 4,3±0,4 в контрольной группе; р<0,05).
Итак, изучение влияния проведения химиотерапии, модифицированной эфферентными методами и иммуномодулятором аллокином-альфа, на иммунный статус больных РШМ показало во многом сходную динамику, которая, однако, представляется более благоприятной у больных обеих основных групп по сравнению с контролем. Как при применении ПА, так и при дополнительном использовании препарата аллокина-альфа, обнаружено существенное снижение Т-regклеток, считающихся иммуносупрессивными и проонкогенными [9]. Снижение содержание этих клеток и их продуктов в динамике лечения описано как прогностически благоприятный фактор при злокачественных опухолях [10] и хронической ВПЧ-инфекции [1]. Кроме того, обращает на себя внимание повышение уровня активированных Т-лимфоцитов с мембранным рецептором CD38 у больных контрольной группы после лечения, в отличие от обеих основных групп, хотя при финальном исследовании статистически значимых различий между ними и не найдено. В литературе есть данные о высоком уровне растворимого рецептора CD38 при некоторых онкологических заболеваниях, который рассматривается как механизм, ограничивающий межклеточные взаимодействия и способствующий ускользанию опухоли от иммунного надзора [5]. Развитие неопластического процесса сопровождается повышением его уровня, а эффективное лечение – снижением. Поскольку количество растворимого рецептора CD38 коррелирует с содержанием CD38+ клеток, являющихся его источником, повышение последнего также расценивается как неблагоприятный прогностический фактор. Обнаруженное нами повышение процентного и абсолютного содержания лимфоцитов, экспрессирующих этот маркер, у больных контрольной группы может отражать менее благоприятный прогноз после проведения стандартной ПХТ по сравнению с ПХТ в сопровождении ПА и иммуномодуляцией аллокином-альфа. Однако для решения данного вопроса необходимы дальнейшие исследования.
Динамика сывороточного содержания цитокинов у больных различных групп свидетельствует о минимальном воспалительном и неопластическом компоненте у больных, получавших ПА+ПХТ+АА по сравнению с больными других групп.
Заключение
Таким образом, мы расцениваем полученные при применении в курсе химиотерапии ПА и аллокина-альфа иммунологические данные как прогностически благоприятные и отражающие клиническую динамику больных раком шейки матки [3]. Представляется целесообразным включение эфферентных методов и иммуномодуляции индуктором интерферона в комплексное лечение больных раком шейки матки.
Исследование выполнено при поддержке гранта Президента Российской Федерации МК-4427.2014.7 «Новые технологии молекулярной детоксикации и клеточной иммунотерапии в комплексе персонализированного лечения и реабилитации больных при злокачественных опухолях гениталий».
Рецензенты:
Каймакчи О.Ю., д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону;
Николаева Н.В., д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону.



