Проблемы злокачественных новообразований сохраняют высокую актуальность, несмотря на значительные успехи, достигнутые при их изучении биомедицинскими науками, активно использующими с началом XXI в. протеомные и другие так называемые постгеномные технологии. Особое внимание при этом уделяется рабдомиосаркомам, которые известны как типичные для детского возраста злокачественные опухоли с высокими способностями к инвазии и метастазированию [5, 8]. В ряде исследований было показано, что рабдомиосаркомы обычно представлены весьма гетерогенной клеточной популяцией, в которой содержатся клетки, находящиеся на разных стадиях миогенной дифференцировки: от малых по размерам одноядерных клеток (рабдомиобластов) до крупных многоядерных образований, похожих на нормальные миотубы [например, 5]. На основании гистологических и некоторых биохимических характеристик среди рабдомиосарком выделяют альвеолярные, эмбриональные, плеоморфные, а иногда и другие подгруппы [5, 3 и др.]. Как следствие из-за высокой гетерогенности рабомиосаркомных опухолей для их исследований уже несколько десятилетий используют специально выведенные культивируемые линии клеток рабдомиосаркомы человека, в частности линию RD, которую рассматривают как одну из моделей рабдомиосарком [по 5, 7]. Недавно на подобных моделях удалось получить ряд новых данных о молекулярных нарушениях, обусловленных злокачественной трансформацией [7, 8]. Однако протеомные технологии, которые представляются весьма эффективными инструментами для изучения молекулярных нарушений в злокачественных клетках, в отношении клеток рабдомиосарком использовались пока лишь в единичных работах [6].
Цель исследования заключалась в протеомном изучении белков культивируемых клеток линии RD, моделирующих рабдомиосаркому, с поиском потенциальных белковых биомаркеров.
Материал и методы исследования
Основным материалом послужили культивируемые клетки рабдомиосаркомы линии RD (каталожный номер ATC-CLL-136), закупленной из клеточной коллекции Института вирусологии им. Д.И. Ивановского РАМН (Москва). В работе использовались также клетки нескольких линий мезенхимального происхождения, в частности SK-UT-1B (ATCC-HTB-115, лейомиосаркома), U-2 OS (ATCC-HTB-96, остеосаркома) и SC5-MSC (неиммортализованные мезенхимальные эмбриональные стволовые клетки), которые были приобретены в Институте цитологии РАН (Санкт-Петербург). Параллельно исследовали нормальные культивируемые миобласты человека, полученные как описано ранее [2].
Клеточные линии RD и SC5-MSC культивировали в среде DMEM с добавлением гентамицина и 10% эмбриональной телячьей сыворотки (ЭТС), клетки U-2-OS — в среде RPMI-1640 с добавлением гентамицина, L-глутамина и 10% ЭТС, клетки SK-UT-1В — в среде Игла МЕМ и нормальные миобласты в среде F-12. Манипуляции, требующие стерильных условий, выполнялись в ламинарном шкафу второго класса защиты фирмы Jouan (Франция).
В качестве основных протеомных технологий применяли модификацию двумерного электрофореза по О`Фарреллу с изоэлектрофокусированием в амфолиновом (IEF-PAGE) градиенте pH, как описано ранее [1]. Детекция белков на гелевых пластинах проводилась окрашиванием Кумасси R-250 и азотнокислым серебром.
Идентификацию белковых фракций на ДЭ осуществляли после трипсинолиза методами MALDI-TOF MS и MS/MS масс-спектрометрии на MALDI-времяпролетном масс-спектрометре Ultraflex (Bruker, Германия) с УФ-лазером (336 нм) в режиме положительных ионов в диапазоне масс 500–8000 Да с калибровкой их по известным пикам аутолиза трипсина [1]. Анализ полученных масс-спектров триптических пептидов выполняли с помощью программы Mascot (Matrix Science, США), осуществляя поиск по базам данных Национального центра биотехнологической информации США (NCBI), базе данных UniProt и другим общедоступным биоинформационным Интернет-ресурсам. О результатах идентификации судили по традиционным критериям (score, matched peptides, coverage). Кроме того, учитывалось сходство экспериментально полученных значений Mm и pI у идентифицируемого белка с соответствующими расчетными значениями [1].
Результаты исследования и их обсуждение
Проведенный двумерный электрофоретический анализ белков рабдомиосаркомы линии RD позволил получать на типичных двумерных электрофореграммах (ДЭ) более 200 фракций при окраске Кумасси R-250 и около 400–500 — при окраске азотнокислым серебром. Эти фракции располагались в широком диапазоне молекулярных масс (Мм) и изоэлектрических точек (pI). В частности, некоторые фракции обладали Мм со значениями более 150кДа, а другие – около 10 кДа. Значения pI детектируемых фракций варьировали от 4,50 до 9,50 рН. На рисунке 1 в качестве примера представлена такая ДЭ, окрашенная азотнокислым серебром, на которой стрелками отмечены белки (n=51), идентифицированные масс-спектрометрическими методами.
Все данные о результатах выполненной идентификации можно найти в отечественной общедоступной многомодульной базе данных «Протеомика рака простаты», модуль «Белки клеток рабдомиосаркомы RD» [9].
Среди идентифицированных фракций наряду с мажорными ферментами, участвующими в основных метаболических процессах (в частности, в гликолизе), и структурными белками оказалось как минимум десять белков, которые рассматриваются как ассоциированные со злокачественной трансформацией или даже как потенциальные биомаркеры злокачественных опухолей.
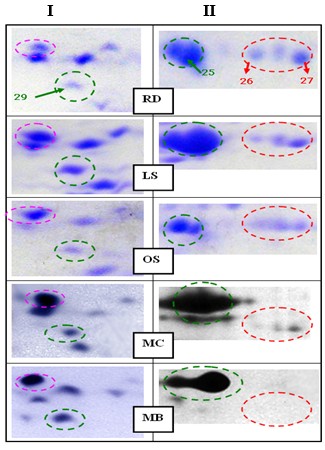
Рис. 1. Результаты фракционирования белков рабдомиосаркомы линии RD. Белковые фракции окрашены азотнокислым серебром. Стрелками и арабскими цифрами отмечены белковые фракции, идентифицированные масс-спектрометрическими методами. Пунктирными прямоугольниками показаны участок I (синий) и участок II (голубой); остальные пояснения см. ниже в тексте
Общие характеристики таких белков (включая их номера на рисунке 1) представлены в таблице 1. Ссылки на соответствующие литературные источники можно найти в аннотациях каждого из указанных белков, которые имеются в базе данных «Протеомика рака простаты», модуль «Белки клеток рабдомиосаркомы RD».
Поиск, проведенный в двух вариантах по базе данных PubMed NCBI с использованием ключевого слова «rhabdomyosarcoma» и английских названий шести белков, представленных в таблице 1 («ATP synthase subunit delta», или «60 kDa heat shock protein»; «ER-60 protease»; «Heterogeneous nuclear ribonucleoprotein A1»; «Protein S100-A11 и Calgizzarin»; «Stathmin»), не выявил ни одной публикации. В другом варианте в качестве второго ключевого слова использовали символы соответствующих генов с тем же результатом. При этом показатели идентификации всех перечисленных белков были вполне доказательными.
Таблица 1
Результаты масс-спектрометрической идентификации (MALDI-TOF MS и MS / MS) белковых фракций, обозначенных на ДЭ белков рабдомиосаркомы линии RD.
|
№№ |
Наименование белка (Наименование белка на английском языке и символ гена) |
Номера в Protein NCBI / UniProt |
S / M/ C * |
Мм / pI (эксп.)** |
Мм / pI (расч.)*** |
|
1 |
Миозиновая легкая цепь 6 (Myosin light polypeptide 6; MYL6) |
17986258 / P60660 |
157 / 8 /60 |
14,8/4,50 |
16,8/4,56 |
|
2 |
АТФ-синтаза дельта субъединица (ATP synthase subunit delta, ATP5D) |
4502297 / P30049 |
139 / 8 / 22 |
15,0/4,50 |
15,0/4,48 |
|
3 |
Белок теплового шока 60кДа (60 kDa heat shock protein; HSPD1) |
31542947 / P10809 |
360 / 61 / 89 |
59,0/5,40 |
57,9/5,24 |
|
4 |
Дисульфид-изомераза А3 (ER-60 protease; PDIA3) |
1208427 / P30101 |
242 / 26 / 47 |
54,5/ 6,00 |
54,3/5,61 |
|
6 |
Кофилин 1 (Cofilin-1, non-muscle isoform; CFL1) |
5031635 / P23528 |
404**** / 10 / 51 |
15,5/8,20 |
18,5/8,22 |
|
22 |
Галектин 1 (Galectin-1 (LGALS1) |
4504981 / P09382 |
174 / 17 / 94 |
14,6/5,10 |
14,6/5,34 |
|
24 |
Белок теплового шока 70 кДа, изоформа А5 (78 kDa glucose-regulated protein; HSPA5) |
16507237 / P11021 |
386**** / 55 / 75 |
75,0/5,00 |
72,3/5,07 |
|
27 |
Белок А1 гетерогенного ядерного рибонуклеопротеина (Heterogeneous nuclear ribonucleoprotein A1 isoform a; HNRNPA1) |
75517570 / P09651 |
207**** / 15 / 43 |
33,0 / 9,30 |
34,2/9,27 |
|
40 |
Белок S100-A11 (Protein S100-A11;Calgizzarin; S100A11) |
5032057 / P31949 |
143**** / 11 / 86 |
11,0/6,20 |
11,7/6,56 |
|
41 |
Статмин (Stathmin; Leukemia-associated phosphoprotein p18; STMN1) |
5031851 / P16949 |
395 / 38 / 83 |
17,5/6,10 |
17,1/5,76 |
* S / M/ C — традиционные показатели идентификации, принятые в англоязычной литературе: Score — показатель соответствия или «счет очков»; Match peptides - количество совпавших пептидов; Coverage — % покрытия полной аминокислотной последовательности белка выявленными пептидами; ** Мм / pI (эксп.) – значения молекулярных масс и изоэлектрических точек, определенные по результатам электрофоретического анализа; *** — Мм / pI (расч.) — значения молекулярных масс и изоэлектрических точек, рассчитанные из аминокислотных последовательностей белков с учетом удаления сигнального пептида, но без учета других постсинтетических модификаций; **** с учетом данных MS/MS.
Таким образом, можно сделать заключение, что в данном исследовании получены первые результаты, свидетельствующие о присутствии указанных белков в клетках рабдомиосарком человека.
Надо отметить, что Белок А1 гетерогенного ядерного рибонуклеопротеина, как оказалось, в анализируемых клетках существовал в виде как минимум двух электрофоретических форм (№ 26 и 27).
Большинство из перечисленных в таблице 1 белков удалось обнаружить и в других обследованных клетках мезенхимального происхождения. На рисунке 2 в качестве примера показаны отдельные участки ДЭ белков из клеток еще двух видов злокачественных опухолей, а также стволовых мезенхимальных клеток и нормальных миобластов в сравнении с соответствующими участками ДЭ белков из клеток рабдомиосаркомы RD (выделены пунктирными прямоугольниками на рисунке 1).
Из этого сравнения следует, что при некоторых количественных различиях во всех клеточных культурах (участки I) выявлялись фракции, соответствующие кофилину 1 (показаны лиловыми овалами).
Иная ситуация оказалась для Белка А1 гетерогенного ядерного рибонуклеопротеина (участки II). Как минимум две идентифицированные электрофоретические фракции этого белка (№26 и 27, обозначенные красными овалами) четко детектировались на ДЭ сарком при окраске Кумасси R-250 (синий цвет), что позволяло отнести их к мажорным.
Однако в стволовых мезенхимальных клетках указанные фракции удавалось выявлять только при окраске азотнокислым серебром (серый цвет). Поскольку известно, что чувствительность окраски азотнокислым серебром более чем на порядок превосходит чувствительность при традиционной окраске Кумасси R-250, то полученные данные очевидно свидетельствуют о существенно меньшем содержании Белка А1 гетерогенного ядерного рибонуклеопротеина в мезенхимальных стволовых клетках по сравнению с клетками сарком.
Более того, в нормальных миобластах фракции Белка А1 гетерогенного ядерного рибонуклеопротеина практически не определялись даже при окраске азотнокислым серебром, хотя референсные белковые фракции, принадлежащие глицеральдегид-3-фосфат дегидрогеназе, четко детектировались (рис. 2).
Таким образом, из приведенных данных следует, что Белок А1 гетерогенного ядерного рибонуклеопротеина можно рассматривать как потенциальный биомаркер злокачественной трансформации мезенхимальных клеток человека.
Заключение
Клетки сарком, имеющие мезенхимальное происхождение, и клетки наиболее распространенных карцином эпителиального происхождения наряду с характерными признаками злокачественной трансформации характеризуются и определенными различиями на молекулярном уровне [например, по 4]. Проведенный протеомный анализ белков в культивируемых клетках рабдомиосаркомы (линия RD) привел к идентификации 51 белковой фракции, среди которых оказалось как минимум десять, принадлежащих белкам, рассматриваемым как ассоциированные со злокачественной трансформацией. Шесть из этих белков (АТФ-синтаза дельта субъединица; Белок теплового шока 60кДа; Дисульфид-изомераза А3; Кофилин 1; Галектин 1; Белок теплового шока 70 кДа, изоформа А5, Белок А1 гетерогенного ядерного рибонуклеопротеина; Белок S100-A11; Статмин) ранее не упоминались в публикациях о рабдомиосаркомах. Все полученные результаты внесены в отечественную базу данных «Протеомика рака простаты (http://ef.inbi.ras.ru). Таким образом, эта база данных становится биоинформационным ресурсом, пригодным для обеспечения поисков новых белковых биомаркеров злокачественных опухолей мезенхимального происхождения.

Рис. 2. Результаты сравнительного протеомного изучения на ДЭ отдельных белков (участки I и II) из различных клеток мезенхимального происхождения. RD - рабдомиосаркома; LS - лейомиосаркома; OS - остеосаркома; MC - мезенхимальные стволовые клетки; MB -нормальные миобласты.
Стрелками и арабскими цифрами, как на рисунке 1, отмечены идентифицированные белки. Зелеными овалами и цифрами обозначены референсные белковые фракции: на участках I - № 29 (профилин); на участках II - № 25 (глицеральдегид-3-фосфат дегидрогеназа)
Рецензенты:
Лукашева Е.В., д.б.н., профессор, профессор кафедры биохимии РУДН, Российский университет дружбы народов, г. Москва;
Левицкий Д.И., д.б.н., профессор, заведующий лабораторией, Федеральное государственное учреждение Федеральный исследовательский центр «Фундаментальные основы биотехнологии» РАН, г. Москва.



