Задачей нашей работы было определение оптимальных условий переноса гетерологичных генов в клетки диплоидной пшеницы однозернянки (T.monococcum L., 2n, A геном)и тетраплоидной пшеницы Тимофеева (Т.timopheevii Zhuk., 4n, GA геном)с помощью устройства «генная пушка» PIG[2].Для подбора оптимальных параметров биобаллистической трансформации использовали репортерный гензеленого флуоресцентного белка gfp, которыйпозволяет определить эффективность переноса генов уже через несколько часов после обстрела плазмидной ДНК тканей пшеницы [4]. Проведенные ранее экспериментальные работы показали, что величина давления гелия, определяющая силу, с которой частицы проникают в ткани экспланта, оказывает значительное влияние на уровень транзиентной экспрессии гена gfp в клетках мягкой гексаплоидной пшеницы [1]. Для решения поставленной задачи изучали влияние на эффективность переноса генов таких факторов, как величина давления гелия, а такжеразмер частиц-носителей ДНК.
Материалы и методы исследования
Перенос генетического материала в клетки незрелых зародышей пшеницы однозернянки и пшеницы Тимофеева производили с использованием устройства Particle Inflow Gun [2] по модифицированной методике [1] вольфрамовыми частицами с нанесенной на них плазмидной ДНКвектора psGFP-BAR [4].Использовали частицытрех размеров: N5 (0,7 мкм), N10 (0,7 мкм) и N17 (1,1 мкм) (Biorad, USA). При осуществлении переноса ДНК создавали давление гелия в камере генной пушки,равное 4,5, 5,0, 5,5 и 6,0 кгс/см2. Эффективность переноса генетического материала проводили путем анализафлуоресценции клеток через 24 часа после обстрела частицами по транзиентной (временной) экспрессиигена gfp.Подсчитываликоличество клеток, проявляющих характерную для гена gfp флуоресценцию,с помощью микроскопа ZEIZ (Германия) со светофильтрами 450–490 нм (возбуждение флуоресценции GFP) и 515–530 нм (эмиссия флуоресценции GFP).
Результаты и их обсуждение
Анализ транзиентной экспрессии в клетках пшеницы однозернянки показал, что увеличение давления гелия с 4,5 до 5,5 кгс/см2 приводило к постепенному увеличению числа флуоресцирующих клеток с 7,60 до 19,98 шт./эксплант (рис. 1). При увеличении давления гелия до 6,0 кгс/см2наблюдали несущественное снижение числа флуоресцирующих клеток до 17,33 шт./эксплант. Характер транзиентной экспрессии гена gfpу пшеницы Тимофеева в целом соответствовал тому, который наблюдался у пшеницы однозернянки. Так, увеличение давления гелия приводило к постепенному увеличению числа флуоресцирующих клеток, достигнув максимума 19,03 шт./эксплант при 6 кгс/см2 (рис. 1).
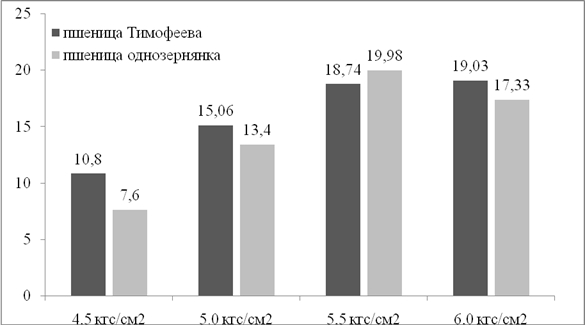
Рис. 1. Влияние давления гелия на среднее число флуоресцирующих клеток с экспрессией гена gfp в тканях незрелых зародышей пшеницы однозернянки и пшеницы Тимофеева (экспланты обстреливали частицами N17)
Перенос гетерологичной ДНК в растительные клетки осуществляется на металлических частицах[6]. Для этих целей используются ковкие металлы: вольфрам или золото. Подавляющее большинство работ по трансформации пшеницы выполнено с использованием золотых частиц на коммерческой установкевысокого давления газа PDS 1000/He gun [3]. Поскольку в нашей работе мы использовали пушку низкого давления газа PIG, проблема повреждения клеток при бомбардировке была не столь острой. Следует также отметить, что вольфрамовые частицы имеют более низкую стоимость в сравнении с золотыми, что позволяет снизить затраты на проведение исследований.
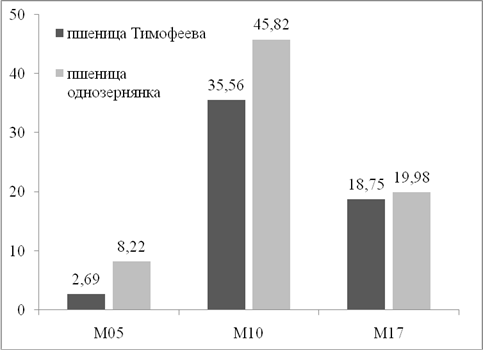
Рис. 2. Влияние размера вольфрамовых частиц на среднее число флуоресцирующих клеток с экспрессией гена gfp в тканях незрелых зародышей пшеницы однозернянки и пшеницы Тимофеева
Теоретически частицы меньшего размера должны обеспечивать более равномерное распределение ДНК по поверхности ткани-мишени и меньше повреждать растительные клетки, что, в свою очередь, должно положительно влиять на уровень транзиентной экспрессии. Как показали результаты проведенных исследований – это не совсем так. При обстреле тканей пшеницы однозернянки и пшеницы Тимофеева частицами среднего размера (N10) количество флуоресцирующих клеток с экспрессией гена gfp было выше (рис. 2). Более мелкие частицы N5 не обеспечивали хорошего проникновения в клетки, поэтому уровень экспрессии при их использовании был низким. Более крупные частицы N17 лучше доставляли гетерологичную ДНК, чем частицы N5, поэтому приводили к более высокой транзиентной экспрессии. Однако из-за более крупного размера ониоказывали сильный повреждающий эффект, что привело к снижению числа живых клеток, способных кфлуоресценции по сравнению с частицами N10.Полученные данные отличаются от тех, которые были получены в предыдущих исследованиях по баллистической трансформации мягкой пшеницы, когда частицы N17 оказались более предпочтительныдля переноса ДНК, чем частицыN10[1].Это подтверждает необходимость поиска оптимальных условий для каждого вида пшеницы, поскольку восприимчивость клеток-мишеней значительно зависит от генотипическихособенностей. Так, в данной работе ткани пшеницыоднозернянкибыли более восприимчивы к переносу ДНК,чем ткани пшеницыТимофеева,поскольку демонстрировали большее число клеток с экспрессией гена gfp (45,82против 35,56 шт./эксплант).
Заключение
В ходе экспериментов по оптимизации параметров по переносу гетерологичных последовательностей (на примере гена gfp) в ткани диплоидного и тетраплоидного видов пшеницы T.monococcum и Т.timopheevii нами установлено, что для достиженияэффективной экспрессии следует соблюдать следующие условия при использовании генной пушки PIG:
1) обстрел частицами, несущими плазмидную ДНК, следует проводить, используя величину давления гелия, равную 5,5-6,0 кгс/см2;
2) для достижения оптимального баланса между повреждающим эффектом и проникновением через клеточную стенку предпочтительнее использовать вольфрамовые частицы размером 0,7 мкм.
Исследования выполнены при финансовой поддержке Министерства науки и образования Российской Федерации (грант № 14.М04.12.0015).
Рецензенты:Харченко П.Н., д.б.н., профессор, заведующий отделом клеточной и генной инженерии растений ФГБНУ ВНИИСБ, г. Москва;
Долгов С.В., д.б.н., заведующий лабораторией экспрессионных систем и модификации генома растений, Филиал ФГБНУ ИБХ им. акад. М.М. Шемякина и Ю.А. Овчинникова РАН, г. Пущино.



