Интерес к изучению активности протеолитических ферментов в злокачественных и доброкачественных новообразованиях обусловлен их разнообразным влиянием на процесс канцерогенеза путем процессинга, модификации или инактивации регуляторных пептидов и ростовых факторов, вовлеченных в этиологию и патогенез злокачественных новообразований [3].
Патофизиология новообразований характеризуется изменением активности и спектра пептидгидролаз. Ферментный спектр обусловлен локализацией и степенью дифференцировки опухоли. Если в дифференцированных образованиях ферменты соответствуют таковым данного органа или ткани, то при низкой степени дифференцировки активность и спектр ферментов значительно изменены. Предполагается исключительно высокая роль пептидгидролаз в инвазии опухолевых клеток. В трансформированных клетках протеолитических ферментов синтезируется заметно больше, чем в нормальных клетках. В злокачественных новообразованиях наблюдаются выход пептидгидролаз в межклеточное пространство и увеличение их активности. В сыворотке онкологических больных обнаруживается увеличение и изменение активности ряда ферментов обмена регуляторных пептидов и белков [6].Тем не менее работ по изучению активности пептидгидролаз в злокачественных новообразованиях человека практически нет, практически все исследования выполнены на лабораторных животных, поэтому роль данных ферментов в патофизиологии злокачественных новообразований человека остается неизвестной.
Таким образом, целью нашей работы является изучение активности ферментов модификации, процессинга и деградации регуляторных пептидов – кислых протеаз, катепсинаD, карбоксипептидазы Е (КПЕ) и ФМСФ-ингибируемой карбоксипептидазы (ФМСФ-КП) в злокачественных новообразованиях молочной железы, желудка, кишечника и почек человека.
Материалы и методы исследований
Активность ферментов определяли в злокачественных новообразованиях молочной железы, желудка, кишечника и почек человека, удаленных в ходе хирургических операций в ГБУЗ «Пензенский областной онкологический диспансер». Изучение активности ферментов было проведено у 100 человек в возрасте от 35 до 70 лет. Новообразования классифицировали в соответствии с клиническими признаками и результатами гистологического анализа.
Для определения активности КПЕ и ФМСФ-КП навески ткани гомогенизировали в 50 мМ натрий ацетатном буфере, содержащем 50 мМNaCl, рН 5,6, в соотношении 1 : 50 (вес : объем), для определения активности кислых протеаз и катепсинаD – в в200 мМ натрий ацетатном буфере, рН 4,0. Активность ферментов определяли как разницу прироста флюоресценции или оптических единиц в пробах, не содержащих и содержащих ингибитор, и выражали в нмольпродукта, образовавшегося за 1 мин инкубации в пересчете на 1 мг белка.
В полученныхгомогенатах определяли активность КПЕ и ФМСФ-КП флюорометрическим методом L. D. FrickerandS. H. Snyder [7] с модификациями, как описано ранее [2], активность кислых протеаз и катепсинаDфотометрически [4], содержание белка определяли методом Lowry [5].
Достоверность отличий между средними определяли с использованием t-критерия Стьюдента [1].
Результаты исследования и их обсуждение
Результаты исследования (рис. 1) показали увеличение активности кислых протеаз в злокачественных новообразованиях молочной железы (инвазивная протоковая карцинома), желудка (низкодифференцированная аденокарцинома) и почек по сравнению с доброкачественными новообразованиями в этих же органах.
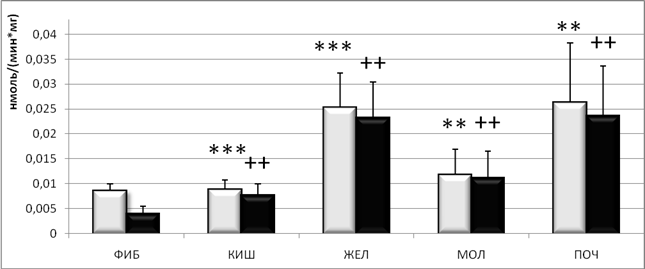
Рис.
1. Активности кислых протеаз (![]() ) и катепсинаD (
) и катепсинаD (![]() ) (нмоль/(мин*мг белка) в
доброкачественных новообразованиях (ФИБ) и в злокачественных новообразованиях
кишечника (КИШ), желудка (ЖЕЛ), молочной железы (МОЛ) и почек (ПОЧ) человека.
Здесь и на рисунке 2: M±m, n=10-14, * – Р < 0,05, ** – Р < 0,01, *** – Р < 0,001, + – Р < 0,01, ++ – Р < 0,01, +++ – Р < 0,001
) (нмоль/(мин*мг белка) в
доброкачественных новообразованиях (ФИБ) и в злокачественных новообразованиях
кишечника (КИШ), желудка (ЖЕЛ), молочной железы (МОЛ) и почек (ПОЧ) человека.
Здесь и на рисунке 2: M±m, n=10-14, * – Р < 0,05, ** – Р < 0,01, *** – Р < 0,001, + – Р < 0,01, ++ – Р < 0,01, +++ – Р < 0,001
Так, значение активности кислых протеаз в злокачественных новообразованиях желудка и почек в 3 раза превышает активность кислых протеаз в доброкачественных новообразованиях, а в злокачественных новообразованиях молочной железы — в 1,37 раза.
Достоверных отличий между активностью кислых протеаз в злокачественных новообразованиях кишечника и соответствующих доброкачественных новообразованиях не обнаружено.
АктивностьКатепсина D была повышенной в злокачественных новообразованиях молочной железы, желудка, кишечника и почек по сравнению с доброкачественными новообразованиями. При этом значение активности Катепсина D в злокачественных новообразованиях желудка и почек по сравнению с активностью Катепсина D в доброкачественных новообразованиях была выше в 6 раз, в злокачественных новообразованиях кишечника — в 2 раза, а в злокачественных новообразованиях молочной железы — в 2,8 раза.
Результаты исследования (рис. 2) показали достоверное увеличение активности КПЕ в злокачественных новообразованиях молочной железы, кишечника, желудка по сравнению с доброкачественными новообразованиями в этих же органах.
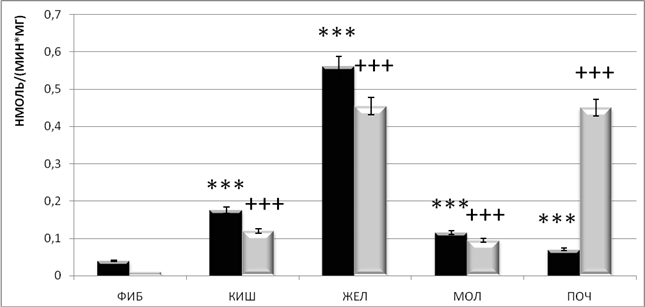
Рис.2. Активности КПЕ (![]() ) и ФМСФ-КП (
) и ФМСФ-КП (![]() ) (нмоль/(мин*мг белка) в
доброкачественных новообразованиях (ФИБ) и в злокачественных новообразованиях
кишечника (КИШ), желудка (ЖЕЛ), молочной железы (МОЛ) и почек (ПОЧ) человека
) (нмоль/(мин*мг белка) в
доброкачественных новообразованиях (ФИБ) и в злокачественных новообразованиях
кишечника (КИШ), желудка (ЖЕЛ), молочной железы (МОЛ) и почек (ПОЧ) человека
Значение активности КПЕ в клетках низкодифференцированной аденокарциномы желудка более чем в 10 раз превышает активность КПЕ в доброкачественных новообразованиях желудка.
Достоверных отличий между активностью КПЕ в злокачественных и доброкачественных новообразованияхпочек не обнаружено.
ФМСФ-КП в опухолевой ткани человека показывает аналогичное КПЕ распределение активности (рис. 2).
По результатам эксперимента показано, что активность ФМСФ-КП достоверно выше в злокачественных новообразованиях молочных желез, желудка, кишечника, почек, чем в доброкачественных новообразованиях в этих же органах.
Результаты нашего исследования показывают, что активность кислых протеаз в злокачественных новообразованиях желудка и кишечника была выше, чем в клетках доброкачественных опухолей. Активность Катепсина Д была значительно выше во всех исследуемых группах злокачественных новообразований, чем у контрольной группы. Кроме того, в доброкачественных опухолях активность Катепсина Д составляла не более 50% от активности кислых протеаз, а в раковых опухолях, во всех исследованных группах активность Катепсина Д составляла не менее 90% от общей активности кислых протеаз.
Активность КПЕ и ФМСФ-КП была существенно выше во всех типах злокачественных новообразований, чем в фиброзах. Активность данных карбоксипептидаз в клетках доброкачественных опухолей достаточно низкая, в то время как в раковых клетках она достигает уровня активности секреторных клеток.
Полученные данные по карбоксипептидазам вносят большой вклад в фундаментальные сведения о роли основных карбоксипептидаз, поскольку активность этих ферментов ранее не изучалась в раковых клетках. Активность ФМСФ-КП впервые изучена в тканях человека, ранее она изучалась только в тканях животных.
Существенное повышение активности кислых протеаз и катепсина D в злокачественных новообразованиях показывает положительную корреляцию с активностью карбоксипептидазы Е и ФМСФ-ингибируемой карбоксипептидазы, что позволяет сделать вывод об активном вовлечении данных ферментов в процессы канцерогенеза, о высокой роли протеолиза в этиологии и патогенезе злокачественных заболеваний, а также предполагает наличие зависимости между процессами образования, модификации и деградации регуляторных пептидов и ростовых факторов при канцерогенезе.
Выводы:
1. Значительное увеличение активности кислых протеаз, катепсинаD, КПЕ и ФМСФ-КП в злокачественных новообразованиях органов человека свидетельствует об активном вовлечении данных ферментов в процессы онкогенеза.
2. Наиболее выраженное повышение активности кислых протеаз, катепсинаD, КПЕ и ФМСФ-КП, наблюдаемое в низкодифференцированной аденокарциноме желудка и злокачественных новообразованиях почек, говорит о зависимости между интенсивностью роста и интенсивностью процессинга регуляторных пептидов при канцерогенезе.
3. ФМСФ-КП в отличие от КПЕ задействована в канцерогенезе почек, поэтому изучение ее активности может выступать в ролиновой диагностическойпроцедуры при выявлении злокачественных новообразований почек.
4. Изучение активности кислых протеаз и КатепсинаD может быть использовано в качестве диагностических процедур при определении злокачественных новообразований молочной железы, желудка и почек.
Рецензенты:
Генгин М.Т., д.б.н., профессор, ведущий научный сотрудник НИИ Фундаментальных и прикладных исследований ФГБОУ ВПО «Пензенский государственный университет», г. Пенза;
Карпова Г.А., д.б.н., профессор, заведующий кафедрой «Общая биология и биохимия» ФГБОУ ВПО «Пензенский государственный университет», г. Пенза.



