По данным ВОЗ рак желудка характеризуется высокой летальностью: у мужчин более 460 тыс. человек в год, и у женщин – более 270 тыс. человек в год [6]. Метастазы возникают у 80-90 % больных раком желудка, при этом выживаемость составляет 65% в случае ранней диагностики заболевания и менее 15% на поздних стадиях процесса [9]. Поэтому исследования механизмов канцерогенеза необходимы для поиска потенциальных молекулярных маркеров, пригодных для ранней диагностики и прогнозирования течения заболевания.
Раковые клетки получают возможность выживать в организме за счет изменения в сигнальных путях, обеспечивающих приобретение автономной регуляции постоянного клеточного роста; иммортализации, нечувствительности к сигналам, ингибирующим клеточную пролиферацию; резистентность к сигналам апоптоза; неограниченного потенциала к пролиферации; способности поддерживать ангиогенез; способности к инвазии и метастазированию. Молекулярные изменения, ответственные за приобретение вышеуказанных свойств, могут использоваться в качестве онкомаркеров [2].
Изменение копийности генов (Copy Number Variation или CNV) является одним из основных механизмов контроля раковой клеткой ключевых для выживания и малигнизации экспрессии генов. Копийность генов – вид генетического полиморфизма, возникающий в результате несбалансированных хромосомных перестроек, таких как делеции и дупликации. Результатом вариации может явиться снижение или повышение числа копий определенного гена, и, следовательно, пониженная или повышенная экспрессия продукта гена – белка или не кодирующей РНК [2]. CNV представляют собой критические генетические события, которые способствуют развитию и прогрессированию злокачественных новообразований у человека. CNV является одним из основных механизмов контроля экспрессии потенциальных онкогенов и генов-супрессоров опухолей раковыми клетками [2].
Анализ литературы позволяет сделать заключение о том, что значение CNV в качестве фактора малигнизации тканей ранее было недооценено. Так, в работе Günther T. и соавт. [4] изучена амплификация гена MDM2 при раке желудка и показано, что увеличение копийности этого гена коррелирует с увеличенной экспрессией белка MDM2 и понижением экспрессии белка p53. Ген MDM2 локализован на хромосоме 12 и считается негативным регулятором функции белка р53. MDM2/P53 путь является важной составной частью канцерогенеза. В работах Y-D Wang и соавт. [10] рассмотрена роль транскрипционного фактора OCT4 в опухолеобразовании при аденокарциноме желудка. Ими установлено повышение экспрессии гена OCT4 в опухолевых клетках по сравнению с прилегающими условно здоровыми тканями, тканями атрофического гастрита и желудочной язвы, а также то, что это изменение происходит совместно с изменением экспрессии генов SOX2, NANOG и С-MYC.
Точная характеристика числа копий генов определяет возможность создания предиктивных маркеров малигнизации тканей. Поэтому целью нашего исследования стало исследование относительной копийности генетических локусов, ответственных за апоптоз, онкогенез, пролиферацию и окислительное фосфорилирование в тканях опухолевых и здоровых тканях желудка пациентов с метастазами в лимфатических узлах и без метастазов.
Материалы и методы
Клиническим материалом для исследования послужили ткани (опухолевые и условно здоровые) 30 пациентов Юга России с гистологически подтвержденным диагнозом рак желудка: с наличием метастазов в лимфоузлы (9 пациентов) и без метастазов (21 пациент). Образцы тканей были получены в процессе хирургического вмешательства в Ростовском научно-исследовательском онкологическом институте (РНИОИ) с 2013 по 2015 гг. Все пациенты, вошедшие в данное исследование, имели ECOG статус от 0 до 2. Для верификации образцов тканей проводилось стандартное патолого-морфологическое исследование с окрашиванием фиксированных срезов гематоксилин-эозином. Биоптаты тканей после проведения патолого-морфологического исследования классифицировали на две группы: опухолевые (малигнизированные) и контрольные (не малигнизированные) образцы.
Геномную ДНК экстрагировали из свежезамороженных операционных биоптатов тканей желудка с использованием лизирующего SDS- содержащего буфера в присутствии протеиназы–К и последующей фенол-хлороформной экстракцией [2, 3]. Концентрацию полученных препаратов ДНК измеряли на флюориметре Qubit 2.0® (Invitrogen, США) с использованием набора Quant-iT™ dsDNA High-Sensitivity (HS) Assay Kit (Invitrogen, США). Для проведения Real-Time qPCR концентрацию образцов ДНК нормализовывали до величины 2 нг/мкл.
Определение относительной копийности генетических локусов проводили методом Real-Time qPCR (RT-qPCR). Принцип метода заключается в одновременной амплификации гена-мишени и референтного гена в опытной и контрольной пробах. Вывод об изменении дозы гена делается на основании анализа соотношения сигналов, продуцируемых ампликонами изучаемой и референсной последовательностей [2]. Метод использует относительную количественную оценку интересующего гена в сравнении с референсным геном. Относительная величина определялась методом ΔΔCt [7]. Каждые 25 мкл ПЦР-смеси для анализа содержали 10 нг геномной ДНК, 0.2 mM dNTP’s, по 400 нМ прямого и обратного праймеров для референтного гена (B2M) или гена-мишени, 2.5 mM MgCl2, ПЦР-буфер, 0.05u/µl SynTaq ДНК-полимеразы с ингибирующими активность фермента антителами («Синтол», Россия). В качестве красителя использовали SYBR®Green I (Invitrogen, США). Амплификация каждой из проб осуществлялась в трех повторностях. Первичные данные RT-qPCR получали с использованием программного обеспечения Bio-Rad CFX Manager ver 3.1.
Количественная RT-PCR амплификация проводилась с использованием термоциклера Bio-Rad CFX96 (Bio-Rad, USA) в соответствии с инструкциями производителя по следующей программе: 95 °C 3 мин., и 40 циклов при 95 °C 10 сек, 58 °C 30 секунд (чтение оптического сигнала FAM для красителя SYBR®Green I) и 72°C 15 секунд. Показатели относительной копийности выбранных для исследования генетических локусов были получены методом количественной Real-Time PCR с использованием разработанной нами панели праймеров (таблица 1). Прямые и обратные праймеры были разработаны с использованием референтных последовательностей ДНК NCBI GenBank. Генетический локус B2M [2] использовали в качестве референтного для нормализации полученных показателей количественной RT-qPCR.
Таблица 1
Панель праймеров для определения относительной копийности генов
|
№№ |
Наименование |
№№ NCBI GenBank |
Хромосомная локализация |
|
1. |
HV2_Hum34 |
NC_012920.1 |
mitochondrion |
|
2. |
B2M |
NM_004048.2 |
15q21-q22.2 |
|
3. |
GAPDH |
NM_002046.5 |
12p13 |
|
4. |
BAX |
NM_138761.3 |
19q13.3-q13.4 |
|
5. |
GSTP1 |
NM_000852.3 |
11q13 |
|
6. |
CASP3 |
NM_004346.3 |
4q34 |
|
7. |
CASP8 |
NM_001080125.1 |
2q33-q34 |
|
8. |
HIF1α |
NM_001530.3 |
14q23.2 |
|
9. |
OCT4 (POU5F1) |
NM_001285987.1 |
6p21.31 |
|
10. |
C-MYC |
NM_002467.4 |
8q24.21 |
|
11. |
SOX2 |
NM_003106.3 |
3q26.3-q27 |
|
12. |
BCL2 |
NM_000633.2 |
18q21.3 |
|
13. |
CFLAR |
NM_003879.5 |
2q33-q34 |
|
14. |
NANOG |
NM_024865.2 |
12p13.31 |
|
15. |
P53 |
NM_000546.5 |
17p13.1 |
|
16. |
CASP9 |
NM_032996.3 |
1p36.21 |
|
17. |
IL10 |
NM_000572.2 |
1q31-q32 |
|
18. |
MKI67 |
NM_002417.4 |
10q26.2 |
|
19. |
MDM2 |
NM_002392.5 |
12q13-q14 |
|
20. |
NFKB1 |
NM_003998.3 |
4q24 |
Усредненные данные по каждому генетическому локусу нормировались по усредненному показателю референтного гена B2M для получения величины ΔCt (ΔCt=Ct(исследуемого гена) – Ct(B2M)) Относительную копийность генетического локуса (RQ) рассчитывали по формуле 2-ΔCt. Далее вычисляли медиану [1] RQоп опухолевых образцов и медиану RQк контрольных (условно нормальная ткань) для каждого генетического локуса и рассчитывали соотношение относительной копийности генов в опухолевой ткани по отношению к нормальной ткани желудка: RQоп/RQк [2].
Статистический анализ выполняли с использованием прикладных пакетов программ Microsoft Excel 2013 и STATISTICA 8.0. Оценку различий проводили с использованием критерия Манна-Уитни [1] для порогового уровня статистической значимости р<0.05.
Результаты и обсуждение
Сравнение относительной копийности генетических локусов в опухолевой и условно-здоровой ткани пациентов без метастазов в лимфоузлы показало статистически достоверное (p<0.05) снижение относительной копийности генов OCT4 и MTDNA на 50% и 30% соответственно в опухолевой ткани относительно условно здоровой (Рисунок 1). Ген OCT4 кодирует транскрипционный фактор, участвующий в самообновлении недифференцированных эмбриональных стволовых клеток. Нокдаун гена OCT4 вызывает дифференцировку эмбриональных стволовых клеток человека [2]. Обнаруженное снижение его копийности в опухолевой ткани желудка у пациентов без метастазов в лимфоузлы отличается от данных литературы [10] и может свидетельствовать об особом молекулярном статусе опухолей желудка из данной выборки.
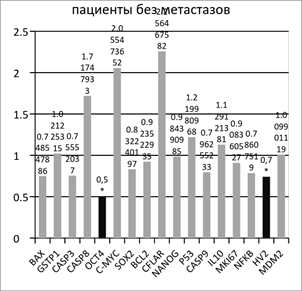
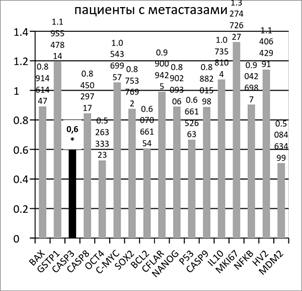
Рис. 1. Отношение копийности генов в опухолевой ткани желудка к условно нормальной у пациентов с метастазами и без метастазов в лимфоузлах
Обнаруженное снижение относительной копийности митохондриальной ДНК (мтДНК) находит подтверждение в данных литературы [8]. Подобное изменение числа копий митохондриальных генов, характерное для раковых клеток, ингибирует окислительное фосфорилирование, осуществляемое в митохондриях, и изменяет состояние биоэнергетики малигнизированных клеток, переводя клетки в режим преимущественного использования гликолиза (анаэробный режим). Это объясняет так называемый эффект Варбурга [8]. Количество копий мтДНК в клетке может служить индикатором интенсивности процессов окислительного фосфорилирования в силу своей пластичности. Полученные нами данные хорошо подтверждают факт угнетения процессов окислительного фосфорилирования в малигнизированных тканях желудка, оцениваемое по уменьшению относительной копийности митохондриальной ДНК (оцениваемое по локусу HV2).
Аналогичное сравнение копийности генетических локусов в опухолевой и условно-здоровой ткани пациентов с метастазами в лимфоузлах показало статистически достоверное (p<0.05) снижение копийности гена CASP3 на 38% в опухолевой ткани относительно условно здоровой (рисунок 1). Снижение копийности гена CASP3 может свидетельствовать о высоком потенциале к ингибированию эффекторной фазы апоптоза в клетках опухолей, дающих метастазы в лимфоузлы.
Так же было проведено сравнение копийности генов в опухолевой ткани пациентов с метастазами относительно копийности генов в опухолевой ткани пациентов без метастазов (Рисунок 2). Было обнаружено достоверное снижение копийности гена CFLAR на 50% (p<0,05) и достоверно увеличение относительной копийности mtDNA на 90% (p<0.05). Ген CFLAR кодирует белок регулятор апоптоза и структурно похож на каспазу-8, тем не менее, у кодируемого белка отсутствует активность каспазы, и он действует как ингибитор апоптоза [5].
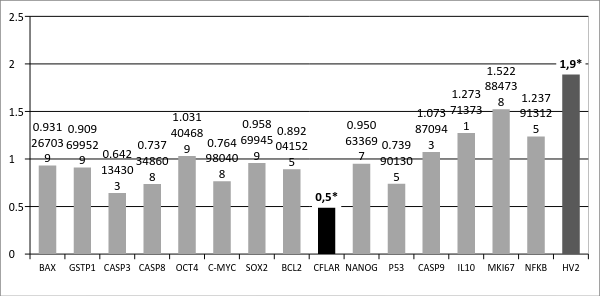
Рис. 2. Отношение копийности генов в опухолевой ткани желудка у пациентов с метастазами к копийности генов в опухолевой ткани желудка у пациентов без метастазов в лимфоузлах
Более низкая копийность гена CFLAR в метастазирующей опухоли может свидетельствовать о менее выраженной способности к ингибированию апоптоза, чем в не метастазирующей опухоли, а, следовательно, существует вероятность более высокой интенсивности апоптических процессов в подобных опухолях по сравнению с неметастазирующими, но не по сравнению с нормальной тканью (копийность гена CASP3 достоверно снижена в таких опухолях по сравнению с нормальной тканью (рисунок 1)).
Повышенная копийность митохондриальной ДНК (HV2) в опухолях желудка у пациентов с метастазами относительно опухолей у пациентов без метастазов может отражать особенности энергетического метаболизма данной ткани с повышенной интенсивностью процессов окислительного фосфорилирования в митохондриях, переводящей клетки в аэробный режим для обеспечения их распространения из первичного очага в другие органы [8].
Особый интерес представляют данные полученные в результате сравнения копийности про- и антиапоптозных генов p53 и MDM2 в опухолевых и условно здоровых тканях желудка пациентов с метастазами и без метастазов (таблица 2). У группы пациентов без метастазов в нормальной и опухолевой ткани соотношение копийности генов p53/MDM2 составляет 1.169 и 1.414 соответственно, что говорит о более высокой копийности гена p53 по сравнению с копийностью гена его негативного регулятора MDM2. Противоположный результат получен для группы пациентов с наличием метастазов в лимфоузлах: у них в нормальной и опухолевой ткани желудка соотношение копийности генов p53/MDM2 составляет 0.021 и 0.027 соответственно, причем данные значения достигаются за счет увеличения копийности гена MDM2, что свидетельствует о ярко выраженной отрицательной регуляции гена P53 в этих клетках.
Таблица 2
Соотношение копийности про- и анти-апоптозных генов p53 и MDM2 в опухолевых и условно здоровых тканях желудка пациентов с метастазами и без метастазов в лимфоузлах
|
Тип ткани |
Пациенты с метастазами |
Пациенты без метастазов |
||||
|
CNV p53 |
CNV MDM2 |
p53/MDM2 |
CNV p53 |
CNV MDM2 |
p53/MDM2 |
|
|
Нормальная |
0,299 |
14,514 |
0.021 |
0,221 |
0,189 |
1.169 |
|
Опухоль |
0,199 |
7,380 |
0.027 |
0,270 |
0,191 |
1.414 |
Заключение
Таким образом, использование трех разных подходов в оценке копийности генов (соотношение копийности в опухолевой ткани относительно нормальной ткани желудка, соотношение копийности в опухолевой ткани у пациентов с метастазами относительно опухолевой ткани у пациентов без метастазов, соотношение копийности генов p53/MDM2) позволяет выделить генетические локусы (OCT4 и mtDNA, CASP3, CFLAR и mtDNA), а также соотношение генетических локусов (p53/MDM2), которые можно использовать в качестве предиктивных маркеров при прогнозировании развития метастазов у пациентов с диагнозом рак желудка.
Рецензенты:
Франциянц Е.М., д.б.н., профессор, руководитель лаборатории изучения патогенеза злокачественных опухолей ФГБУ «Ростовский научно-исследовательский онкологический институт» МЗ РФ, г. Ростов-на-Дону;
Горошинская И.А., д.б.н., профессор, главный научный сотрудник лаборатории изучения патогенеза злокачественных опухолей ФГБУ «Ростовский научно-исследовательский онкологический институт» МЗ РФ, г. Ростов-на-Дону.



