Полиморбидность (мультиморбидность, множественность заболеваний у одного человека) – одна из самых сложных проблем, с которой сталкиваются медицинские работники при работе с больными пожилого и старческого возраста [1,3]. В среднем при клиническом обследовании больных пожилого и старческого возраста диагностируется не менее 4—5 болезней, проявлений патологических процессов [5]. В плане развития геронтологии и гериатрии наибольший интерес представляют патогенетические механизмы, задействованные в формировании полиморбидности при социально значимой возраст-ассоциированной патологии[2]. Необходимо отметить, что согласно эпидемиологическим данным, к наиболее распространенным заболеваниям пожилого и старческого возраста относятся сердечно-сосудистые, болезни дыхательной системы, неврологическая патология, а также стресс на фоне проводимых в пожилом и старческом возрасте оперативных вмешательств [4]. В этой связи изучение молекулярных биомаркеров диагностики, прогноза, оценки эффективности терапии наиболее востребовано, прежде всего, при социально значимой возраст-ассоциированной патологии.
Цель работы – изучить формирование полиморбидности путем развития оксидативного дисбаланса при соматической патологии, не имеющей общих патофизиологических механизмов развития и их молекулярные маркеры.
Материал и методы
Исследование включало в себя несколько этапов.
1.1. Сравнительное изучение показателей оксидативного статуса практически здоровых лиц среднего и пожилого возраста с целью выявления возрастных особенностей. На данном этапе проведено обследование 61 человека: 31 человека среднего возраста (от 40 до 49 лет, средний возраст 44,1+2,2 года, мужчин – 17 чел., женщин – 14 чел.) и 30 человек пожилого возраста (от 60 до 69 лет, средний возраст 64,4+2,3 года, мужчин – 14 чел., женщин – 16 чел.). Группы пациентов различного возраста были сопоставимы по возрасту, полу, факторам риска заболеваний.
1.2. Сравнительное изучение оксидативного статуса у практически здоровых пожилых людей с различными факторами риска сердечно-сосудистыми заболеваний. На данном этапе было обследовано 78 пациентов пожилого возраста (от 60 до 69 лет, средний возраст 64,8+2,4 года, мужчин – 42 чел., женщин – 36 чел.), в т.ч. лиц с курением – 17 чел., лиц с гиподинамией – 15 чел., лиц, подверженных хрониострессу – 15 чел., лиц с гиперхолестеринемией – 17 чел.; лиц с отсутствием факторов риска – 14 чел.
1.3. Изучение возрастных особенностей оксидативного статуса при хронической ИБС. На данном этапе проведено обследование 63 пациентов: 31 человека среднего возраста (от 40 до 49 лет, средний возраст 45,2+2,7 года, мужчин – 21 чел., женщин – 10 чел.) и 32 пациентов пожилого возраста (от 60 до 69 лет, средний возраст 65,8+2,2 года, мужчин – 19 чел., женщин – 13 чел.). Все пациенты страдали ИБС в виде стенокардии напряжения I-III ФК, ХСН ФК I-II по классификации NYHA. Группы пациентов различного возраста были сопоставимы по возрасту, полу, характеристикам ИБС. Следует подчеркнуть, что эти пациенты не имели другой, кроме ИБС, клинически значимой патологии, выявляемой рутинными методами, поэтому в нашем исследовании мы трактовали их как «пациентов, страдающих монопатологией в виде ИБС».
1.4. Изучение возрастных особенностей оксидативного статуса при железодефицитной анемии. На данном этапе проведено обследование 61 пациента: 30 человек среднего возраста (от 40 до 49 лет, средний возраст 44,8+3,1 года, мужчин – 11 чел., женщин – 19 чел.) и 31 пациента пожилого возраста (от 60 до 69 лет, средний возраст 64,0+2,7 года, мужчин – 13 чел., женщин – 18 чел.). Все пациенты страдали железодефицитной анемией легкой и средней степени тяжести. Группы пациентов различного возраста были сопоставимы по возрасту, полу, причинам и характеристикам железодефицитной анемии. Эти пациенты не имели другой кроме железодефицитной анемии клинически значимой патологии, выявляемой рутинными методами, а заболевания, явившиеся причиной железодефицитной анемии, находились в стадии выраженной клинической ремиссии, поэтому в нашем исследовании мы трактовали их как «пациентов, страдающих монопатологией в виде железодефицитной анемии», понимая определенную условность этого термина.
1.5. Изучение особенностей оксидативного статуса при сочетанной кардиоваскулярной и гематологической патологии у лиц пожилого возраста.
На данном этапе проведено обследование 32 человек пожилого возраста (от 60 до 69 лет, средний возраст 64,9+1,8 года, мужчин – 17 чел., женщин – 15 чел.). Все пациенты страдали ИБС в виде стенокардии напряжения I-III ФК, ХСН ФК I-II по классификации NYHA, железодефицитной анемией легкой и средней степени тяжести.
Уровень оксидативного стресса по содержании МДА и SH-группы и их соотношения определялся при помощи ферментативного метода с применением стандартных реактивов на биохимических автоанализаторах FP-901 «Labsystem» (Франция), «Harizon» (Канада).
Результаты и обсуждения
Проведя анализ полученных данных мы выявили, что в пожилом возрасте имелась тенденция к увеличению концентрации МДА: в нашем исследовании этот показатель увеличился с 33,2±1,3 мкмоль/л у людей среднего возраста до 39,2±1,1 мкмоль/л у людей пожилого возраста, р<0,05. Это свидетельствовало об увеличении прооксидантного потенциала в пожилом возрасте, по мере старения, несмотря на отсутствие заболеваний (табл. 1). Также была отмечена тенденция к снижению содержания маркеров прооксидантов SH-групп с 318,6±10,6 мкмоль/л у людей среднего возраста до 292,5±7,4 мкмоль/л у людей пожилого возраста, р<0,05. Соответственно, происходило снижение суммарного коэффициента SH/МДА, характеризующего оксидативный статус. Так, у лиц среднего возраста его значение составило 9,91±0,3, у здоровых лиц пожилого возраста – 7,08±0,3, р<0,05. Таким образом, у пожилых пациентов без сердечно-сосудистой патологии наблюдалось достоверное снижение маркеров антиоксидантной защиты в сыворотке крови и увеличение содержания МДА как показателя течения оксидативных процессов.
Таблица 1
Сравнительная характеристика оксидативного статуса у лиц среднего и пожилого возраста
|
Показатель |
Средний возраст (n=31) |
Пожилой возраст (n=30) |
|
МДА (мкмоль/л) |
33,2±1,3 |
39,2±1,1* |
|
SH ( мкмоль/л) |
318,6±10,6 |
292,5±7,4* |
|
SH / МДА |
9,91±0,3 |
7,08±0,3* |
* p<0,05 по сравнению с лицами среднего возраста
Оксидативный статус у практически здоровых людей пожилого возраста с факторами риска сердечно-сосудистой патологии
При изучении влияния управляемых факторов риска было выявлено, что по степени значимости они расположены в порядке убывания следующим образом (согласно значению коэффициента SH/МДА): хронический стресс, гиподинамия, гиперхолестеринемия, курение, р<0,05. Наибольшей активностью в плане стимуляции оксидативного стресса обладало курение, коэффициент SH/МДА был наименьшим среди других факторов риска – 3,58±0,1, при этом значение МДА составило 51,3 ± 1,1 мкмоль/л, SH-групп – 184,1 ± 7,3 мкмоль/л. Значимый вклад в стимуляцию процессов ПОЛ вносила гиперхолестеринемия, коэффициент SH/МДА составил 3,93±0,1, уровень МДА был 51,5±1,1 мкмоль/л, SH-групп – 201,3 ± 8,9 мкмоль/л. Несколько меньшей активностью в отношении оксидативных процессов обладали такие факторы риска как гиподинамия (уровень МДА составил 45,1±1,2 мкмоль/л, SH-групп – 255,2±5,4 мкмоль/л, коэффициент SH/МДА – 5,65±0,3) и хрониостресс (уровень МДА составил 43,1±0,7 мкмоль/л, SH-групп – 259,4±8,2 мкмоль/л, коэффициент SH/МДА – 6,01 ± 0,2). Необходимо отметить, что при сравнении колебаний показателей концентрации МДА, SH-групп, значений коэффициента SH/МДА у лиц с наличием факторов риска и без них выявлены статистически достоверные различия. Так, у людей с отсутствием факторов риска показатель содержания МДА составил 41,5±1,2 мкмоль/л, SH-групп – 292,5±7,1 мкмоль/л, коэффициент SH/МДА соответствовал значению 7,04±0,2. При этом показатель МДА был достоверно ниже (p<0,05), чем у людей, которые имели такие факторы риска как курение и гиперхолестеринемия, показатель SH и отношение SH/МДА – выше, чем у людей со всеми изучаемыми факторами риска (p<0,05). Это свидетельствовало об активации оксидативных процессов и снижении антиоксидантной защиты на фоне факторов риска, значимость оксидативного стресса в формировании патологии сердца и сосудов, артериальной гипертензии. Таким образом, оксидативные процессы характеризовались большей напряженностью у практически здоровых лиц пожилого возраста по сравнению с лицами среднего возраста. Кроме того, наличие факторов риска сердечно-сосудистых заболеваний потенцировало прооксидантные процессы в пожилом возрасте.
Оксидативный статус при хронической ишемической болезни сердца
В среднем возрасте при ИБС имело место более низкое содержание МДА в сыворотке крови, чем в пожилом – 34,5±1,2 мкмоль/л и 43,4±1,5 мкмоль/л соответственно, р<0,05; более высокая концентрация SH-групп – 319,8±9,3 мкмоль/л и 291,5 ± 7,4 мкмоль/л соответственно, р<0,05. Коэффициент SH/МДА также свидетельствовал о росте прооксидантных влияний в пожилом возрасте при ИБС, он составил в среднем возрасте – 9,26 ± 0,1, а в пожилом – 6,7±0,2, р<0,05.
Оксидативный статус при железодефицитной анемии
При железодефицитной анемии показатели оксидативного статуса в пожилом возрасте были менее благоприятными. Так, достоверно более высокими значениями у пожилых характеризовался уровень МДА: у пожилых больных он составил 43,2±1,4 мкмоль/л, у лиц среднего возраста – 32,6±1,1 мкмоль/л, p<0,05. Противоположная картина имела место в отношении уровня сульфгидрильных групп – в пожилом возрасте их содержание соответствовало 292,3±7,1 мкмоль/л, в среднем было достоверно больше – 367,5±8,1 мкмоль/л, p<0,05. Соответственно, у пожилых коэффициент SH/МДА был достоверно меньшим – 6,65±0,3 – против 9,22±0,2 у лиц среднего возраста, p<0,05. Таким образом, железодефицитная анемия у пожилых людей способствовала снижению антиоксидантных защитных механизмов и активации проокислительных процессов в достоверно большей степени, чем у людей среднего возраста.
Оксидативный статус при сочетании ишемической болезни сердца и железодефицитной анемии у людей пожилого возраста
При изолированной ИБС и железодефицитной анемии состояние оксидативного статуса не имело достоверных различий (показатели МДА составили соответственно 43,4±1,5 и 43,2±1,4 мкмоль/л, р>0,05; показатели содержания SH-групп соответственно 291,5±7,4 и 292,3±7,1, р>0,05). При сочетании этих заболеваний имели место достоверно более высокие значения МДА (50,1±1,2 мкмоль/л, p<0,05) и меньшие показатели уровня SH-групп (252,4±4,3 мкмоль/л), значение суммарного коэффициента, характеризующего оксидативный стресс, составляло 6,01±0,1 (p<0,05 по сравнению с практически здоровыми пожилыми людьми и с пациентами с монопатологией) (рис. 1). Соответственно, при сочетании ИБС и железодефицитной анемии в пожилом возрасте отмечались достоверно меньшие значения суммарного коэффициента, характеризующего оксидативный статус: при ИБС значение коэффициента составило 6,71±0,2, при железодефицитной анемии – 6,65±0,3, при их сочетании 5,98±0,3 (p<0,05 по сравнению с практически здоровыми пожилыми людьми и с пациентами с одним ведущим заболеванием).
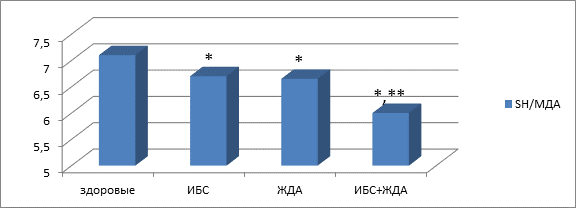
* p<0,05 по сравнению с практически здоровыми пожилыми людьми
** p<0,05 по сравнению с лицами с монопатологией
Рис. 1. Значения коэффициента SH/МДА у пожилых пациентов с ишемической болезнью сердца, железодефицитной анемией и их сочетанием.
Выводы:
1. У пожилых людей без сердечно-сосудистой патологии наблюдается более выраженное снижение маркеров антиоксидантной защиты (по показателю содержания SH-групп в сыворотке крови в среднем на 8,9%) и увеличение содержания малонового диальдегида по сравнению с лицами среднего возраста (в среднем на 18,1%), при этом присоединение управляемых факторов риска развития кардиоваскулярной патологии способствует ухудшению оксидативного статуса.
2. Железодефицитная анемия у пожилых людей способствует снижению антиоксидантных защитных механизмов и активации проокислительных процессов в достоверно большей степени, чем у людей среднего возраста, что проявляется снижением коэффициента SH/МДА в 1,4 раза.
3. Сочетание ишемической болезни сердца и железодефицитной анемии обладает наибольшим прооксидатным влиянием по сравнению со здоровыми пожилыми людьми, а также у больных с монопатологией и сопровождается снижением коэффициента SH/МДА в 1,2 раза.
Рецензенты:
Ильницкий А.Н., д.м.н., профессор, заведующий кафедрой терапии, гериатрии и антивозрастной медицины ФГБОУ ДПО «Институт повышения квалификации Федерального медико-биологического агентства», г. Москва;
Перелыгин К.В., д.м.н., старший научный сотрудник отдела клинической геронтологии Автономной некоммерческой организации «Научно-исследовательский медицинский центр «Геронтология», г. Москва.



