Лекарственные растения рассматриваются как перспективный источник биологически активных соединений (БАС), обладающих антиоксидантной активностью, однако в Государственный реестр лекарственных средств, разрешенных к применению в Российской Федерации, включен лишь антиоксидант диквертин, представляющий собой дигидрокверцетин (таксифолин) – флавоноид из древесины лиственницы сибирской [9, 13]. Если на этом фоне рассматривать значимость антиоксидантных свойств сквозь призму механизма действия некоторых витаминных препаратов (витамины А, С, Е, Р и др.), гепатопротекторов и ангиопротекторов, то актуальность исследований, направленных на поиск новых антиоксидантов, является тем более бесспорной.
В последнее время внимание исследователей привлекают фенольные соединения, среди которых наиболее активно изучаются флавоноиды [1-11, 13-15]. При этом флавоноиды, содержащиеся в лекарственных растениях, представляют интерес не только как потенциальные антиоксидантные препараты, но и как БАС, которые могут оказывать в суммарных растительных средствах, включая галеновые препараты, сопутствующий антиоксидантный эффект, способствующий успешному лечению какого-либо заболевания, причиной или следствием которого являются нарушения в системе антиоксидантной защиты организма [1, 9]. Лекарственное растительное сырье (ЛРС), содержащее флавоноиды, широко применяется в медицинской практике в качестве источника желчегонных, гепатопротекторных, антиоксидантных, ангиопротекторных, диуретических, противовоспалительных, противоязвенных, спазмолитических лекарственных средств [2, 7, 9, 14, 15]. За последние 15-20 лет число фармакопейных видов сырья, отнесенных к флавоноидам, увеличилось с 11 до 30 наименований [10]. Кроме того, флавоноиды имеют статус второй группы БАС в 35 видах лекарственных растений, включая эфиромасличное сырье (цветки пижмы обыкновенной, листья мяты перечной, трава полыни эстрагон и др.), а также виды, содержащие фенилпропаноиды, в частности, гидроксикоричные кислоты (цветки бессмертника песчаного и др.), в случае которых подходы к химической стандартизации достаточно противоречивы, а используемые методики анализа не всегда отвечают параметрам валидации [10].
Цель настоящих исследований – компьютерное прогнозирование активности антиоксидантной активности некоторых флавоноидов, широко встречаемых в лекарственных растениях.
Материал и методы исследования
В качестве объектов исследования служили фармакопейные растения, лекарственное растительное сырье, флавоноиды, выделенные из травы гречихи посевной (Fagopyrum sagittatum Gilib.) (рутин), травы зверобоя продырявленного (Hypericum perforatum L.) (бисапигенин), травы зверобоя пятнистого (Hypericum maculatum Grantz.) (гиперозид) листьев березы бородавчатой (Betula verrucosa Ehrh.) (гиперозид), древесины лиственницы сибирской (Larix sibirica L.) (дигидрокверцетин). Кверцетин, будучи агликоном рутина (3-О-рутинозид кверцетина), получен в результате кислотного гидролиза рутина при нагревании на водяной бане с последующей перекристаллизацией полученного осадка в водном этиловом спирте.
В работе использованы тонкослойная хроматография, колоночная хроматография, спектрофотомерия, 1Н-ЯМР-спектроскопия, масс-спектрометрия, различные химические превращения. 1Н-ЯМР- спектры получали на приборах «Bruker AM 300» (300 МГц), масс-спектры снимали на масс-спектрометре «Kratos MS-30», регистрацию УФ-спектров проводили с помощью спектрофотометра «Specord 40» (Analytik Jena). Воздушно-сухое растительное сырье подвергали исчерпывающему экстрагированию 70 % этиловым спиртом, полученные водно-спиртовые экстракты упаривали под вакуумом до густого остатка и далее подвергали хроматографическому разделению. Хроматографическую колонку (силикагель L 40/100) элюировали хлороформом и смесью хлороформ-этиловый спирт в различных соотношениях. Контроль за разделением флавоноидов осуществляли с помощью ТСХ-анализа на пластинках «Сорбфил ПТСХ-АФ-А-УФ» в системах хлороформ-этанол (9:1), хлороформ-метанол-вода (26:14:3), а также н-бутанол-ледяная уксусная кислота-вода (4:1:2).
Компьютерное прогнозирование антиоксидантной активности осуществляли с использованием программы PASS в виде списка активностей с двумя вероятностями Pa («быть активным») и Pi («быть неактивным») [12]. При этом только активности с Pa>Pi считаются возможными для анализируемого соединения [12].
Результаты исследования и их обсуждение
В ходе исследований с использованием программы PASS определено, что наиболее вероятное проявление антиоксидантной активности (Pa > Pi) возможно в случае флавоноловых гликозидов - рутина и гиперозида (табл. 1), что согласуется с экспериментальными данными по изучению антиоксидантной активности [3, 8]. Достаточно велика вероятность проявления антиоксидантной активности кверцетина (0.681 > 0.005) и бисапигенина (0.665 > 0.005), хотя в меньшей степени, чем в случае препарата сравнения – дигидрокверцетина (0.718 > 0.004) (табл. 1). Следует отметить, что данный прогноз коррелирует с результатами соответствующих экспериментальных исследований антиоксидантной активности [3, 8].
Таблица 1
Прогноз антиоксидантной активности некоторых флавоноидов (Pa > Pi)
|
Вещество
|
|
Pa |
Pi
|
|
Рутин
|
|
0.753 |
0.004
|
|
Гиперозид |
|
0.709 |
0.004
|
|
Кверцетин
|
|
0.681 |
0.005
|
|
Дигидрокверцетин |
|
0.718 |
0.004
|
|
Бисапигенин |
|
0.665 |
0.005
|
Известно, что при интоксикации четыреххлористым углеродом в ткани печени крыс статистически достоверно повышается перекисное окисление липидов (ПОЛ), что проявляется в увеличении содержания малонового диальдегида (МДА), и снижается антиоксидантная защита, связанная с ослаблением активности ферментов супероксиддисмутазы, глутатионпероксидазы, в меньшей степени – каталазы [1, 3, 8]. Ранее, при исследовании влияния на уровень МДА, как конечного продукта ПОЛ, среди флавоноидов в наибольшей мере активен рутин (снижается на 25% по сравнению с контрольной группой) [3, 8]. Далее антиоксидантная активность уменьшается в ряду: дигидрокверцетин, силибин (флаволигнан плодов расторопши пятнистой), кверцетин [3, 8].
Разумеется, результаты исследования влияния субстанций на уровень МДА должны рассматриваться лишь как предварительная оценка их перспективности, так как они могут иметь разный механизм действия и, соответственно, в различной степени влиять на отдельные звенья антиоксидантной ферментативной защиты организма, причем даже в случае близких по строению веществ, например, рутина, гиперозида и кверцетина.
Таким образом, лекарственные растения, содержащие флавоноиды рутин, дигидрокверцетин, гиперозид, кверцетин, бисапигенин, являются перспективным источником антиоксидантных и лекарственных средств. Определено, что наиболее вероятное проявление антиоксидантной активности (Pa > Pi) возможно в случае флавоноловых гликозидов - рутина и гиперозида, достаточно велика вероятность проявления антиоксидантной активности кверцетина (0.681 > 0.005) и бисапигенина (0.665 > 0.005), хотя в меньшей степени, чем в случае препарата сравнения – дигидрокверцетина (0.718 > 0.004).
Вывод
Обоснована целесообразность создания антиоксидантных лекарственных препаратов на основе травы гречихи посевной (рутин), травы зверобоя продырявленного (бисапигенин), травы зверобоя пятнистого (гиперозид), листьев березы бородавчатой (гиперозид), древесины лиственницы сибирской (дигидрокверцетин) и других видов сырья, содержащих вышеперечисленные флавоноиды.
Рецензенты:
Первушкин С.В., д.фарм.н., профессор, заведующий кафедрой фармацевтической технологии государственного бюджетного образовательного учреждения высшего профессионального образования «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Самара;
Дубищев А.В., д.м.н., профессор, зав. кафедрой фармакологии им. заслуженного деятеля науки РФ профессора А.А.Лебедева Государственного бюджетного образовательного учреждения высшего профессионального образования «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Самара.




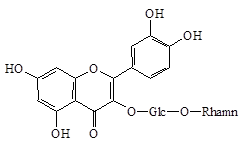 Химическая структура
Химическая структура