Цель исследования
Изучить способность к биопленкообразованию и степень его активности у энтеробактерий, выделенных из различных источников (от больных кишечными инфекциями и из окружающей среды).
Материалы и методы исследования
Способность формировать биопленки изучали у микроорганизмов (условно-патогенных и патогенных энтеробактерий), выделенных от больных кишечными инфекциями, а также водных штаммов, представленных бактериями семейства Enterobacteriaceae (Escherichia coli, Enterobacter spp., Pantoea agglomerans) и неферментирующими грамотрицательными бактериями (Acinetobacter spp.). Всего проведено 282 исследования. Образование биопленок изучали с помощью определения способности штаммов энтеробактерий к адгезии на поверхности 96-луночной полистироловой панели. Микроорганизмы культивировали на мясопептонном бульоне (МПБ) при двух температурах (24°С и 37°С) в течение 48 ч. Из лунок панели удаляли планктонные клетки и окрашивали пленки. Для этого в лунку вносили 150,0 мкл дистиллированной воды и 20,0 мкл 1%-ного кристаллвиолета и инкубировали в течение 45 мин при комнатной температуре. После трехкратного промывания дистиллированной водой в лунки для экстракции краски из пленки добавляли 200,0 мкл 96%-ного этанола и измеряли оптическую плотность раствора при длине волны 492 нм. Интенсивность окрашивания содержимого лунок соответствовала степени пленкообразования. Количественным выражением степени образования биопленок служили значения оптической плотности (ОП), измеряемые на спектрофотометре. Значимость различий полученных показателей определяли по критерию Стьюдента [6, 8].
Результаты исследования и их обсуждение
Свойство формировать биопленки было выявлено у подавляющего большинства протестированных изолятов. При этом условно-патогенные энтеробактерии (Proteus mirabilis, Klebsiella oxytoca, K. pneumoniae, Citrobacter freundii, Enterobacter aerogenes, E.cloacae, Morganella morganii), выделенные больными с кишечными инфекциями, в 100,0% случаев обладали способностью к образованию биопленочных сообществ. Среди шигелл и сальмонелл данное свойство выявлено в 90,0% и 84,2% случаев соответственно. Среди водных изолятов способность формировать встречалась реже: биопленкообразование было отмечено у 67,7% штаммов.
Проведенные исследования показали зависимость биопленкообразования от температурных условий. Так, микроорганизмы, выделенные из организма человека (от больных кишечными инфекциями), чаще образовывали биопленки при температуре, близкой к температуре тела человека. При культивировании при более низкой температуре способность штаммов энтеробактерий формировать биопленки снижалась. Тестирование штаммов на наличие данного признака показало, что у энтеробактерий, выделенных от больных с кишечными инфекциями, формирование биопленок более активно идет при температуре 37°С по сравнению с 24°С. Так, при температуре 24°С способность формировать биопленки выявлена у 60,3% штаммов микроорганизмов, при 37°С – у 93,6% изолятов. Различия носили значимый характер (p<0,05). Данная закономерность выявлена как в отношении условно-патогенных энтеробактерий, так и в отношении патогенов — бактерий родов Salmonella и Shigella. Так, среди условно-патогенных энтеробактерий биопленкообразование при температуре 37°С установлено в 100,0% случаев, при 24°С — в 67,6% случаев, среди сальмонелл — в 84,2% и 57,9% соответственно. У шигелл способность к образованию биопленок при температуре 37°С также встречалась чаще, чем при 24°С (90,0% и 40,0% соответственно).
Водные изоляты, напротив, значимо чаще (р<0,01) формировали биопленку при температуре 24°С. При повышении температуры до 37°С способность водных изолятов к образованию биопленок снижалась (рис.).
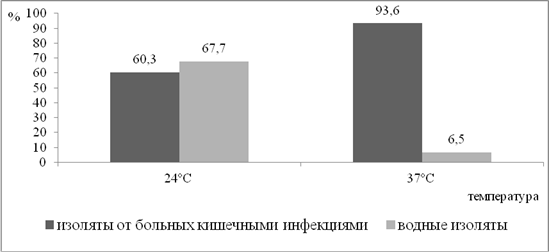
Способность к биопленкообразованию микроорганизмов, выделенных из разных источников, при культивировании при различных температурных условиях (%)
Среди водных штаммов E. coli свойство биопленкообразования установлено только при культивировании при температуре 24°С. Водные изоляты Enterobacter spp. при температуре 24°С обладали данным свойством в 50,0% случаев, при повышении температуры до 37°С встречаемость биопленкообразования снижалась до 12,5%. Аналогичная закономерность отмечена и у неферментирующих грамотрицательных бактерий: среди Acinetobacter spp. при 24°С формировали биопленку 66,7% изолятов, при температуре 37°С – 11,1% штаммов. Следующим этапом работы было изучение степени выраженности процесса биопленкообразования. Сравнение активности пленкообразования (по уровню адсорбции кристалвиолета этанолом) при культивировании в разных температурных условиях показало, что у штаммов, выделенных от больных кишечными инфекциями, при более высокой температуре активность, измеряемая в единицах оптической плотности, была выше при 37°С, чем при 24°С. Превышение оптической плотности пленкообразования в условиях культивирования при температуре 37°С по сравнению с более низкой температурой было отмечено в отношении большинства протестированных возбудителей кишечных инфекций: условно-патогенные энтеробактерии — 0,122 и 0,153 единиц ОП соответственно, Salmonella enterididis – 0,072 и 0,124 единиц ОП соответственно, у Shigella flexneri — 0,04 и 0,074 единиц оптической плотности соответственно. Следует обратить внимание, что у условно-патогенных энтеробактерий была выявлена более высокая плотность биопленок по сравнению с патогенами. Исследование биопленкообразования у водных штаммов бактерий при различных температурных условиях показало, что при более высокой температуре способность исследованных штаммов образовывать биопленки снижалась. При указанной температуре только две культуры обладали изучаемым свойством: E.aerogenes и Acinetobacter spp. (0,032 единиц ОП). У всех других протестированных штаммов при температуре 37°С уровень адсорбции кристалвиолета этанолом в единицах оптической плотности соответствовал фону. Сравнение степени пленкообразования у указанных микроорганизмов при культивировании в разных температурных условиях показало, что при более низкой температуре (24°С) уровень адсорбции кристалвиолета этанолом был выше, чем при более высокой температуре (37°С).
Заключение
Таким образом, проведенные исследования показали, что большинство исследованных микроорганизмов, выделенных от человека (от больных острыми кишечными инфекциями), а также из окружающей среды (водные изоляты), способно к образованию биопленок. При этом у патогенных и условно-патогенных энтеробактерий, возбудителей кишечных инфекций, формирование биопленочных сообществ значимо чаще наблюдалось в условиях культивирования при температуре 37°С; при более низкой температуре способность штаммов формировать биопленки снижалась. У водных изолятов, напротив, данное свойство чаще отмечалось при температуре 24°С. Аналогичная закономерность прослеживалась и в отношении активности биопленкообразования.
Рецензенты:Зоркальцева Е.Ю., д.м.н., профессор, зав. кафедрой туберкулеза ГБОУ ДПО «Иркутская государственная медицинская академия последипломного образования», г. Иркутск;
Верхотуров В.В., д.б.н., профессор, зав.кафедрой технологии продуктов питания и химии, ФГБОУ ВО «Иркутский национальный исследовательский технический университет», г. Иркутск.



