Ключевым положением в проведении экспериментальных исследований с наличием очага хронического гнойного воспаления является выбор или создание адекватной, стандартизованной экспериментальной модели изучаемой патологии. В современной литературе представлены разнообразные экспериментальные модели хронического остеомиелита, преследующие решение разных задач: изучение эффективности применения местных и системных антибактериальных препаратов, способов иммобилизации, методик санации остеомиелитического очага и др. [3, 8].
Для исследования процессов регенерации костной ткани в условиях хронического гнойного воспаления с наличием дефекта используются самые разнообразные технологии создания экспериментального остеомиелитического очага, методики его хирургической санации и замещения. При разработке модели авторы руководствуются характеристиками исследуемого остеопластического препарата, особенностями нормальной анатомии выбранного экспериментального животного, опираясь на типичную морфологическую и микробиологическую картину заболевания. В подавляющем большинстве исследований животным прижизненно проводятся только рентгенологические исследования области оперативного вмешательства. После выведения из эксперимента, как правило, осуществляется качественный гистоморфологический анализ тканей дефекта [2, 4].
Проведение экспериментов на кроликах считается наиболее целесообразным по многим причинам: доступность этих животных, относительная простота обеспечения необходимых условий для содержания, проведения хирургического вмешательства и последующего наблюдения. Кроме этого, их анатомические особенности (крупные трубчатые кости) позволяют нанести необходимый по размеру дефект кости без использования специального инструментария и риска патологических переломов [1, 9].
Описаны разнообразные варианты инфицирующих микроорганизмов, их дозировок и кратности внесения для создания хронического гнойного воспаления. Опубликованы методики создания как одиночных, так и множественных дефектов костной ткани. Одной из наиболее удачных моделей хронического гнойного воспаления костной ткани является методика создания остеомиелитического очага, описанная в работе Матуссис З.Е. (1962). Точная дозировка инфицирующего агента и инородного тела (кварцевого песка) в этой модели не предусматривались. Другой недостаток модели – высокий риск патологического перелома трубчатой кости, а малые размеры дефекта исключают вможность выполнения эффективной хирургической санации. Гноеродный протей, использованный авторами, является не типичным представителем флоры остеомиелитического очага у людей [5, 7]. Для адекватного моделирования важно создание условий для формирования бактериальной биоплёнки и нанесение стандартизованного полостного дефекта [6].
Таким образом, возникает потребность в создании воспроизводимой, обеспечивающей чистоту эксперимента модели костной полости с хроническим гнойным воспалением.
Цель работы: создать стандартизованную экспериментальную модель хронической гнойной костной полости.
Материалы и методы
Эксперименты проводили на 10 кроликах породы «Серый великан» 6-8 месячного возраста весом от 1800 до 2400 г. в отделении экспериментальной хирургии с виварием ФГБУ «ПФМИЦ» Минздрава России в соответствии требованиями «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (Страсбург 18.05.2014г.), согласно приказу Минздравсоцразвития РФ №708н от 23.08.2010г. «Об утверждении правил лабораторной практики». Условия содержания животных в виварии обеспечивали чистоту эксперимента. Выведение животных из эксперимента осуществляли воздушной эмболией под наркозом через 37 суток после введения в эксперимент.
Для подготовки операционного поля удаляли ножницами волосяной покров в области оперативного вмешательства, дезинфицировали растворами антисептиков трехкратно, отгораживали стерильным бельём.
Доступ осуществляли по передней поверхности проксимальной метаэпифизарной области левой большеберцовой кости продольным разрезом с послойным рассечением кожи, подкожной клетчатки, фасции длинной 3,0 см. Острыми крючками разводили края раны. Распатором скелетировали большую берцовую кость на площади 2х1 см. Фрезой диаметром 4,0 мм вдоль оси кости формировали стандартизированный дефект надкостницы, кортикального слоя и губчатого вещества размерами 8,0х4,0 мм и глубиной 4,0 мм (рис. 1). Размеры дефекта контролировали при помощи штангенциркуля ШЦ – 1 с глубиномером и ценой деления 0,1 мм.
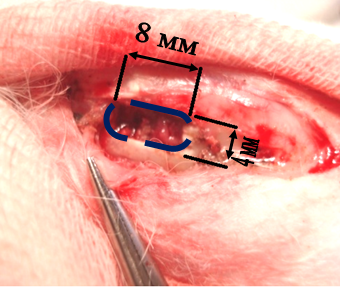
Рис. 1. Стандартизованный дефект большой берцовой кости
В качестве инфекционного возбудителя всем животным применили Staphylococcus Aureus, как наиболее часто выявляемого представителя раневой флоры у пациентов с хроническим остеомиелитом. Использовали музейный штамм Staphylococcus aureus коллекции ГИСК им. Л. А. Тарасевича.
Дефект инфицировали смесью суточной культуры стафилококка в стерильном физиологическом растворе в дозе 40 млн. колониеобразующих единиц (КОЕ) и 0,2 г стерильного кварцевого песка на 1 кг массы тела животного. Кварцевый песок выполнял роль «секвестров» с большой площадью поверхности, что способствовало формированию субстрата для развития хронического гнойного процесса. Завершали операцию ушиванием раны.
Через 72 часа после операции осуществляли пассивное дренирование очага, для чего снимали три шва в проксимальной части раны и разводили её края на протяжении 1 см. Это рассматривали как надежную профилактику генерализации процесса, что исключало риск летального исхода у животных. Одновременно с формированием свища, реинфицировали костную полость культурой Staphylococcus Aureus в дозе 20 млн. КОЕ на 1 кг массы тела кролика. Такие «подсевы» применяли трехкратно с интервалом в 72 часа. Оставшиеся швы кожной раны снимали через 10 суток после оперативного вмешательства. Трёхкратное реинфицирование обеспечило хронизацию гнойного воспалительного процесса (рис. 2).
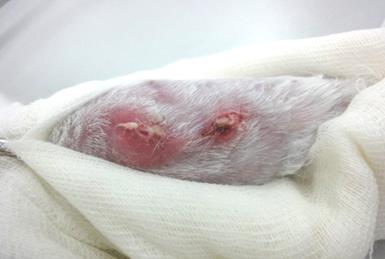
Рис. 2. Хроническая гнойная свищевая костно-мягкотканая рана голени (30 суток после операции).
Для идентификации наличия и топики костного дефекта использовался рентгенологический метод. Рентгенологическое обследование проводили всем животным трёхкратно: интраоперационно после ушивания раны, через 10 суток после формирования дефекта и непосредственно перед выведением. Рентгенографию в двух проекциях выполняли при помощи аппарата «Dira-RC» Компьютерную томографию проводили на аппарате «Toshiba 32 Aquillon», она включала оценку трёхмерной реконструкции сегмента. Визуализировали особенности формы и структуры костной ткани в области очага его точное расположение, конфигурацию.
Микробиологические исследования проводились в лаборатории бактериологии ФГБУ «ПФМИЦ» Минздрава России. Забор биосубстрата для бактериологического анализа выполняли через 14 суток после формирования костного дефекта и непосредственно перед выведением животного из эксперимента. Материалом для исследования служил соскоб со стенок свищевого хода. Идентификацию микроорганизмов производили классическим культуральным методом на анализаторе iEMS Reader FM (Labsystems, Финляндия) с помощью набора тест-систем (Lachema, Чехия).
Наряду с клинико-рентгенологическими и гистоморфологическими данными, подтверждающими формирование хронической гнойной костной полости у экспериментального животного, проводилась динамическая оценка основных показателей общих анализов крови у всех животных через 7, 14, 37 суток от первого внесения инфицирующей смеси в созданный дефект костной ткани.
Результаты:
После прекращения действия наркоза, экспериментальное животное не опиралось на оперированную конечность, поджимая её. Наблюдали гиперемию, локальное повышение температуры, флюктуацию, кролик отдёргивал лапу, что расценивалось как признак боли. Формирование свища приводило к исчезновению флюктуации, отмечали густое гнойное отделяемое в количестве 1-2 мл в сутки. Нарушения функции смежных суставов не определялось. Через 10 дней после оперативного вмешательства наблюдали полное восстановление опороспособности конечности. Гнойно-некротическая рана характеризовалась наличием свищевого хода, дном которого являлась костная ткань. Отмечалось образование участков некрозов мягких тканей и грануляций, легко кровоточащих при зондировании раны. Раневое отделяемое содержало песчинки. У всех животных при микробиологическом исследовании раневого отделяемое выявлена смешанная флора: Staphylococcus Aureus и Escherichia Coli.
Клиническими признаками хронического гнойного воспаления экспериментальной модели считали:
а) существование свищевой гнойной раны на всём протяжении эксперимента после оперативного вмешательства;
б) медленное, мозаичное выполнение раны вялыми, бледными, легко кровоточащими грануляциями;
в) наличие очагов влажного или сухого некроза мягких тканей (кожа, клетчатка, фасция, мышца).
Указанные признаки наблюдали у всех животных. Послеоперационная рентгенография у всех животных выявляла дефект костной ткани в метаэпифизарной области с рентгенологическим просветлением и чередующимися очагами затемнения (рисунок 3А). Участки затемнения обуславливались наличием инородних тел – кварцевого песка. Эти признаки сохранялись до выведения животных из эксперимента. По результатам КТ исследования выявлялся дефект со сторонами 8ммх4мм, который был расположен вдоль оси конечности, имеет чёткие контуры (рис. 3Б).
Через 37 суток на компьютерных томограммах дефект костной ткани имеет неправильную форму, неровные края, свободнолежащие мелкие рентгеноконтрастные объекты в полости, признаки периостальной реакции окружающей очаг.
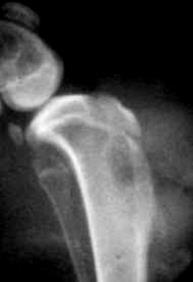
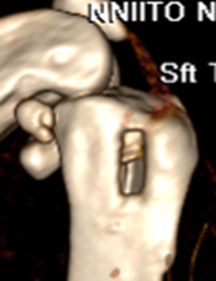
А Б
Рис. 3. А - Рентгенограмма области верхней трети левой голени кролика. Боковая проекция верхней трети левой голени с нанесёным дефектом (1). Б - Интраоперационная трёхмерная реконструкция проксимального метаэпифиза б/берцовой кости с нанесённым дефектом (2).
При гистоморфологическом исследовании образцов тканей области гнойного дефекта выявили признаки хронически протекавшего гнойного воспалительного процесса. Со стороны костномозговой полости в тканях, смежных с дефектом визуализировали картину гнойного воспалительного процесса, прилегающего к костному массиву с наличием участков рассасывания костных фрагментов и формированием абсцессов (рис. 4). Очаги гнойного расплавления выявлялись и со стороны периоста. Гнойный процесс распространялся на кортикальную костную пластинку, отмечались участки её рассасывания и образования в новом дефекте грануляционной ткани, что расценивалось как формирование свищевого хода.
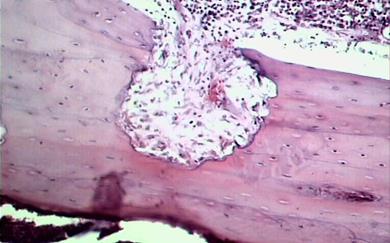
Рис. 4. Участок распада кортикальной костной ткани, прилегающей к дефекту – формирование абсцесса. (×200). 1 — кортикальная костная пластинка, прилегающая к дефекту; 2 — очаг рассасывания костной ткани; 3 — гнойно-воспалительный инфильтрат в костномозговом канале; 4 — периост.
Вокруг отграничивающихся участков воспаления обнаружены разрозненные безостеоцитные костные балки (рис. 5).
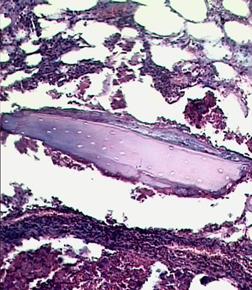
Рис. 5. Безостеоцитный костный фрагмент в области очага хронического воспаления (×200). 1 - очаг гнойного воспаления; 2 - безостеоцитный костный фрагмент; 3 - костный мозг.
Таким образом, разработанная модель обеспечивала формирование хронической гнойной костно-мягкотканой раны с достоверными клинико-инструментальными и морфологическими признаками хронического остеомиелита. Информативным свидетельством хронического гнойного воспаления костной ткани оказались и данные КТ на 37 сутки эксперимента: содержимое очага низкой рентгенологической плотности, периостальная реакция окружающая очаг.
Через 7 суток от начала эксперимента число лейкоцитов возрастает на 18,6 ± 3,1%, тромбоцитов на 14,8 ± 1,7%. Гемоглобин снижается на 15,3 ± 2,4%. Через 14 суток, число лейкоцитов превышает исходные показатели на 10,4 ± 2,1%, тромбоцитов на 14,3 ± 2,3%. Гемоглобин ниже исходных на 10,3 ± 0,5%. Через 30 суток все измеряемые показатели не возвращались к исходным значениям (рис. 6).
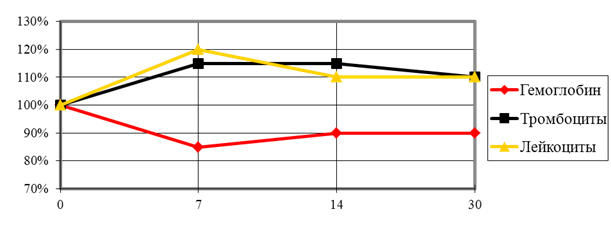
Рис. 6. Динамика лабораторных показателей.
Динамика лабораторных показателей соответствует развитию хронического процесса под влиянием травмы кости, инфекционного фактора и инородных тел. Такие изменения могут служить первыми лабораторными признаками хронизации раневого процесса у экспериментальных животных.
Выводы:
Таким образом, предложенная экспериментальная модель, включающая стандартизованные дозы инфицирующего агента и дефект кости, позволяет достичь формирования хронической гнойной костной раны с признаками хронического остеомиелита, что позволит на ее основе оценивать различные методики санации гнойного очага, хирургического лечения остеомиелитического процесса, эффективности использования остеопластических материалов.
Рецензенты:
Королёв С.Б., д.м.н., профессор, заведующий кафедрой травматологии, ортопедии и военно-полевой хирургии им. М.В. Колокольцева Государственного бюджетного образовательного учреждения высшего профессионального образования «Нижегородская государственная медицинская академия» Министерства здравоохранения Российской Федерации, г. Нижний Новгород;
Ежов И.Ю., д.м.н., заведующий отделением травматологии и ортопедии федерального бюджетного учреждения здравоохранения «Приволжский окружной медицинский центр» федерального медико-биологического агентства, г. Нижний Новгород.



