В настоящее время применение монохромного красного света можно наблюдать как в медицинских учреждениях во время лечебных процедур [4], так и для освещения помещений, для которых всё больше используют в целях энергосбережения светодиодные лампы. При этом исследования по воздействию широкополосного низкоинтенсивного света красного диапазона показывают, что данный тип излучения обладает способностью влиять на функциональное состояние тканей и органов, а также на организм в целом [2]. Однако неизвестно, является ли действие красного света стрессорным для органов иммунной системы, в частности для селезёнки.
Как известно, влияние красного спектра на организм человека будет связано с перестройкой, в первую очередь, нейромедиаторной, эндокринной и иммунной систем [1]. Установлено, что в иммунных процессах участвуют биологически активные вещества, которые синтезируются в иммунокомпетентных органах [3, 5]. В связи с чем, воздействуя на организм мышей монохромным красным светодиодным излучением, можно выявить изменения, которые происходят в биоаминсодержащих структурах селезёнки и прогнозировать изменения иммунных реакций в организме.
Цель данной работы: выявить динамику нейроаминов в биоаминсодержащих структурах селезёнки при облучении мышей монохромным светодиодным излучением длиной волны 630 нм (красный свет).
Задачи исследования:
1. Выявить морфологические и количественные изменения нейроаминов в биоаминсодержащих структурах селезенки при облучении мышей красными лучами спектра.
2. Определить изменения серотонинового индекса (ведущий медиатор) в биоаминсодержащих структурах селезенки при воздействии красными лучами спектра.
Материал и методика исследований
Материалом для исследования была селезёнка 30 мышей-самцов массой 18 гр. Животные были разделены на 2 группы:
1-я - контрольная (15), животные содержались при обычном освещении.
2-я – опытная (15), животные содержались в течение 7 дней с 7.30-17.00 часов при облучении их лампочкой с монохромным светодиодным излучением с длиной волны 630 нм (красный свет). Расстояние от излучателя до опытных животных составило 30 см, что исключает воздействие теплового эффекта и обеспечивает равномерность светового потока.
Все процедуры по уходу за мышами осуществлялись согласно «Правилам проведения работ с использованием экспериментальных животных» (Приказ МЗ РФ от 19.06.2003 № 267).
Органы изымались после гильотинирования. Криостатные срезы свежезамороженных органов толщиной 15 мкм исследовались люминесцентно-гистохимическими методами: метод Фалька – Хилларпа (1962) в модификации Е.М. Крохиной (1969) для выявления моноаминов: катехоламинов (КА) и серотонина (СТ) в содержащих их структурах. Метод основан на реакции конденсации катехоламинов и серотонина с формальдегидом, которые в результате дегидратации превращаются в интенсивно люминесцирующие структуры; метод Кросса с соавт. (1971) для идентификации гистаминсодержащих структур. Метод основан на реакции паров ортофталевого альдегида с гистамином, в ходе которой образуется флуоресцирующее соединение.
С целью определения влияния ведущего нейроамина на общий физиологический процесс определяли серотониновый индекс (Is), являющийся средней от суммы частных соотношений содержания С/КА. Его расчёт проводили по формуле:
IS =S![]() , где С – концентрация серотонина в одной клетке;
, где С – концентрация серотонина в одной клетке;
КА – концентрация катехоламинов в одной клетке;
n – число обследованных клеток;
Is – серотониновый индекс.
Метод спектрофлуориметрии использовался для идентификации и количественного выражения уровней СТ, КА и гистамина в тканевых структурах селезёнки. Для этого на люминесцентный микроскоп Лейка ДМ 1000 была установлена дополнительная насадка ФМЭЛ-1А. Замер интенсивности свечения производился в единицах флуоресценции (условные единицы (у.е.) по шкале регистрирующего прибора-усилителя). Статистическая обработка полученных цифровых данных проведена с помощью пакета программ Microsoft office. Достоверность результатов оценивалась с помощью непараметрического критерия Манна – Уитни.
Результаты исследований и их обсуждение
Нами при люминесцентно-гистохимическом исследовании селезёнки мышей контрольной группы обнаружены нейроамины: СТ, гистамин, КА в ГЛК мантийной зоны, герминативного центра, маргинальной зоны,а также в ГЛК красной пульпы и тучных клетках (табл.1). По литературным данным именно ГЛК являются регуляторами автономных функций лимфоидных органов на клеточном уровне [4].
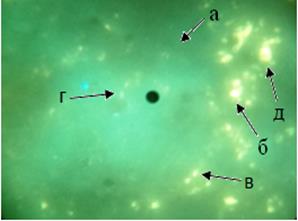
В контрольной группе селезенки в области маргинальной зоны по окружности лимфоидных узелков определялась цепочка из 6–8 крупных ГЛК, люминесцировавших ярко-желтым цветом (рис. 1, 2). В области мантийной зоны лимфоидных узелков и в герминативном центре определялись средней величины одиночные ГЛК. Они люминесцировали менее интенсивно, чем клетки маргинальной зоны (рис. 1).
Таблица 1
Интенсивность люминесценции биогенных аминов в структурах
селезёнки (у.е.)
|
Биоаминсодержащие структуры |
Контрольная группа |
Опытная группа (красный свет) |
||||
|
КА |
СТ |
Г |
КА |
СТ |
Г |
|
|
ГЛК мантийной зоны и герминативного центра |
18,6 ±0,2 |
13,6 ±0,6 |
12,6 ±0,1 |
15,4 ±0,23* |
11,1 ±0,3* |
27,1 ±0,7* |
|
Микроокружение ГЛК мантийной зоны и герминативного центра |
15,2 ±0,3 |
9,1 ±0,2 |
8,7 ±0,06 |
12,1 ±0,6* |
7,8 ±0,3** |
19,9 ±0,11* |
|
ГЛК маргинальной зоны |
14 ±0,2 |
11,5 ±2,2 |
16,5 ±2,0 |
15,3 ±1,1* |
11,9 ±0,42* |
19,9 ±0,4* |
|
Микроокружение ГЛК маргинальной зоны |
9,2 ±0,02 |
7,2 ±0,6 |
12,6 ±0,25 |
11 ±0,2* |
8,6 ±0,5* |
15,7 ±0,3** |
|
ГЛК красной пульпы |
23,9 ±0,25 |
20,4 ±2,2 |
35,5 ±1,2 |
17,8 ±0,9* |
14,1 ±0,7** |
25,2 ±2,1* |
|
Микроокружение ГЛК красной пульпы |
16,8 ±0,9 |
13,1 ±0,7 |
18,3 ±0,1 |
12,9 ±1,2* |
9,8 ±0,3* |
16,8 ±0,7** |
|
Тучные клетки |
13,9 ±0,11 |
13,2 ±0,9 |
23,8 ±1,2 |
13,8 ±0,7* |
11,1 ±0,6** |
18,4 ±0,3* |
|
Микроокружение тучных клеток |
8 ±0,07 |
7,4 ±0,09 |
17,6 ±0,14 |
10,6 ±0,3* |
8,1 ±0,12* |
13,8 ±0,7** |
Примечание: Г – гистамин, СТ – серотонин, КА – катехоламины
ГЛК – гранулярные люминесцирующие клетки
Р£0,05* – по сравнению с контрольной группой.
Р£0,001* *– по сравнению с контрольной группой.
|
|
|
|
Рис. 1. Локализация гистамина в структурах селезёнки контрольной группы мышей. а. лимфоидный узелок. б. гранулярная люминесцирующая клетка маргинальной зоны в. гранулярная люминесцирующая клетка мантийной зоны г. гранулярная люминесцирующая клетка герминативного центра. д. гранулярная люминесцирующая клетка красной пульпы. Метод Кросса. Лейка ДМ 1000. Об. 40. Гомаль 1,7 |
Рис. 2. Локализация КА и серотонина в структурах селезёнки контрольной группы мышей. а. лимфоидный узелок. б. гранулярная люминесцирующая клетка мантийной зоны. Метод Фалька. Лейка ДМ 1000. Об. 40. Гомаль 1,7 |
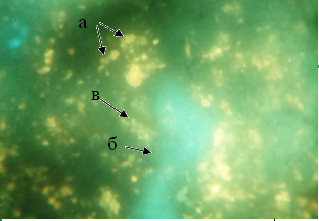
В красной пульпе определялись многочисленные до 15–20 в одном поле зрения клетки размерами 15–16 мкмс крупными гранулами – ГЛК (рис. 3). Они люминесцировали насыщенным желтым свечением. У некоторых из них гранулы были разнокалиберными. Известно, что часть ГЛК относится к макрофагам, а часть из них принадлежит к клеткам APUD-системы [5].
![]()
Рис. 3. Локализация КА и серотонина в красной пульпе селезёнки контрольной группы мышей. а. гранулярная люминесцирующая клетка красной пульпы. б. кровеносный сосуд. в. тучная клетка. Метод Фалька. Лейка ДМ 1000. Об. 40. Гомаль 1,7
Вдоль стенок сосудов и под капсулой селезёнки определялись овальные клетки, люминесцирующие менее интенсивно, чем ГЛК. Внутри клеток были различимы одинаковой величины мелкие гранулы. При параллельных окрасках по Унна такие клетки относятся к тучным (рис. 3).
После семидневного облучения мышей красным светом при исследовании на гистамин выявлено, что в мантийной зоне и в герминативном центре ГЛК были также единичными (рис. 4). Содержание гистамина в них увеличилось в 2,1 раза (табл. 1). При обработке срезов на моноамины обнаружено, что содержание КА и СТ в ГЛК мантийной зоны и в герминативном центре снизилось в 1,2 раза (табл. 1). Микроокружение этих клеток содержало гистамина в 2,3 раза больше по сравнению с контролем, а содержание моноаминов, напротив, снизилось: КА – в 1,3 раза и СТ – в 1,2 раза.
|
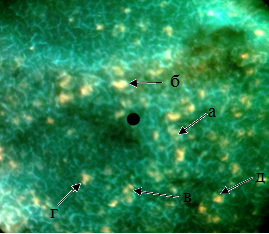
Рис. 4. Локализация гистамина в структурах селезёнки мышей, облучённых красным светом. а. лимфоидный узелок. б. гранулярная люминесцирующая клетка маргинальной зоныв. гранулярная люминесцирующая клетка мантийной зоны. г. гранулярная люминесцирующая клетка герминативного центра. д. гранулярная люминесцирующая клетка красной пульпы. Метод Фалька. Лейка ДМ 1000. Об. 40. Гомаль 1,7 |
Рис. 5. Локализация КА и серотонина в структурах селезёнки мышей, облучённых красным светом. а. лимфоидный узелок. б.гранулярная люминесцирующая клетка маргинальной зоны в. гранулярная люминесцирующая клетка мантийной зоны.г. гранулярная люминесцирующая клетка герминативного центра.д. центральная артерия. Метод Фалька. Лейка ДМ 1000. Об. 40. Гомаль 1,7
|
В опытной группе селезенки в области маргинальной зоны ГЛК были такими же крупными, как и в контрольной группе, и люминесцировали ярким желтоватым свечением (рис. 4, 5). Содержание гистамина в них у мышей, облученных красным светом, возросло в 1,2 раза по сравнению с контролем, а содержание КА и СТ увеличилось в 1 раз. Микроокружение этих клеток содержало гистамина, КА и СТ в 1,2 раза больше, чем у мышей, содержавшихся при дневном свете (табл. 1).
Популяция ГЛК красной пульпы селезёнки мышей, облучавшихся красным светом, была немногочисленной и была представлена в основном ГЛК среднего размера. Содержание КА в них у мышей, подверженных излучению красным светом, снизилось в 1,3 раза, а серотонина и гистамина в 1,4 раза. Микроокружение этих клеток содержало гистамина в 1,1 раз меньше, чем у мышей контрольной группы, а содержание КА и СТ снизилось в 1,3 раза по сравнению с контролем (табл. 1).
В тучных клетках у мышей, облучавшихся красным светом, содержание гистамина снизилось в 1,3 раза по сравнению с контролем, содержание СТ снизилось в 1,1 раз, а содержание КА имело лишь незначительную тенденцию к снижению по сравнению с контрольной группой. Микроокружение этих клеток содержало гистамина в 1,3 раза меньше, чем у мышей контрольной группы, а содержание моноаминов, напротив, увеличилось: КА – в 1,3 раза, а СТ – в 1,1 раз (табл. 1).
Установлено, что у мышей контрольной группы серотониновый индекс во всех структурах селезёнки был ниже единицы. Выявлено, что у мышей, облучённых красным светом, этот показатель также был ниже единицы (табл. 2).
Таблица 2
Серотониновый индекс в биоаминсодержащих структурах селезёнки (у.е.)
|
Биоаминсодержащие структуры |
Контрольная группа |
Опытная группа (красный свет) |
|
ГЛК мантийной зоны и герминативного центра |
0,7±0,05 |
0,7±0,3* |
|
ГЛК маргинальной зоны |
0,8±0,7 |
0,7±0,4* |
|
ГЛК красной пульпы |
0,8±0,11 |
0,8±0,05* |
|
Тучные клетки |
0,9±1,1 |
0,7±1,2* |
Примечание: ГЛК – гранулярные люминесцирующие клетки.
Р£0,05* – по сравнению с контрольной группой.
Таким образом, нами было установлено, что во всех структурах селезёнки у мышей контрольной и опытной групп преобладали катехоламины над серотонином, что говорит о полном контроле со стороны адренергической нервной системы. Кроме того, облучение красным спектром не изменяет соотношение СТ/КА.
Выводы:
1. Облучение мышей монохромным красным светом увеличивает выработку биогенных аминов в ГЛК маргинальной зоны и гистамина в ГЛК мантийной зоны и герминативного центра селезёнки.
2. Облучение красным светом снижает содержание биогенных аминов в ГЛК красной пульпы и в тучных клетках и повышает содержание КА и СТ в микроокружении тучных клеток.
3. У мышей контрольной группы и у мышей, облучённых красным светом, преобладающими медиаторами были катехоламины.