При диспластическом коксартрозе одной из важнейших и тяжелых задач является установка тазового компонента с восстановлением биомеханики тазобедренного сустава и в то же время созданием надежной и долговечной опоры [1; 2]. Некоторые исследования указывают, что у пациентов Crowe IV дисплазии функциональные результаты хуже, чем у пациентов в группах I, II и III по Crowe, ревизии на тазовом компоненте в 2 раза чаще, чем в остальных группах [3]. Chougle установлена корреляция между тяжестью дисплазии и ранним расшатыванием чашки [4].
Современные имплантаты допускают 70% недопокрытия, также применяются дополнительная винтовая фиксация, наклон впадины до 55 градусов, медиализация чаши, смещение центра ротации до 2 см краниально [5]. Применение всех этих методик часто связано с ранней нестабильностью вертлужного компонента до 32% после 15 лет [6] и 53% в среднем спустя 16,6 года [7].
В случае когда все эти приемы не позволяют достичь необходимого покрытия, применяется аутопластика надацетабулярного массива головкой бедренной кости (далее – ГБК).
Цель исследования. Оценить состоятельность костной аутопластики надацетабулярного массива, выполненной из ГБК в отдаленных сроках (свыше 10 лет).
Материалы и методы. За период с 2001 года выполнено 24 эндопротезирования тазобедренных суставов (ЭТБС) 23 пациентам (16 женщин, 7 мужчин) на фоне диспластического коксартроза (ДКА) с замещением дефекта надацетабулярного массива ГБК. Степень ДКА оценивалась по классификации Crowe (табл. 1). Распределение по типам конструкций – в табл. 2.
Таблица 1
Распределение по классификации Crowe
|
Количество человек |
% |
|
|
Crowe 2 |
7 |
29,2 |
|
Crowe 3 |
9 |
37,5 |
|
Crowe 4 |
8 |
33,3 |
Таблица 2
Распределение пациентов по установленным тазовым компонентам
|
Тип протеза |
Кол-во человек |
% |
|
Zweymuller |
15 |
62,5 |
|
Феникс |
2 |
8,3 |
|
Duralock |
1 |
4,3 |
|
ЭСИ |
2 |
8,3 |
|
Aesculap plasmacup |
2 |
8,3 |
|
Zimmer цементный |
2 |
8,3 |
Состояние пластики оценивалось по контрольным обзорным рентгенограммам таза.
В одном случае при асептической нестабильности эндопротеза «Феникс», имплантированного в 2002 г., аутотрансплантат вместе с винтами был взят на гистологическое исследование.
Трансплантат был разделен на 4 части: № 1 – костный фрагмент на границе с чашей; № 2 – центр костного фрагмента; № 3 – винт, фиксировавший трансплантат; № 4 – кость на границе со здоровой костью.
Участки кости фиксировали в 10%-ном растворе нейтрального формалина, декальцинировали в растворе «Биодек R» (Bio Optica Milano, Италия), обезвоживали в градиенте этанола возрастающей концентрации, просветляли в ксилоле и заключали в парафин. Срезы толщиной 5-7 мкм окрашивали гематоксилином и эозином, изучали при увеличении светового микроскопа Axioimager M1 (Zeiss, Германия) до 1200 раз.
Результаты. У 9 пациентов (37,5%) развился асептический некроз аутотрансплантата. 4 мужчины, 5 женщин, средний возраст составил 38 лет. Распределение по классификации Crowe: 2 ст. – 3; 3 ст. – 4; 4 ст. – 2. Распределение пациентов по тазовым компонентам: Zweymuller – 5; «Феникс» – 2; ЭСИ – 1; Aesculap – 1; замена тазового компонента потребовалась в 8 случаях: в 2 случаях – на Zimmer continuum, в 1 – на антипротрузионную чашу Mullera и в 5 – на антипротрузионную чашу ЭСИ.
У 6 (25%) пациентов на рентгенограммах не было признаков асептического некроза аутотрансплантатов (1 мужчина, 5 женщин, средний возраст составил 45 лет). Распределение пациентов по классификации Crowe: 2 ст. – 3; 3 ст. – 2; 4 ст. – 1. Распределение пациентов по тазовым компонентам: Zweymuller – 4; Aesculap – 1; Duralock – 1.
В 9 (37,5%) случаях связь с пациентами была утеряна.
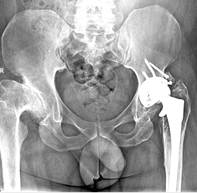
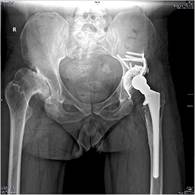
Клинический пример. Пациенту Г. в 2002 г. выполнено эдопротезирование эндопротезом «Феникс». В феврале 2016 г. – реэндопротезирование тазового компонента на антипротрузионную впадину ЭСИ (рис. 1).
|
а) |
б) |
Рис. 1. Пациент Г. Рентгенограммы таза в прямой проекции: а) асептическая нестабильность тазового компонента эндопротеза через 14 лет после первичного ЭТБС с костной пластикой крыши ГБК; б) рентгенография после реэндопротезирования
Результаты гистологического исследования (пациент Г.)
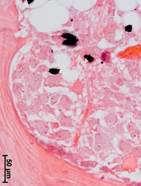
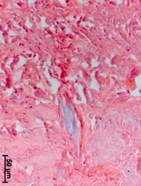
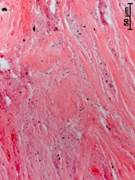
№ 1. Костный фрагмент на границе с чашей. Костная ткань, несколько отдаленная от чаши искусственного сустава, уплотнена. Структуры желтого и красного костного мозга практически отсутствуют. В тканях, заполняющих пространство между костными балками, присутствуют мелкие оптически непрозрачные частицы без заметной клеточной реакции вокруг, скорее всего, фрагменты эндопротеза или частицы талька (рис. 2а).
Ближе к эндопротезу костные балки становятся шире, в некоторых случаях в кости имеются выраженные рубцовые изменения. Иногда в кости были найдены разрастания плотной волокнистой соединительной ткани. Структуры красного и желтого костного мозга были найдены только в единичных наблюдениях. Инородные частицы встречались значительно чаще и были сконцентрированы в определенных участках ткани, в макрофагах (рис. 2б).
Непосредственно у чаши сустава «кость» была представлена разными типами соединительной ткани: от грубой волокнистой до плотной и даже рыхлой волокнистой соединительной ткани. Структуры, характерные для кости, такие как балки, остеоны, костный мозг и пр., найдены не были. В тканях множество разных по размерам оптически непрозрачных фрагментов. Следует отметить наличие единичных фрагментов некротизированной кости без заметной клеточной реакции вокруг (рис. 2в).
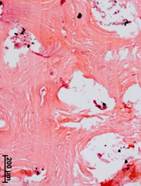
№ 2. Центр костного фрагмента. В центре костного фрагмента костные балки были разрежены, но структура их – уплотнена. Очень редко были найдены структуры красного костного мозга. В биоптате присутствовали разные по величине участки тканевого (костного) бесструктурного детрита, ограниченные уплотненной костью с рубцовыми изменениями и инфильтрированные эритроцитами, непрозрачные фрагменты, без определенной концентрации к каким-то местам (рис. 2г).
|
|
|
|
|
|
а) |
б) |
в) |
г) |
Рис. 2. Данные морфологического исследования костного трансплантата через 14 лет после операции. Костный фрагмент на границе с чашей (а, б, в). Центр костного фрагмента (г)
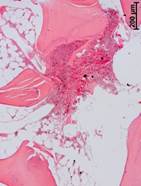
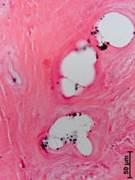
№ 3. Винт, фиксировавший трансплантат. Винт, фиксировавший трансплантат, спаян с окружающими тканями, которые очень плотные, но внешне мало похожие на кость. Микроскопически винт был инкапсулирован грубоволокнистой соединительной тканью с очень плотным расположением волокон и практически без сосудов. В этой ткани присутствовали разные по размерам геморрагии. Диффузно по всей ткани рассеяны оптически непрозрачные частицы. Выраженной клеточной реакции на эти фрагменты найдено не было. Однако в некоторых случаях была отмечена концентрация таких мелких инородных частиц на волокнистых структурах своеобразных псевдокист, имеющих свою капсулоподобную оболочку. Необходимо отметить присутствие на разном удалении от импланта некротизированных костных фрагментов различных размеров. Частиц металла в таких нежизнеспособных фрагментах кости не было (рис. 3 а, б).
|
|
|
|
|
Винт |
а) |
б) |
Рис. 3. Данные, полученные морфологическим методом из тканей, окружающих винт, фиксировавший трансплантат, через 14 лет после операции (а, б)
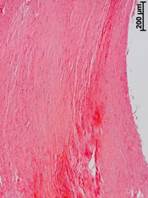
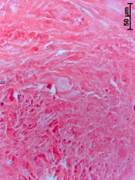
№ 4. Кость на границе со здоровой костью. Граница со здоровой костью. «Здоровая» кость уплотнена, в структурах желтого костного мозга много мелких оптически непрозрачных фрагментов, такие же инородные частицы иногда найдены возле сосудов остеонов. В пограничных отделах костная ткань еще более уплотнена и имеет рубцовые изменения. Непосредственно к такому плотному краю примыкает грубоволокнистая или плотная волокнистая соединительная ткань, содержащая множество очень мелких темных частиц (рис. 4 а, б).
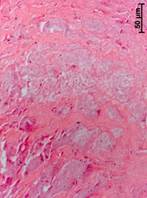
В такой волокнистой соединительной ткани расположены структуры, подобные остеонам или псевдокистам. Внутри таких структур сконцентрировано множество очень мелких пылевидных оптически непрозрачных инородных частиц. Кроме того, там же расположены разные по размерам частицы нежизнеспособной кости (или костного матрикса) и иногда мелкие грануляции (рис. 4 в, г).
|
|
|
|
|
|
а) |
б) |
в) |
г) |
Рис. 4. Данные, полученные морфологическим методом из костного трансплантата через 14 лет после операции. Костный фрагмент на границе со здоровой костью (а, б, в, г)
Обсуждение. Способ создания искусственной опоры для чаши из головки бедренной кости был опубликован в начале 70-х годов [8]. В опубликованных работах среднесрочные результаты были успешными [9; 10]. Тем не менее многие после применения этого метода описывают частую нестабильность до 46% примерно через 12 лет [11-14]. Более поздние исследования свидетельствуют, что эндопротезирование в сочетании с аутопластикой надацетабулярного массива ГБК дает отличные клинические и радиологические результаты даже спустя 15 лет, со 100%-ной вероятностью интеграции трансплантата [15].
В нашем исследовании (пациент Г.) по результатам гистологии основной причиной нестабильности эндопротеза явилось асептическое воспаление, спровоцированное мелкими пылевидными оптически непрозрачными инородными частицами. Эти частицы являются или металлом, фрагментами эндопротеза, или тальком с хирургических перчаток. С другой стороны, тальк на микроскопическом уровне выглядит несколько иначе, для талька в тканях характерно выраженное гранулематозное воспаление. Скорее всего, разрушение поверхности импланта в организме дошло до такой степени, что окружающие ткани практически инфильтрированы металлической пылью.
После имплантации любого инородного тела в тканях начинается асептическое воспаление, приводящее к инкапсуляции этого инородного тела соединительной тканью (кость является одним из типов соединительной ткани). После изоляции чужеродного материала воспаление стихает, но активируется при повреждении пограничного слоя в результате смещения импланта, травмы и т.п.
После попадания в ткани с поверхности эндопротеза такое множество мелких инородных тел не дает возможности для изоляции инородного тела и стихания асептического воспалительного процесса. Каждая частица или их группы окружаются своей собственной капсулой, в результате этого формируются обнаруженные псевдокисты с пылевидными частицами. Кроме того, часть таких частиц фагоцитируется макрофагами и перемещается вместе с ними куда угодно, следствием чего является присутствие пылевидных инородных тел в отдаленных участках «здоровой» кости. Следует отметить, что, согласно литературным данным, инородные тела в макрофагах транспортируются по всему организму и могут быть найдены в отдаленных органах и тканях, в частности силикон после маммопластики в паховых лимфатических узлах.
Поддерживая воспаление возле эндопротеза (грануляции), мелкие частицы не дают возможности формирования костной ткани, фиксирующей этот имплантат. Костная ткань, отдельные остеоны, постоянно формируются для отграничения импланта и быстро некротизируются и лизируются вследствие воспаления и связанных с ним микроциркуляторных расстройств, поэтому были найдены частицы нежизнеспособной костной ткани практически во всех участках биоптата (это не остеонекроз, хотя он тоже может быть, это постоянная регенерация и быстрая деструкция регенерата).
Постепенно, в результате длительного воспалительного процесса, не исключено, что гранулематозного, вокруг импланта формируется плотная волокнистая соединительная ткань с хаотичным расположением волокон. Эта ткань слабо фиксирует эндопротез, он смещается в результате повреждения этой ткани, смещаются и пылевидные фрагменты, и воспаление очень часто активизируется. Также в результате длительной воспалительной реакции край «здоровой» кости уплотняется и приобретает рубцовые изменения (постоянная деструкция и регенерация), а структуры красного и желтого костного мозга атрофируются.
Заключение. Чаще всего костная аутопластика применялась при дисплазии Crowe 3 ст. В 9 (60%) случаях из 15 отслеженных на рентгенограммах наблюдались признаки асептического некроза аутотрансплантата, чаще у мужчин. Результат пластики не имеет корреляции с видом конструкции. Наиболее часто применялась резьбовая чаша Zweymuller (62,5%), т.к. до некоторых пор она считалась золотым стандартом ЭТБС при ДКА. В тех случаях, когда аутотрансплантат не обеспечивает абсолютной стабильности тазового компонента, запускается патофизиологический механизм асептического расшатывания эндопротеза, что является частой причиной неудач.