Сердечно-сосудистые заболевания (ССЗ) являются основной причиной преждевременной смерти и инвалидизации населения, а также источником роста расходов на здравоохранение, главным образом в развитых странах, и все более распространенной проблемой в развивающихся странах [1]. При этом показатели ССЗ и смертности в России одни из самых высоких в Европе [2]. На сегодняшний день остается актуальной и обсуждаемой темой российской системы здравоохранения проблема фатальных аритмий и внезапной сердечной смерти (ВСС), возникающих в связи с общим ростом заболеваемости ишемической болезнью сердца (ИБС). Однако при этом отмечается и увеличение количества случаев возникновения аритмий и ВСС в последующем без установленной ИБС [3]. Особый интерес к ВСС продиктован ее неуклонным ростом, наблюдаемым на протяжении последних десятков лет, в частности тем, что прогрессирующая хроническая сердечная недостаточность (ХСН) и ВСС приблизительно в равной степени являются ведущими первопричинами смерти среди всех ССЗ. Изучение достоверных признаков, позволяющих прогнозировать вероятность возникновения ВСС, является крайне значимым курсом современной кардиологии и аритмологии [4].
Установлено, что ВСС развивается в первые 12 месяцев после возникновения острого инфаркта миокарда (ОИМ) [5], при этом около 30% пациентов, страдающих ИБС, погибают непредсказуемо в результате возникновения фатальных нарушений ритма (НР) [6], таких как желудочковая тахикардия (ЖТ) / фибрилляция желудочков (ФЖ) [7]. Одним из предложенных путей решения этой задачи является проведение своевременного исследования электрофизиологических и структурно-функциональных особенностей сердца у пациентов высокого риска с целью обнаружения экстраполирующих факторов возникновения НР и ситуаций, способных привести к аккумулированию их проаритмогенного влияния [8]. Особый интерес представляют работы, которые тесно связаны с изучением патофизиологических механизмов формирования морфологического субстрата аритмических осложнений, электрически нестабильной структурной перестройки миокарда при этом как самих кардиомиоцитов (КМЦ), так и межклеточного матрикса вследствие длительной ишемии или ОИМ [9].
Цель. Изучить литературные данные о патофизиологических механизмах формирования структурно-морфологических субстратов аритмических осложнений, методике определения предикторов электрофизиологической нестабильности миокарда (интервала QT и его частей), представить анализ об особенностях показателей дисперсии интервалов реполяризации, вариабельности сердечного ритма и поздних потенциалов желудочков у больных, перенесших острый инфаркт миокарда с подъемом сегмента ST (ОИМпST).
Окклюзия сосудов коронарного русла как результат тотального тромбоза приводит к возникновению ОИМпST, что имеет свое отражение и подтверждение на стандартной электрокардиограмме (ЭКГ). Чаще ВСС возникает в первые минуты или часы от начала приступа острой коронарной недостаточности в результате возникновения жизнеугрожающих НР и является главной причиной высокой добольничной летальности [10]. Несмотря на успехи последних лет и развитие сосудистых центров, ремоделирование миокарда происходит у больных ОИМпST невзирая на проведенную положительную реперфузию миокарда. Раннее восстановление перфузии подвергшегося острой ишемии участка миокарда препятствует дальнейшему увеличению зоны гибели КМЦ, снижая тем самым вероятность летального исхода [11]. Это достигается применением фибринолитических препаратов либо выполнением чрескожного коронарного вмешательства (ЧКВ) [12].
Совокупность структурно-функциональных изменений левого желудочка (ЛЖ), происходящих в результате некроза части миокарда, обусловлена осуществлением множества дополнительных биохимических процессов, приводящих к компенсаторной перестройке размеров и объемов камер сердца. Эти изменения объединяются понятием постинфарктного ремоделирования. В последующем возникшие структурно-морфологические и функциональные трансформации ЛЖ являются участниками в формировании электрической нестабильности миокарда. В ряде случаев в результате ремоделирования наступает долгосрочная стабилизация функциональных способностей и геометрических показателей ЛЖ, что обусловливает вполне благополучный прогноз. Однако у другой части больных ремоделирование сопровождается дезорганизацией адаптационных процессов, что приводит к нарушению основных звеньев гемодинамики, резко выраженным и/или неуклонно нарастающим патологическим изменениям ЛЖ, вследствие чего происходит прогрессирующее увеличение объемов ЛЖ, а в последующем присоединяется падение его насосной функции. Электрическое и морфологическое ремоделирование миокарда представляется патогенетическим механизмом формирования самой электрической нестабильности, клиническим проявлением которой является ВСС [13].
Мониторинг ЭКГ представляет собой недорогой диагностический метод первой линии в анализе сдвигов сегмента ST и/или волны T при определении ОИМ. Однако, как доказано в разных исследованиях, оценка критериев ишемии имеет низкий диапазон специфичности – от 10% до 50%, составляя в среднем для мужчин 55,6%, для женщин 37,5% [14]. Структурно-функциональные изменения миокарда ЛЖ сопровождаются нарушением процесса реполяризации в виде увеличения дисперсии интервала QT, что прямо коррелирует со структурно-морфологическими показателями миокарда ЛЖ, при этом удлинение корригированного интервала QTc наблюдается равномерно во время ранней трансмуральной ишемии [11]. Отмечается, что рост показателя дисперсии интервала QTd связан с концентрической и эксцентричной гипертрофией, в то время как изменение составляющей части интервала QT – отрезка JT – зависит от состояния систолической функции миокарда независимо от типа его геометрической модели. В последнее время особое внимание уделяется в качестве предвестников тяжелых НР таким показателям, как интервал QT, его части, дисперсия и их коррекция с частотой сердечных сокращений (ЧСС).
Методика определения дисперсии интервалов реполяризации проводится с использованием данных стандартной ЭКГ в 12 отведениях. Интервал QT измеряется от начала комплекса QRS до конца зубца Т на уровне изолинии. В случае двухфазного зубца Т его длина измеряется до окончательного возвращения Т к изолинии. Если на ЭКГ присутствует зубец U, интервал QT определяется до самой низкой точки кривой между зубцами T и U. Замеры проводятся не менее чем в трех последовательных кардиоциклах в каждом отведении, при этом экстрасистолические и постэкстрасистолические кардиоциклы исключаются из измерений. Если конец зубца Т изоэлектричный, очень низкой амплитуды, то измерения не проводятся, эти отведения исключаются из анализа. С целью стандартизации числа ЭКГ отведений необходимо проводить адекватное измерение QT не менее чем в восьми отведениях. Измеряют следующие интервалы цикла: R-R – от верхушки зубца R до верхушки зубца R кардиоцикла, QT – от начала зубца Q или R, в случае отсутствия зубца Q – до конца зубца Т, QTар – от начала зубца Q/R до верхушки зубца Т, JT – от точки J до конца зубца Т, JТар – от точки J до верхушки (середины) зубца Т, SubТ – от верхушки зубца Т до его конца, к возвращению изоэлектрической линии. На основании этих измерений вычисляются средние показатели интервалов (QTm, QTapm, Jtapm, SubTm) с последующей коррекцией этих интервалов по формуле Базетта [15], так называемые корригированные показатели: QTс, QTapс, JTc, JTapc, SubTc. Дисперсия изученных интервалов вычисляется как разница между максимальными и минимальными значениями интервалов с последующим определением средних величин дисперсий (QTсd, QTapсd, JTcd, JTapcd, SubTcd). При измерении интервала QTap в случае наличия двухфазного зубца Т точкой верхушки принято считать место перехода с одной фазы на другую при равной длительности фаз. При преобладании какой-либо фазы в качестве точки отсчета на зубце Т использовали точку Т в месте верхушки преобладающей фазы. Для вычисления интервалов по формуле Базетта используется следующая формула: 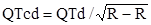 , где QTcd – дисперсия QT, величина длительности интервала QT, корригированного с сердечным ритмом; R-R – длительность кардиоцикла, с.
, где QTcd – дисперсия QT, величина длительности интервала QT, корригированного с сердечным ритмом; R-R – длительность кардиоцикла, с.
Длительность потенциала действия уменьшается в первые часы ишемии, а при ишемии с тахикардией увеличивается [3]. Важным является то, что изменение дисперсии интервала QT и его частей динамично и может отражать как появление нарушения, так и возобновление электрического потенциала в ранней фазе ОИМпST. Установлено, что показатель дисперсии больше 60 мс характеризует больных с высоким риском фатальных аритмий. В ходе начала и пролонгации ишемии наблюдается удлинение QT, особенно в случае ранней трансмуральной ишемии. По сравнению с клинически признанными показателями трансмуральной ишемии (т.е. элевации сегмента ST [≥1 мм]) удлинение QT является самой ранней аномалией ЭКГ [16]. При постановке диагноза ОИМпST после начального постепенного увеличения удлинение QTc-интервала имеет типичный параболический тренд с максимальной длиной, которая достигается после 48–72 часов [17]. Необходимо отметить, что отсутствие восстановления корригированного интервала QTc, а не абсолютного QTc после реваскуляризации сосуда, связанного с инфарктом, коррелирует с пиком ферментов некроза миокарда и с худшим прогнозом [17]. Данная пролонгация QT является предиктором возможного появления желудочковой тахикардии и/или ВСС [18]. Патогенетически для развития аритмии при ОИМпST значимым является механизм наличия микро- и макроструктурных реорганизаций миокарда. Помимо основы на морфофункциональном уровне, параллельно формируются дезорганизационные изменения, такие как преходящая очаговая ишемия, нарушение сбалансированного соотношения уровня электролитов и метаболитов, систолическая дисфункция и диссинхрония миокарда, а также изменения вследствие гормонального дисбаланса и влияния экзогенных токсических субстратов на миокард, в том числе проаритмогенное действие медикаментозных препаратов.
Прогностическими факторами риска возникновения ВСС при ОИМ среди электрофизиологических показателей являются дисперсия интервалов реполяризации, вариабельность сердечного ритма и поздние потенциалы желудочков. Корригированные интервалы QT и JT с ЧСС считаются одними из лучших предикторов для выявления сложных НР или ВСС. Их используют в клинических исследованиях и в практическом здравоохранении, несмотря на влияние других факторов и применение лекарственных средств.
Впервые в 2018 г. [19] получены данные о значительной корреляции между длительностью разницы дисперсии интервала QT (ΔQTс) в месте ранней локализации повреждения миокарда по сравнению с удаленной зоной миокарда без повреждения основной артерии. Многомерным анализом установлено и подтверждено, что ΔQTс и пиковый уровень тропонина I были единственными независимыми предикторами для позднего улучшения перфузии, при этом ΔQTc и фракция выброса (ФВ) ЛЖ были независимыми предикторами показателя индекса «спасенного» миокарда (Salvage index, SI) <60%. Отсутствие восстановления удлиненного интервала ΔQTc в месте локализации инфаркта во время внутрибольничного мониторинга указывает на пациента с повышенным риском потенциально неблагоприятного прогноза по поводу развития фатальных желудочковых НР.
Также применение показателя дисперсии QT предложено для возможности определения степени атеросклеротического поражения сосудов коронарного русла, достоверно выявляемого при нагрузочном тестировании и ангиографии. Была обнаружена зависимость между дисперсией QT и степенью поражения коронарных артерий. Показано, что дисперсия QT при нагрузке и в состоянии покоя у лиц без коронаросклероза составляют 570 и 450 мс, с атеросклеротическими изменениями в одном сосуде – 750 и 620 мс, при двухсосудистом поражении – 640 и 590 мс, при трехсосудистом – 780 и 480 мс соответственно [20]. Также выявлена достоверная корреляция между показателем дисперсии интервала JT и числом летальных исходов у больных ИБС. За 2 года наблюдения летальность в группе обследуемых больных с дисперсией интервала QT менее 60 мс составила 9,5%, а при превышении 100 мс уровень смертности превышал 70%. Специфичность и чувствительность этого показателя, превышающего значение в 68 мс у больных с вызываемой ЖТ и у здоровых лиц, составляют 75% и 45% соответственно. Дисперсия JT является значимым дополнительным экстраполирующим фактором вероятности появления ЖТ, несмотря на невысокую специфичность показателя.
Важным представляется изменение дисперсии QT в ранней фазе острого инфаркта, так как оно динамично и может отражать восстановление электрического потенциала. С целью мониторинга вероятного возникновения жизнеугрожающих НР представляется возможным применение измерения интервала QT на ЭКГ и его параметры [21]. Так, степень дисперсии более 60 мс характеризует больных с высоким риском фатальных аритмий. Доказано, что при этом аномальная реполяризация сердца тесно связана с ЖТ / ФЖ. Ишемия и само повреждение усугубляют сердечную дисперсию реполяризации, и ЖТ / ФЖ может привести к летальному исходу в ранней стадии ОИМпST.
Во время изучения ЭКГ лиц, не страдающих заболеваниями сердечно-сосудистой системы, установлено, что QTd не зависит от ЧСС в широком диапазоне частот. При этом QTd коррелирует с желудочковыми НР при проведении сердечной ресинхронизирующей терапии у больных с тяжелой систолической дисфункцией. Односторонние преобразования обусловлены разницей по длительности и обширности ишемии миокарда, состоянием тканево-клеточного состава в поврежденной зоне, влиянием вегетативной нервной системы, воздействием противоишемических препаратов и т.д. В 2018 г. были получены данные о появлении доказанного дополнительного прогностического маркера оценки реполяризации и ее дисперсии – интервал и его дисперсия от пика верхушки зубца Т до его окончания (SubT, SubTcd) [22], которые эффективно участвуют в прогнозе ЖТ / ФЖ в острой фазе, а также аномальную сердечную функцию в хронической фазе ОИМпST с оценкой параметров синусового ритмического комплекса по отношению к реполяризации сердца. Установлено, что использование как самого интервала QT, его дисперсии, так и его частей, таких как SubT, имеет независимый характер изменений от других сопутствующих факторов при прогнозировании ЖТ / ФЖ в острой фазе ОИМпST [23], что соответствует дисперсии QTd и высоко коррелируют между собой. При сравнении показателей длительности комплекса QRS, максимального интервала QTс, дисперсии QTс, вариабельности сердечного ритма и экстрасистол простое определение QTс и QTd играет достоверно лучшую роль в идентификации больных с угрожающей ВСС. Устойчивую желудочковую тахикардию удается индуцировать у всех больных с показателем дисперсии интервала QT, превышающим 120 мс, в меньшей степени у больных с показателем дисперсии в рамках 90–120 мс и ни у одного обследуемого с показателем менее 90 мс [19]. Сочетанное определение дисперсии QT с другими показателями (вариабельностью сердечного ритма, поздними потенциалами желудочков, ФВ и др.) является более информативным в определении возникновения сложных НР и/или ВСС у больных ОИМпST вне зависимости от его фазы [24].
Заключение. Все вышесказанное показывает, что проблемы НР и ВСС как результат электрофизиологического ремоделирования КМЦ, межклеточного матрикса и формирования субстратов электрической нестабильности в виде очагов локальной ишемии, повреждения и некроза, а в последующем с формированием зон некроза у больных ОИМпST до и после перенесенной реперфузии требуют продолжения исследований дополнительного внедрения и практического применения. Определение удлинения дисперсии интервала QT и его частей, таких как QTapd, JTd, JTapd, SubTd, и отсутствие восстановления удлиненного интервала QT и его частей в месте локализации инфаркта во время внутрибольничного мониторинга указывают на пациента с повышенным риском потенциально неблагоприятного прогноза по поводу развития фатальных желудочковых НР.
Изменения в разные периоды ОИМпST дисперсии интервала QT и его частей могут применяться как предикторы НР и ВСС у больных на фоне реперфузии миокарда с оценкой длительности времени до полного восстановления кровотока в тромбированной артерии. Перспективной представляется разработка изучения дополнительного влияния на показатели вариабельности интервала QT антагонистов минералокортикоидных рецепторов, селективных β-адреноблокаторов и донаторов синтеза оксида азота, ингибиторов ангиотензинпревращающего фермента, статинов и других фармакологических средств, а также восстановления кровотока ЧКВ и регресса изменений структурно-морфологических, электрофизиологических субстратов гибернации и апоптоза у больных ИОМпST.



