Роль хронического дуоденального стаза (дуоденостаза) в происхождении вторичных поражений двенадцатипёрстной кишки, поджелудочной железы, желчного пузыря и желчевыводящих путей достаточно изучена [1; 2]. Дуоденальный стаз возникает вследствие нарушения моторно-эвакуаторной функции двенадцатиперстной кишки (ДПК) при многих заболеваниях гепатопанкреатодуоденальной зоны. Одним из основных признаков его является длительное повышение давления в ДПК. Дуоденальная гипертензия создаёт условия для нарушения замыкательной функции большого сосочка двенадцатиперстной кишки (БСДК) и сфинктера Одди и возникновения дуоденобилиарного и дуоденопанкреатического рефлюксов. С другой стороны, поражения БСДК воспалительного или травматического характера приводят к развитию рубцового стеноза или недостаточности сфинктера Одди, нарушениям оттока желчи и панкреатического сока, прямому рефлюксу из ДПК в протоковую систему поджелудочной железы или желчевыводящие пути [1; 3; 4]. Дуоденобилиопанкреатический рефлюкс способствует возникновению, прогрессированию и поддержанию воспалительных и деструктивных процессов в поджелудочной железе и желчевыводящих путях, желчном пузыре. Это, в свою очередь, приводит к гипотонии, а затем - к атонии и стойкому парезу ДПК, что, в свою очередь, усугубляет дуоденальный стаз [2].
Одним из вероятных механизмов эндогенного инфицирования изначально стерильных некротических масс при остром панкреатите (ОП), наряду с гематогенной транслокацией микрофлоры кишечника, является дуоденобилиопанкреатический рефлюкс [3-6]. Наиболее вероятным это представляется при остром панкреатите билиарного происхождения, в том числе после наружного дренирования желчевыводящих путей или эндоскопической папиллосфинктеротомии. Однако в доступной литературе данный вопрос практически не представлен. Поэтому изучение роли повышенного дуоденального давления и возможности дуоденобилиопанкреатического рефлюкса, как источника эндогенного инфицирования при остром некротическом билиарном панкреатите, является актуальным.
Цель исследования: улучшение результатов лечения острого тяжелого и средней тяжести некротического билиарного панкреатита путем применения активной дуоденальной декомпрессии.
Материал и методы исследования. Дизайн исследования: открытое проспективное контролируемое (когортное) исследование у 65 больных острым некротическим панкреатитом.
Критерии включения: больные с острым тяжелым и средней тяжести некротическим панкреатитом билиарного происхождения, в 1А-Б фазе течения заболевания.
Критерии исключения: пациенты с острым панкреатитом любой этиологии легкой степени тяжести; больные с острым тяжелым и средней тяжести некротическим панкреатитом алкогольно-алиментарного, травматического, послеоперационного и иного происхождения; пациенты с острым тяжелым и средней тяжести некротическим панкреатитом любой этиологии, во 2 фазе течения заболевания.
В работе использовали современную классификацию острого панкреатита Российского общества хирургов (2014) [7; 8].
В исследование включены 65 (35,9%) из 181 поступившего в клинику больного с острым некротическим панкреатитом, соответствовавших критериям включения и исключения, в возрасте от 21 до 89 лет; 61 (93,8%) из 65 пациентов – в трудоспособном возрасте до 60 лет, в среднем (М±σ) 48,7±12,3 года. Мужчин было 40 (61,5%), женщин 25 (38,5%).
Все пациенты были разделены на 2 группы – основную (40) и контрольную (25), сопоставимые по демографическим показателям и тяжести заболевания (таблица 1).
Таблица 1
Распределение больных сравниваемых групп по полу, возрасту и тяжести течения некротического билиарного панкреатита (абс., %)
|
Показатель/группа |
Контрольная группа, n1=25 |
Основная группа, n2=40 |
P |
|
Мужчины |
15 (60%) |
25 (62,5%) |
>0,1 |
|
Женщины |
10 (40%) |
15 (37,5%) |
>0,1 |
|
18-44 года |
8 (32%) |
17 (42,5%) |
>0,1 |
|
45-59 лет |
15 (60%) |
21 (52,5%) |
>0,1 |
|
≥60 лет |
2 (8%) |
2 (5%) |
>0,1 |
|
ОП средней степени |
19 (76%) |
29 (72,5%) |
>0,1 |
|
ОП тяжелой степени |
6 (24%) |
11 (17,5%) |
>0,1 |
С момента поступления всем 65 пациентам обеих групп проводили интенсивную инфузионную терапию, подкожное введение ингибиторов панкреатической секреции, антибактериальную и тромбопрофилактику, введение ингибиторов протонной помпы или Н2-блокаторов в стандартных дозировках согласно современным рекомендациям [3; 4; 7].
Всем 65 пациентам были выполнены операции наружного дренирования желчевыводящих путей и раннего открытого дренирования сальниковой сумки с рассечением перипанкреатической брюшины, как одновременные, так и гетерохронные.
Во время лапаротомии всем 65 пациентам в нисходящий отдел ДПК проводили назодуоденальный зонд.
В контрольной группе (25 больных) в нисходящий отдел ДПК проводили одноканальный зонд с внутренним диаметром 5-8 мм. В основной группе устанавливали двухканальный зонд, один канал которого заканчивался в желудке, а второй, с внутренним диаметром 5 мм – в двенадцатиперстной кишке.
Всем 65 пациентам интраоперационно измеряли внутриканальное давление в ДПК методом открытого катетера с использованием аппарата Вальдмана, затем вводили в дуоденальный зонд (канал зонда) 15 доз непатогенного штамма М-17 E.сoli (препарата «Колибактерин» для внутреннего (перорального) применения, производства ФГУП «НПО «Микроген», РУ № ЛСР-004224/09) по методу Я.Д. Витебского (1992). После введения препарата у 25 больных контрольной группы назодуоденальный зонд подтягивали, перемещая его конец в желудок для пассивного дренирования; в основной группе (40 человек) дуоденальный порт двухканального зонда пережимали до окончания вмешательства.
В обеих группах повторные введения колибактерина проводили через зонд (желудочный канал зонда) в желудок, за 1 сутки до забора желчи, на 2 и 4 сутки после операции. Забор желчи для микробиологического исследования выполняли через 1, 3 и 5 суток после вмешательств, с помощью стерильного катетера, путем аспирации желчи из желчевыводящих путей через холецистостомическую или холедохостомическую трубки, вводили в транспортную среду и немедленно доставляли в микробиологическую лабораторию ЛПУ. Идентификацию тестового возбудителя в пробах желчи выполняли стандартными методами.
В обеих группах в послеоперационном периоде назогастральную и назогастродуоденальную интубацию продолжали в течение 5-6 суток (до восстановления перистальтики кишечника). Уход за зондами в послеоперационном периоде осуществляли путем регулярного промывания их канала 40-50,0 мл физиологического раствора (каждые 3-4 часа). Назогастральную декомпрессию в обеих группах осуществляли в пассивном режиме, а назодуоденальную, в основной группе – путем постоянной активной аспирации с разрежением 15-20 мм рт. ст.
Измерение давления в ДПК у больных в послеоперационном периоде проводили в утренние часы, в положении Фоулера. В течение 2-4 часов до исследования избегали введения препаратов, влияющих на двигательную активность кишечника.
У 25 пациентов контрольной группы, на 5 сутки после операции, с помощью фиброгастродуоденоскопии конец назогастрального зонда продвигали в нисходящий отдел ДПК и выполняли измерение внутриканального давления. После измерения зонд удаляли или возвращали в полость желудка.
У всех 40 больных основной группы измерение давления в ДПК выполняли ежедневно с 1 по 5 сутки послеоперационного периода через дуоденальный канал зонда.
Изучали сравнительную динамику показателей внутриканального давления в ДПК, долей обнаружения тестовой культуры непатогенного штамма М-17 E. coli в исследованных пробах желчи, частоту и распространенность инфекционных осложнений некротического билиарного панкреатита в процессе лечения.
Полученные результаты обрабатывали статистическими методами с использованием стандартного пакета прикладных программ (MS Exсel 7.0, MedCalc 11.2). Для межгрупповых сравнений применили параметрический критерий Т (Стьюдента) и непараметрические - χ2 Пирсона и точный метод Фишера (ТМФ), при уровне доверительной вероятности p<0,05.
Результаты исследования и их обсуждение. Во время операции у всех больных обеих групп сравнения выявили повышение внутриканального давления в ДПК. Среднее давление в ДПК составило 162,2±17,3 и 166,4±16,7 мм вод. ст. (М±σ), в основной и контрольной группах соответственно (p<0,05) (рисунок).
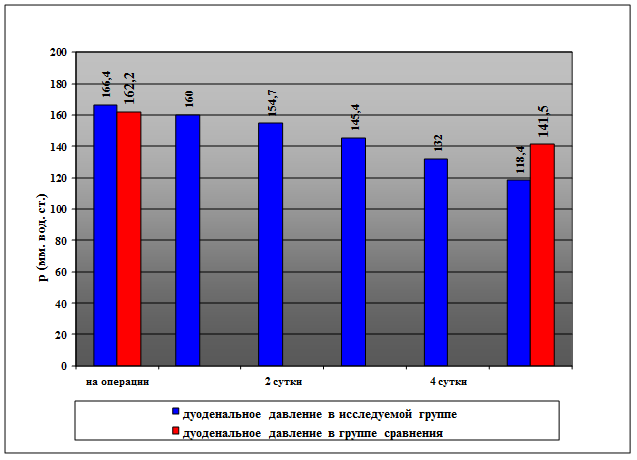
Динамика среднего внутриканального давления в ДПК в группах больных при использовании активной дуоденальной декомпрессии и без нее (мм вод. ст.)
В последующие дни активной дуоденальной декомпрессии отметили постепенное снижение среднего внутриканального давления в ДПК у больных основной группы: через 1 сутки после операции оно составило 160,0±17,5 мм вод. ст., через 2 - 154,7±18,4 мм вод. ст., через 3 суток – 145,4±19,0 мм вод. ст. Через 4 суток средний показатель давления в ДПК составили 132,0±16,3 мм вод. ст.
Через 5 суток после операции внутриканальное давление в ДПК снизилось до 118,4±17,2 мм вод. ст. В тот же срок у больных контрольной группы интрадуоденальное давление составило 141,5±18,6 мм вод. ст.
Очевидно, что внутриканальное давление в ДПК значительно снижалось с 4 суток после вмешательств и приближалось к статистической норме через 5 суток. Поэтому изучение динамики внутриканального давления и продолжение активной декомпрессии ДПК позднее 5-6 суток послеоперационного наблюдения считали нецелесообразным.
Таким образом, в основной группе больных, с применением активной зондовой декомпрессии канала ДПК, отметили более быстрое снижение дуоденального давления.
В результате проведенного микробиологического исследования обнаружили, что у 18 (72%) из 25 больных контрольной группы и у 21 (52,5%) из 40 - основной, в первые сутки после операции из желчи был выделен тестовый штамм кишечной палочки М-17 E.сoli (р<0,05), что расценили, как результат дуоденобилиарного рефлюкса вследствие дуоденальной гипертензии и функциональной недостаточности БСДК (таблица 2).
Таблица 2
Частота выявления тестовой культуры микроорганизмов в желчи пациентов сравниваемых групп в зависимости от сроков послеоперационного наблюдения (абс., %)
|
Показатель/группа |
Контрольная группа, n1=25 |
Основная группа, n2=40 |
P |
|
1 сутки |
18 (72%) |
21 (52,5%) |
<0,05 |
|
3 сутки |
20 (80%) |
15 (37,5%) |
<0,05 |
|
5 сутки |
15 (60%) |
9 (22,5%) |
<0,05 |
На 3 сутки послеоперационного периода положительный результат микробиологического исследования в контрольной группе выявили у 20 (80%) из 25 больных, в основной - у 15 (37,5%) из 40 пациентов (р<0,05).
Через 5 суток после операции в контрольной группе наличие тестовых микроорганизмов в желчи отметили у 15 (60%) из 25 пациентов, а в основной – у 9 (22,5%) из 40 (р<0,05).
Таким образом, к 5 суткам послеоперационного периода наблюдали отчетливую тенденцию к снижению частоты инфицирования желчи тестовой культурой кишечной палочки в основной группе больных (с 52,5% до 22,5%, р<0,05) и незначительное изменение этого показателя - у пациентов контрольной группы (с 72% до 60%, р>0,1).
В процессе дальнейшего наблюдения за больными обеих групп сравнения развитие инфекционных осложнений некротического панкреатита выявили у 26 (40%) из 65 пациентов (таблица 3). В контрольной группе больных – без выполнения активной дуоденальной декомпрессии, эти осложнения развились у 14 (56%) из 25, а в основной группе – только у 12 (30%) из 40 пациентов (р<0,05).
Таблица 3
Частота и распространенность инфекционных осложнений некротического билиарного панкреатита у пациентов сравниваемых групп в процессе лечения (абс., %)
|
Показатель/группа |
Контрольная группа, n1=25 |
Основная группа, n2=40 |
P |
|
Стерильный НП |
11 (44%) |
28 (70%) |
<0,05 |
|
Инфицированный НП |
14 (56%) |
12 (30%) |
<0,05 |
|
Отграниченные |
4 (16%) |
7 (17,5%) |
>0,1 |
|
Распространенные |
10 (40%) |
5 (12,5%) |
<0,05 |
Отграниченные гнойные осложнения инфицированного панкреонекроза развились в контрольной группе у 4 (16%) из 25 больных, а в основной - у 7 (17,5%) из 40 (р>0,1). Распространенные инфекционные осложнения наблюдали у 10 (40%) из 25 пациентов контрольной и 5 (12,5%) из 40 – основной групп исследования (р<0,05).
Таким образом, у пациентов основной группы, в сравнении с контрольной, после выполнения активной продленной дуоденальной декомпрессии выявили снижение частоты распространенных гнойных осложнений некротического билиарного панкреатита. Частота развития отграниченных инфекционных осложнений в группах - существенно не различалась (р>0,1).
Как следует из данных литературы, при некротическом билиарном панкреатите развивается не только повышение давления в желчевыводящих путях, но и дуоденальная гипертензия, обусловленная парезом кишечника и сдавлением ДПК воспалительно измененными головкой поджелудочной железы и окружающими ее тканями [7; 9; 10]. Наружное дренирование желчевыводящих путей, в условиях дуоденальной гипертензии, в результате уменьшения градиента давлений в желчных протоках и канале ДПК способствует увеличению частоты дуоденопанкреатобилиарного рефлюкса, что повышает вероятность инфицирования как желчевыводящих путей, так и очагов асептического панкреонекроза [6-8].
Проведенные нами клиническое, дуоденоманометрическое и микробиологическое исследования в сопоставимых группах оперированных больных с тяжелым и средней тяжести некротическим билиарным панкреатитом в 1А-В фазе течения, с выполнением послеоперационной активной дуоденальной декомпрессии и без таковой, позволили сделать заключение о том, что метод позволяет не только ускорить нормализацию внутриканального давления в двенадцатиперстной кишке, но и снизить частоту инфицирования некротического панкреатита и развития его распространенных гнойных осложнений.
Выводы
1. Внутриканальное давление в двенадцатиперстной кишке пациентов с тяжелым и средней тяжести некротическим билиарным панкреатитом в 1А-В фазе течения при выполнении активной продленной дуоденальной декомпрессии снижается быстрее, чем у больных без активной декомпрессии ДПК, и приближается к статистической норме уже к 5 суткам послеоперационного периода.
2. Активная послеоперационная декомпрессия ДПК у больных с тяжелым и средней тяжести некротическим билиарным панкреатитом в 1А-В фазе течения обеспечивает снижение частоты дуоденобилиарного рефлюкса с 52,5% до 22,5%, инфицирования очагов некроза 56% до 30% и распространенных гнойных осложнений с 40% до 12,5%.



