Фибрилляция предсердий (ФП) является наиболее распространенной формой существующих аритмий, которая наблюдается у 1–2% от общей численности населения, и эта цифра, по данным исследований, скорее всего, увеличится в ближайшие 50 лет [1]. Наиболее часто ФП возникает при различных нозологиях: артериальной гипертензии (АГ), ишемической болезни сердца (ИБС) и хронической сердечной недостаточности (ХСН) [2]. В связи с большой распространенностью и социальной значимостью ФП продолжается изучение причин и механизмов развития данной аритмии. Механизмы аритмогенеза имеют некоторые закономерности развития и взаимосвязаны с основной патологией сердца [3]. Важную роль в формировании фибрилляции предсердий у больных артериальной гипертонией играют сопутствующие коморбидные заболевания, такие как сахарный диабет (СД), ожирение (АО), хроническая обструктивная болезнь лёгких (ХОБЛ) [4].
В наблюдательном исследовании обнаружено, что сахарный диабет и/или артериальная гипертензия ассоциированы с развитием ФП. При этом ассоциация сахарного диабета и артериальной гипертензии с ФП была значительной при учете сердечно-сосудистых факторов риска [4]. Ожирение является частым спутником и лидирующим фактором риска развития АГ и способствует структурно-функциональной перестройке миокарда, описанной как феномен липотоксичности. Последняя включает в себя аккумуляцию триглицеридов в миокарде, что приводит к миокардиальному стеатозу и формированию последующей дилятации полостей сердца. Несмотря на большое количество проведенных исследований в этой области, патогенез появления и прогрессирования ФП до конца не изучен [5].
Предполагается, что усиление локального воспаления в бронхах, легочной паренхиме и сосудах оказывает системное воздействие и способствует прогрессированию ХОБЛ, развитию атеросклероза и сердечной патологии у данных пациентов. Существует ряд предположений о взаимосвязи кардиоваскулярной патологии и ХОБЛ, в основе которой лежат гипоксемия, эндотелиальная дисфункция, оксидативный стресс, цитокиновый дисбаланс, избыточная сосудистая жесткость [6].
В настоящее время общепризнанно, что с течением времени ФП имеет тенденцию к прогрессированию от коротких и редких эпизодов аритмии до появления устойчивой постоянной формы ФП [7]. Пароксизмальная ФП сохраняется в течение нескольких десятилетий только у небольшой части пациентов. По оценкам ряда исследований, частота перехода из персистирующей в постоянную форму ФП составляет от 20 до 30% в течение 1-3 лет наблюдений [8]. Эти процессы лежат в основе влияния циклического стресса на ремоделирование [9]. В настоящее время в развитии ФП большое внимание уделяется маркерам фиброза и активно изучается роль одного из главных маркеров фиброза сердечно-сосудистой системы галектина-3 [10]. Известно, что фиброзирование миокарда, формирование дисфункции и ремоделирования сердечной мышцы при сопутствующих коморбидных состояниях приводит к развитию ФП и ХСН [11]. Недостаточно известными на сегодняшний день остаются морфофункциональные, нейрогуморальные маркеры фибрилляции предсердий в сочетании с артериальной гипертонией и коморбидными заболеваниями экстракардиальной природы и их роль в прогрессировании ФП и развитии ХСН.
Цель исследования: оценить особенности клинических, биохимических проявлений и изучить роль маркеров фиброза в стратификации риска фибрилляции предсердий у больных с артериальной гипертонией в сочетании с экстракардиальными коморбидными заболеваниями.
Материалы и методы исследования. В обсервационном когортном исследовании наблюдались 253 мужчины 35-65 лет с АГ и ФП, в том числе 57 – с АГ, ФП (пароксизмальная и персистирующая форма) и хроническим обструктивным заболеванием легких (ХОБЛ) – I группа; 63 – с АГ, ФП и сахарным диабетом - II группа, 53 – с АГ, ФП и абдоминальным ожирением (АО) – III группа и 83 пациентов с АГ, ФП без сопутствующей патологии (контроль). Верификация диагноза ФП – на основании документально зарегистрированных эпизодов этой аритмии по данным электрокардиографии (ЭКГ). Определение формы ФП было согласно Национальным рекомендациям по диагностике и лечению фибрилляции предсердий (РКО/ВНОА/АССХ, 2017). Критериями исключения также стали ХБП, патология печени и легких с нарушением их функции, заболевания щитовидной железы, инсульты, ИБС. В работе оценивались клинические, антропометрические и лабораторные показатели, результаты инструментальной диагностики: ЭКГ, СМЭКГ, ЭхоКГ. Протокол трансторакальной ЭхоКГ выполнен в соответствии с рекомендациями Американской ассоциации эхокардиографии (ASE) в М- и 2D-режимах на аппарате Vivid 7 (General Electric, USA). Уровень галектина-3 был определен в сыворотке крови методом иммуноферментного анализа с помощью набора «Human Galectin-3 ELISA kit; eBioscience» (Bender MedSystems GmbH, Австрия), минимальная концентрация определения - 0,12 нг/мл. Определение концентрации NT-proBNP с использованием набора реагентов «NTproBNP – ИФА – Бест».
Структурированный сбор данных для исследования осуществлялся в электронные таблицы, в табличных данных выполнялось исследование на полноту и наличие ошибок ввода, проводился разведочный анализ данных для выявления выпадающих значений. Проверенные данные обрабатывались методами статистического анализа. Эмпирические распределения данных испытывались на согласие с законом нормального распределения по критериям Шапиро-Уилка, Андерсона-Дарлинга, Крамера - фон Мизеса, Лиллиефорса и Шапиро-Франциа. Вследствие малого количества показателей, согласованных с нормальным распределением в исследуемых группах, для сравнения использовались непараметрические критерии. Множественное сравнение групп проводилось критерием Краскелла-Уоллиса. Для сравнения бинарных и категориальных показателей применялся точный двусторонний критерий Фишера. Многофакторной логистической регрессией выявлялись значимые предикторы осложнений. Оптимальные модели многофакторных регрессий строились методами прямого и обратного шага. Проверка статистических гипотез проводилась при критическом уровне значимости р = 0.05, т.е. различие считалось статистически значимым, если p < 0.05. Нижняя граница доказательной мощности бралась равной 80%. Программный инструментарий: все статистические расчёты проводились в программе Rstudio (version 0.99.879 – © 2009-2016 RStudio, Inc., USA, 250 Northern Ave, Boston, MA 02210 844-448-121, [email protected]).
Результаты исследования и их обсуждение
Исследуемые группы различались по возрасту, так, средний возраст больных I группы – 59±7,2 года, и III группы 60±4,1 года был достоверно выше, чем в группе контроля - 57±2,1 года (p<0.001*). При сравнении биохимических показателей оказалось, что у пациентов I, II и III группы были достоверно выше значения мочевины, креатинина и калия крови, чем в контрольной группе (табл. 1). При оценке липидного спектра достоверные различия были получены только в отношении ХС ЛПВП, значения которого были наибольшие в группе контроля (табл. 1). Нами также изучалось содержание мозгового натрийуретического пептида и галектина-3, как маркеров, отражающих процессы ремоделирования и фиброза миокарда у больных фибрилляцией предсердий в сочетании с артериальной гипертонией. Так, средний уровень NT-proBNP во всех исследуемых группах оказался выше: в I группе составил 123,8 пг/мл [42.92; 157.02], р<0.001, по сравнению с группой контроля 67.99 пг/мл [33.5; 115.2], во II группе 149.27 пг/мл [51.11; 156.85], р=0.387, достоверно превышая значение этого показателя в группе контроля р<0.001, в III группе контроля, р<0.001. Несмотря на то что все средние значения укладываются в рекомендуемый референсный интервал, у больных в I группе все же обнаружены наибольшие значения данного показателя, а у 19,1% из них он превышал референсные значения (150 пг/мл).
У больных АГ с ФП уровень галектина-3 в сыворотке крови был выше всего в группе 1 - 36.02 нг/мл [13.03; 65.31], (р=0.005). Хотя следует отметить, что у пациентов всех трех групп значения маркера ремоделирования статистически значимо выше относительно группы контроля. Таким образом, во II группе содержание галектина-3 составило 29.44 нг/мл [12.7; 97.73] р=0.001, в III группе - 17.8 нг/мл [11.32; 51] р=0.009, в группе контроля - 19.23 нг/мл [4.97; 40.99] соответственно (рисунок).
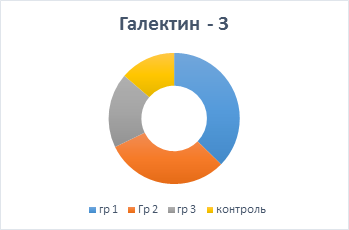
Уровень галектина-3 во всех клинических группах
Таким образом, полученные данные подтверждают возможную роль галектина-3 как биологического маркера фиброза и ремоделирования миокарда у больных ФП с наличием АГ и ХОБЛ, ожирения и сахарного диабета.
Вместе с оценкой биохимических показателей ремоделирования миокарда проводилась инструментальная оценка ремоделирования левого желудочка. Оказалось, что ИММЛЖ в группе контроля был достоверно выше - 143 г/м2 [125; 157], чем у больных I группы - 118 г/м2 [106.5; 131], p<0.001, II группы - 118 [106.5; 131], p<0.001 и III группы - 121 [107; 132] p<0.05. Размеры ЛП во всех исследуемых группах были сопоставимы. Конечно-диастолический размер ЛЖ (КДР) во всех представленных группах был достоверно выше. Так, КДО в I группе - 5.8 см [5.55; 6.35], чем в контрольной группе - 5.2 см [4.6; 6.0], p=0.042, во II группе 5.9 см [5.8; 6.6], p=0.05, и в III группе 5.7 см [5.5; 6.4], p=0.05 (таблица).
Биохимические, гемодинамические данные и инструментальные показатели ремоделирования миокарда
|
Переменные |
Группа контроль N = 83 МЕД [ИКИ] |
Группа АГ+ФП+ХОБЛ N =57 МЕД [ИКИ] |
Группа АГ+ФП+СД N = 63 МЕД [ИКИ] |
Группа АГ+ФП+АО N = 53 МЕД [ИКИ] |
|
Возраст |
57 [52; 63] |
61 [55; 64.5] |
50 [42.5; 54] |
60 [55; 62] |
|
Липидный спектр, ммоль/л |
5.02 [4.16; 6.04] |
4.79 [3.85; 5.44] |
4.96 [3.89; 5.66] |
5 [4.37; 5.64] |
|
ЛПНП |
2.42 [2.13; 3.02] |
2.57 [1.49; 3.11] |
2.59 [1.49; 3.41] |
2.57 [2.03; 3.18] |
|
ТГ |
1.4 [1.04; 1.85] |
1.4 [1.08; 1.93] |
1.4 [1.05; 1.93] |
2.31 [1.79; 3.44] |
|
ЛПВП |
2.4 [1.22; 2.72] |
1.48 [1.33; 1.68] * |
1.48 [1.33; 1.7] * |
1.41 [1.24; 1.54] * |
|
Глюкоза, ммоль/л |
5.89 [5.34; 6.27] |
6.02 [5.47; 7.15] |
6.72 [5.47; 9.15] |
6.05 [5.61; 7.2] |
|
Калий, ммоль/л |
4 [3.8; 4.2] |
4.3 [4.1; 4.43] * |
4.3 [4.1; 4.43] * |
4.2 [4.04; 4.43] * |
|
Мочевина, ммоль/л |
5.4 [4.6; 6.76] |
5.72 [5.3; 7.39] * |
6.28 [5.3; 7.39] * |
6.21 [5.31; 7.63] * |
|
Креатинин, мкмоль/л |
101.7 [94.92; 117.29] |
112.55 [105.09; 118.65] * |
112.55 [109.16; 124.84] * |
106.45 [96.38; 118.65] * |
|
NTproBNP, пг/мл |
67.99 [33.5; 115.2] |
123.2 [43.55; 132.2] * |
149.02 [40.92; 156.34] * |
117 [96; 165.5] * |
|
Галлектин, нг/мл |
14.05 [7.06; 14.76] |
36.02 [13.03; 65.31] * |
29.44 [12.7; 97.73] * |
19.78 [13.28; 53.01] * |
|
ИММЛЖ, г/м^2 |
143 [125; 157] |
100 [95; 108.5] * |
118 [106.5; 131] * |
121 [107; 132] * |
|
САД, мм рт. ст. |
154 [145; 165] |
154 [144.5; 165] |
146 [139; 163.5] |
146 [140; 164] |
|
ДАД, мм рт. ст. |
83 [78; 88] |
80 [74; 81] |
80 [70; 86.5] |
82 [78; 88] |
|
ЧСС, уд. в мин. |
75 [67; 78] |
73 [64; 77] |
73 [67; 77] |
69 [67; 77] |
|
ЛП, см |
4.6 [4.4; 5] |
4.7 [4.6; 5.1] |
4.6 [4.15; 5.2] |
4.5 [4.3; 5] |
|
КДР, см |
5.2 [5.0; 6.2] |
5.8 [5.55; 6.35] * |
5.9 [5.8; 6.6] * |
5.7 [5.5; 6.4] * |
|
ФВ, % |
60 [55; 65] |
57 [53.5; 62] |
59 [54; 64.5] |
60 [58; 65] |
Примечание: символом * обозначены статистически значимо различающиеся показатели.
При анализе статистических взаимосвязей предикторов рецидивирования ФП (рФП) после восстановления синусового ритма на фоне пароксизмов, в I группе (АГ+ФП+ХОБЛ) выявлены следующие статистически значимые взаимосвязи: стадия ХСН (p = 0.049) - увеличение стадии ХСН на одну единицу увеличивает шансы повторной аритмии в 1.47 [1.01; 2.17] раза; снижение содержания сывороточного содержания К + на одну единицу повышает риск рПФ в 5.123 [4.121; 6.431] раза (р< 0,005); увеличение галектина-3 (p < 0.001) на 1 нг/мл достоверно увеличит риск рПФ в 3,2 [1.06; 3.76] раза.
Риск рецидивирования ФП в группе I можно рассчитать на основании статистически значимых показателей (табл. 1), которые выявлены с помощью формулы многофакторной регрессии:
P 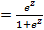 , где z = 1.82.ЛП* + 0.41. ХСН ФК* + 0.01. креатинин* + 0.35. К+ *+ 0.003 галектин-3 *
, где z = 1.82.ЛП* + 0.41. ХСН ФК* + 0.01. креатинин* + 0.35. К+ *+ 0.003 галектин-3 *
P – риск рецидивирования ФП; 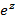 – функция экспоненты в степени z.
– функция экспоненты в степени z.
Из однофакторных моделей при оценке прогрессирования ФП в группе II (АГ+ФП+ГП) выявлены отдельные достоверные предикторы: ХСН стадия (p < 0.001), c увеличением стадии ХСН на 1 ст. увеличиваются шансы прогрессирования ФП в 3587.32 [367.48; 136729.32] раза; c увеличением ЛП (p = 0.004) на 1 см увеличивается риск рФП в 5.04 [1.8; 16.18] раза; биохимические показатели также достоверно увеличивают риск прогреcсирования ФП, так, увеличение NT-PROBNP на 1 пг/мл (p = 0.041) ведет к возрастанию риска рФП в 1.01 [1; 1.02] раза; увеличение галлектина-3 (p = 0.004.) на 1 нг/мл увеличивает риск прогрессирования ФП в 7.04 [2.57; 13.1] раза, c увеличением ОХ (p = 0.048) на 1 ммоль/л увеличиваются шансы в 2,7 [2.44; 3.52] раза; c увеличением ЛПНП (p = 0.02.) на 1 ммоль/л – в 1.87 [1.49; 2.71] раза, повышение ИММЛЖ (p < 0.001.) на 1 г/м риск увеличивает шансы рФП в 22 [13; 31] раза.
Риск рецидивирования ФП в группе II можно рассчитать на основании статистически значимых показателей (табл. 1), которые выявлены с помощью формулы многофакторной регрессии:
P 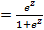 , где z = 2.51 *ХСН стадия - 0.01*ИММЛЖ + 1.12* ЛП + 2.08* NT-PROBNP + 2.06* Галлектин-3 + 1.00*ОХ – 0.16*ЛПНП – 0.03*ТГ
, где z = 2.51 *ХСН стадия - 0.01*ИММЛЖ + 1.12* ЛП + 2.08* NT-PROBNP + 2.06* Галлектин-3 + 1.00*ОХ – 0.16*ЛПНП – 0.03*ТГ
P - риск прогрессирования ФП, 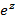 – функция экспоненты в степени z.
– функция экспоненты в степени z.
У пациентов III группы (АГ+ФП+СД) также выявлены отдельные статистически значимые предикторы: увеличение ХСН ФК (p = 0.010), на 1 повышает шансы рФП в 1.52 [1.11; 2.11] раза; увеличение ЛП (p = 0.001) на 1 см повышает шансы рФП в 3.04 [1.64; 5.98] раза, c уменьшением ФВ (p = 0.016) увеличиваются шансы рецидива ФП в 1.06 [1.01; 1.12] раза; увеличение глюкозы (p = 0.04) на 1 ммоль/л повышает шансы рФП в 1.41 [1.03; 2.01] раза; с увеличением галлектина-3 (p = 0.001.) на 1 нг/мл увеличивается риск прогрессирования ФП в 4.02 [2.57; 13.1] раза.
Риск рецидивирования ФП в группе III можно рассчитать на основании статистически значимых показателей (табл. 1), которые выявлены с помощью формулы многофакторной регрессии: P 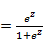 , где z = 0.33* ХСН стадия + 1.12* ЛП + 1.00*ФВ + 2.06* глюкоза + 0.002*галлектин-3
, где z = 0.33* ХСН стадия + 1.12* ЛП + 1.00*ФВ + 2.06* глюкоза + 0.002*галлектин-3
P – риск прогрессирования ФП, 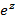 – функция экспоненты в степени z.
– функция экспоненты в степени z.
Изучение предикторов прогрессирования фибрилляции предсердий в IV группе (АГ+ФП+АО) выявило отдельные, связанные между собой статистически значимые предикторы: c увеличением стадии ХСН на 1 увеличивается риск прогрессирования ФП в 2134.12 [367.48; 116729.32] раза; c увеличением ЛП (p = 0.004) на 1 см увеличиваются шансы рФП в 5.04 [1.8; 16.18] раза; с увеличением КДР (p = 0.012) на 1 см вырастут шансы рФП в - 5.612 [5.27; 5.736] раза, c увеличением NT-proBNP (p = 0.041) на 1 пг/мл увеличиваются шансы рФП в 1.01 [1; 1.02] раза; а с увеличением галлектина-3 на 1 нг/мл увеличивается риск рФП в 6.43 [2.29; 18.95] раза.
Риск рецидива ФП в группе IV можно посчитать по следующей формуле:
Формула многофакторной регрессии для предсказания риска прогрессирования ПФ в группе ЭИТ+МТ
P 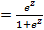 , где z = 0.33* ХСН стадия - 0.01*КДР + 1.12* ЛП + 2.08* NT-proBNP 1,23 *галлектин -3 + 1.00*
, где z = 0.33* ХСН стадия - 0.01*КДР + 1.12* ЛП + 2.08* NT-proBNP 1,23 *галлектин -3 + 1.00*
P – риск прогрессирования ФП, ez – функция экспоненты в степени z.
Таким образом, предикторы возникновения и прогрессирования фибрилляции предсердий, а также риска повторной госпитализации у больных с артериальной гипертонией и экстракардиальной патологией можно рассчитать на основании проведенной формулы.
Выводы
1. У больных артериальной гипертонией и фибрилляцией предсердий в сочетании с экстракардиальной патологией достоверно выше мочевина, креатинин и калий по сравнению с больными без наличия экстракардиальных заболеваний.
2. Повышенный уровень галектина-3 является не только маркером фиброза миокарда, но и, возможно, служит предиктором возникновения ФП у больных с сахарным диабетом, ожирением, хронической обструктивной болезнью лёгких.
3. У больных артериальной гипертонией и фибрилляцией предсердий в сочетании с экстракардиальной патологией ИММЛЖ по сравнению с группой контроля оказался достоверно ниже.
4. Риск повторной госпитализации у больных с фибрилляцией предсердий и артериальной гипертонией в сочетании с экстракардиальной патологией можно рассчитать на основании представленной в настоящем исследовании математической формулы.



