Рак молочной железы (РМЖ) продолжает оставаться одной из наиболее значимых медико-социальных проблем, поскольку за последние десятилетия не отмечено ни значительного снижения первичного выявления этой патологии (по среднемировым оценкам – 46,3 на 100 тыс. населения, более 40% от всех злокачественных опухолевых процессов у женщин) [1, 2], ни существенного прогресса в предотвращении рецидивов РМЖ, метастазирования опухолевых клеток, что влияет на качество жизни пациентов и их выживаемость (смертность – 13,0 на 100 тыс.). Следует отметить, что около 19% случаев РМЖ диагностируется у женщин в возрасте от 30 до 49 лет, 44% случаев – у женщин в возрасте 65 лет и старше [2]. Одним из безусловных достижений последних десятилетий является снижение смертности от РМЖ в ряде развитых стран, особенно в молодом возрасте, что в основном связывают с внедрением программ раннего скрининга РМЖ с помощью маммографии и разработкой новых, более эффективных противоопухолевых препаратов [3]. В то же время важно подчеркнуть, что во многих развивающихся странах смертность от РМЖ не снижается или растет, что обусловливает общее увеличение смертности от РМЖ в мире в последние десятилетия.
Такая динамика заболеваемости и смертности от РМЖ обусловливает необходимость всестороннего изучения данной патологии, особенно факторов риска, генетической предрасположенности, молекулярных механизмов прогрессирования опухолевого роста, метастазирования опухолевых клеток, а также выделения маркеров прогноза исхода заболевания после проведения хирургического и/или химиотерапевтического лечения [4, 5]. К ценным прогностическим маркерам выживаемости при РМЖ наряду с гистологическим типом опухоли и степенью ее злокачественности относят так называемую вовлеченность регионарных лимфатических узлов в опухолевый процесс, а именно наличие или отсутствие в них метастазов [6]. По данным некоторых авторов, при вовлеченности в опухолевый процесс 10 и более аксиллярных лимфатических узлов риск смерти от РМЖ в течение 10 лет возрастает на 70% по сравнению с теми индивидами, у которых в патологический процесс вовлечены 1–3 лимфатических узла [7]. В связи с этим большое внимание в последнее время уделяется выяснению значимости, надежности и безопасности биопсии аксиллярных лимфатических узлов при РМЖ для установления их метастатического статуса до и после неоадъювантной химиотерапии и, как следствие, для оценки эффективности лечения и определения возможной продолжительности жизни [8–10]. Не все авторы одинаково высоко оценивают диагностическую и прогностическую значимость биопсий лимфатических узлов, нередко подчеркивают, что она разнится в зависимости от гистологических вариантов РМЖ, эффективности химиотерапии или статуса лимфатических узлов после химиотерапии [8, 11], но все исследователи считают необходимым продолжение детального изучения лимфатических узлов при РМЖ с целью получения дополнительной информации о характере их структурной реорганизации, в том числе и при отсутствии в них метастазов.
Анализ литературы свидетельствует о том, что основное внимание при изучении регионарных лимфатических узлов уделяется выяснению их метастатического статуса и его изменению после химиотерапии. Другие структурные преобразования лимфатических узлов, как правило, не оцениваются, что не позволяет устанавливать весь спектр негативных эффектов злокачественного опухолевого роста, в том числе РМЖ, на функционально и анатомически связанные с неопластическими очагами органы и ткани. Значительная структурная реорганизация лимфатических узлов, которые относятся к периферическим органам иммунной системы, может негативно влиять на созревание иммунокомпетентных клеток и, как следствие, на развитие иммунных реакций, что может усугублять состояние онкологических больных, снижать качество их жизни после химиотерапевтического и хирургического лечения [12]. Следует также отметить недостаточное использование структурно-функциональных характеристик лимфатических узлов без метастазов для разработки прогностических критериев не только долгосрочной выживаемости, но и развития коморбидной патологии с учетом агрессивности опухолевого процесса.
Цель работы – с помощью комплексного патоморфологического анализа с применением методов морфометрии и иммуногистохимии изучить выраженность склеротических процессов и интенсивность ангиогенеза в аксиллярных лимфатических узлах пациентов на разных стадиях РМЖ.
Материал и методы исследования
Материалом исследования послужили аксиллярные лимфатические узлы без метастазов, удаленные во время мастэктомии у 104 больных, находившихся на лечении в отделении маммологии в 2009–2014 гг. с диагнозом «рак молочной железы». По классификации «TNM» пациенты соответствовали T1N0M0 (52 пациента, возраст – 47,1±13,0 лет), T2N0M0 (43 пациента, возраст – 47,5±12,9 лет) и T3N0M0 (9 пациентов, возраст – 50,0±11,3 лет). Во всех группах исследования, сформированных в соответствии со стадией РМЖ, пациентки в возрасте 40–50 лет составляли около одной трети (соответственно 27, 28 и 33% от всех пациентов на I, II и III стадиях РМЖ). По гистологическому строению у всех женщин опухоли были представлены неинфильтрирующим внутрипротоковым РМЖ (14 случаев) и инфильтрирующим протоковым РМЖ (90 случаев), в том числе инфильтрирующим папиллярным (54 случая) и инфильтрирующим тубулярным (36 случаев) РМЖ. Неоадъювантное противоопухолевое лечение у женщин не проводили в связи с отсутствием показаний. Все больные в предоперационном периоде получали симптоматическое лечение и коррекцию сопутствующих заболеваний. Группу сравнения составили подмышечные лимфатические узлы 14 умерших женщин (возраст – 44,4±10,2 года), ранее находившихся на лечении в ГБУЗ НСО «Городская клиническая больница № 1», без онкологических заболеваний и следов от перенесенных операций и травм на груди.
Исследования выполнены в соответствии с этическими принципами проведения медицинских исследований с участием людей в качестве субъектов исследования, изложенных в Хельсинкской декларации Всемирной медицинской ассоциации.
Подмышечные лимфатические узлы фиксировали в 10%-ном растворе нейтрального формалина и обрабатывали по стандартной методике для заключения в парафин. Срезы окрашивали гематоксилином и эозином и по ван Гизону. Для иммуногистохимической оценки степени выраженности ангиогенеза использовали моноклональные антитела к CD34-антигену Dako reagents kit. Обработку срезов проводили в соответствии с рекомендациями производителя (Dako, Дания). Окрашенные срезы изучали в световом микроскопе Axioimager M1 (Zeiss, Германия).
Морфометрический анализ структурных компонентов подмышечных лимфатических узлов проводили с использованием объективов х10 (тестовая площадь – 1 400 000 мкм2) и х20 (тестовая площадь – 350 000 мкм2) с использованием программного обеспечения морфологического модуля Axiovision (Zeiss, Германия). На каждом срезе проводили по 5 измерений. Определяли объемную плотность CD34-позитивных структур во всем органе и раздельно в корковом и мозговом веществе, краевом синусе, корковом плато, паракортексе; аналогичным образом оценивали объемную плотность соединительной ткани (при окраске по ван Гизону).
Статистическую обработку результатов проводили с использованием статистической программы MS Excel 7.0 (Microsoft, USA). Вычисляли среднее значение, ошибку среднего, а также коэффициент корреляции по Пирсону (для оценки корреляционных связей между показателями васкуляризации и склеротической трансформации, а также между стадией РМЖ и уровнем развития соединительной ткани или показателями васкуляризации в лимфатических узлах в целом и отдельно в каждой из их структур). Межгрупповые различия определяли по критерию Стьюдента; статистически значимыми считали различия при p<0,05.
Результаты исследования и их обсуждение
В аксиллярных лимфатических узлах женщин из группы сравнения строма была представлена умеренно выраженной соединительной тканью, которая и в корковом, и в мозговом веществе выявлялась преимущественно вдоль сосудов (рис. 1, а). Небольшие соединительнотканные прослойки выявлялись также вокруг лимфоидных узелков. Отмечался умеренный отек паренхимы, обусловленный посмертными изменениями. Капсула органа была неравномерно разволокнена.
а 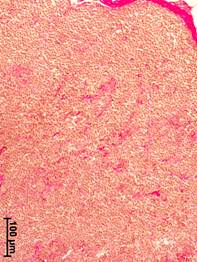 б
б 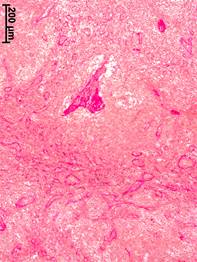 в
в 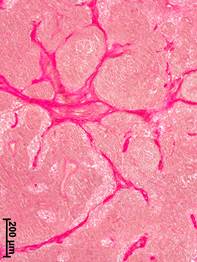
Рис. 1. Морфологические изменения аксиллярных лимфатических узлов при разных стадиях рака молочной железы. Окраска по ван Гизону.
а – корковое вещество, отсутствие рака молочной железы; б – мозговое вещество, II стадия; в – мозговое вещество, III стадия
В аксиллярных лимфатических узлах пациентов при I стадии РМЖ следует отметить незначительное утолщение капсулы (объемная плотность – 1,55±0,60%, в группе сравнения – 1,36±0,49%), ее неравномерное разволокнение. В корковом веществе наблюдались небольшие скопления коллагеновых волокон, особенно по ходу кровеносных сосудов. Незначительно утолщались соединительнотканные прослойки вокруг лимфоидных узелков, в самих узелках коллагеновые волокна не выявлялись. В мозговом веществе склеротические процессы были выражены в большей степени, чем в других отделах. В мозговых тяжах и трабекулах формировалась тонкая коллагеновая сеть, которая в некоторых случаях охватывала большое количество клеточных элементов.
При II стадии РМЖ капсула аксиллярных лимфатических узлов была утолщена по сравнению с группой сравнения на 36% (объемная плотность – 1,85±0,67%). В корковом веществе разрастания коллагеновых волокон наблюдались не только в трабекулах по ходу промежуточных синусов, но и непосредственно в лимфоидной паренхиме. Вокруг лимфоидных узелков появлялись утолщенные пучки коллагеновых волокон, признаки склероза в виде тонкой сети из коллагеновых волокон регистрировались также в самих узелках. Значительной склеротической трансформации подвергались мозговые тяжи и трабекулы (рис. 1, б). В мозговых синусах наблюдалось формирование многослойных фиброзных структур, которые напоминали контуры сосудов, имели часто ветвистую форму и, вероятно, отражали процессы сосудистой мальформации, обусловленной опухолевым процессом.
На III стадии РМЖ отмечалось наиболее значительное утолщение капсулы аксиллярных лимфатических узлов (объемная плотность – 4,2±0,84%) – в 3 раза по сравнению с группой сравнения и в 2,7 раза по сравнению с I стадией РМЖ (p<0,05). В корковом веществе формировались широкие прослойки соединительной ткани, которые располагались преимущественно субкапсулярно и по ходу кровеносных сосудов и лимфатических синусов. Часто регистрировались гнездные скопления многослойных концентрических образований из коллагеновых волокон. Отмечались выраженные склеротические изменения лимфоидных узелков, как их центральных, так и периферических зон. Наиболее значительной склеротической трансформации подвергалось мозговое вещество аксиллярных лимфатических узлов. Обширные прослойки соединительной ткани формировались по ходу мозговых тяжей и трабекул (рис. 1, в). В некоторых случаях происходило фрагментирование мозгового вещества соединительной тканью, можно было говорить о формировании крупноячеистого соединительнотканного остова.
По данным морфометрического анализа, по мере прогрессирования РМЖ происходило увеличение объемной плотности соединительной ткани в аксиллярных лимфатических узлах: наибольшим этот показатель был при III стадии – 46,4±2,07%, при II стадии составлял 28,0±3,65%, при I стадии практически не отличался от группы сравнения – соответственно 3,6±1,76 и 2,64±1,39% (табл. 1). Увеличение объемной плотности соединительной ткани происходило также во всех отделах лимфатических узлов, наиболее заметно в корковом веществе и корковом плато (соответственно в 24 и 26 раз, p<0,05).
|
Таблица 1 Объемная плотность (в %) соединительной ткани в разных отделах аксиллярных лимфатических узлов больных при различных стадиях рака молочной железы (M±m) |
||||
|
Структурный отдел |
Группа сравнения |
Стадии рака молочной железы |
||
|
I |
II |
III |
||
|
Весь узел, |
2,64±1,39 |
3,60±1,76 |
28,01±3,65*,# |
46,42±2,07*,# |
|
в том числе: корковое вещество |
0,78±0,30 |
1,35±0,75 |
13,11±2,41*,# |
19,21±1,30*,# |
|
мозговое вещество |
1,86±0,56 |
2,25±1,55 |
14,90±2,06*,# |
27,21±2,77*,# |
|
Корковое вещество, в том числе: корковое плато |
0,21±0,03 |
1,0±0,33 |
5,75±1,16*,# |
5,60±0,89*,# |
|
паракортикальная зона |
0,57±0,24 |
0,35±0,19 |
5,75±1,53*,# |
7,20±1,10*,# |
|
узелки без центра размножения |
0 |
0 |
0 |
1,80±0,64*,# |
|
узелки с центром размножения |
0 |
0 |
1,61±0,79 |
4,61±0,67*,# |
|
Мозговое вещество в том числе: мякотные тяжи |
1,00±0,14 |
1,00±0,18 |
5,70±1,34*,# |
6,80±1,48*,# |
|
мозговые синусы |
0,86±0,25 |
1,25±0,57 |
9,15±0,66*,# |
20,41±1,97*,# |
|
Примечание: * – р<0,05 относительно группы сравнения, # – р<0,05 относительно I стадии рака молочной железы. |
||||
При этом следует отметить, что в узелках без центра размножения и мантийной зоне соединительнотканные элементы отсутствовали как в группе сравнения, так при I и II стадиях РМЖ, а в узелках с центром размножения и в центрах размножения такие элементы не выявлены в группе сравнения и при I стадии РМЖ (табл. 1). На II стадии РМЖ небольшие прослойки плотной волокнистой соединительной ткани появились только в центрах размножения отдельных органов. Однако на III стадии признаки склероза той или иной степени выраженности были найдены уже во всех узелках всех лимфатических узлов.
Объемная плотность соединительной ткани в мякотных тяжах при II и III стадиях возросла соответственно в 5,7 и 6,8 раза относительно группы сравнения и I стадии (табл. 1). В мозговых синусах данный показатель на III стадии увеличился соответственно в 24 и 16 раз по сравнению с группой сравнения и I стадией (p<0,05).
Прогрессирование РМЖ сопровождалось также увеличением объемной плотности сосудов (CD34-позитивных структур) в аксиллярных лимфатических узлах (рис. 2). Значение данного показателя у больных на III стадии было увеличено соответственно в 12, 13 и 2 раза относительно группы сравнения, I и II стадий РМЖ (табл. 2).
а 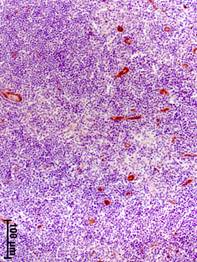 б
б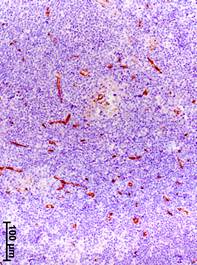 в
в 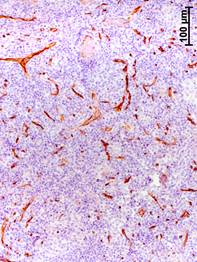
Рис. 2. Иммуногистохимическое выявление CD34-позитивных структур в аксиллярных лимфатических узлах на разных стадиях рака молочной железы.
а – I стадия; б – II стадия; в – III стадия
|
Таблица 2 Объемная плотность (в %) сосудов (CD34-позитивных структур) в разных отделах аксиллярных лимфатических узлов больных при различных стадиях РМЖ (M±m) |
||||
|
Структурный отдел |
Группа сравнения |
Стадия РМЖ |
||
|
I |
II |
III |
||
|
Весь узел, в том числе: |
3,00±0,66 |
2,91±0,65 |
18,76±1,38*,# |
36,84±1,92*,# |
|
корковое вещество |
1,29±0,27 |
1,20±0,32 |
9,01±1,38*,# |
15,62±0,89*,# |
|
мозговое вещество |
1,71±0,25 |
1,71±0,53 |
9,75±1,37*,# |
21,22±2,17*,# |
|
Корковое вещество, в том числе: корковое плато |
0,86±0,16 |
0,95±0,26 |
3,85±0,54*,# |
5,01±0,71*,# |
|
паракортикальная зона |
0,43±0,11 |
0,25±0,04 |
4,15±0,81*,# |
5,40±1,34*,# |
|
узелки без центра размножения |
0 |
0 |
0 |
1,40±0,35*,# |
|
узелки с центром размножения |
0 |
0 |
1,01±0,26 |
3,81±0,79*,# |
|
Мозговое вещество, в том числе: мякотные тяжи |
0,57±0,16 |
0,70±0,20 |
3,30±0,57*,# |
5,21±1,11*,# |
|
мозговые синусы |
1,14±0,27 |
1,01±0,36 |
6,45±0,66*,# |
16,01±1,58*,# 3 |
|
Примечание: * – р<0,05 относительно группы сравнения, # – р<0,05 относительно I стадии рака молочной железы. |
||||
Объемная плотность сосудов в корковом веществе на III стадии РМЖ была больше в 12 и 13 раз, чем в группе сравнения и при I стадии, и на 73,3% больше, чем при II стадии (табл. 2). В мозговом веществе данный показатель на III стадии был больше в 12; 12,5 и 2 раза, чем в группе сравнения, на I и II стадиях. В паракортикальной зоне объемная плотность сосудов на III стадии РМЖ была выше соответственно в 12 и 22 раза, чем в группе сравнения и на I стадии. Следует отметить, что сосуды всех типов полностью отсутствовали в лимфоидных узелках как без центров размножения, так и с герминативными центрами в лимфатических узлах женщин из группы сравнения (без РМЖ) и при I стадии болезни. На II стадии РМЖ небольшие сосуды со склерозированными стенками появились только в центрах размножения отдельных органов. Однако на III стадии сосуды присутствовали уже во всех узелках всех лимфатических узлов (табл. 2). Заметно увеличилась объемная плотность сосудов в мозговых синусах подмышечных лимфатических узлов: на III стадии РМЖ этот показатель был выше соответственно в 14, 16 и 2,5 раза, чем в группе сравнения, на I и II стадиях.
Результаты морфометрического анализа свидетельствуют о том, что процессы васкуляризации и склеротической трансформации лимфатических узлов и их разных отделов происходят параллельно по мере прогрессирования опухолевого роста. Установлены прямые положительные корреляционные связи между объемной плотностью сосудов и объемной плотностью соединительной ткани в подмышечных лимфатических узлах: для I стадии РМЖ r=0,747 (p<0,05), для II стадии – r=0,707 (p<0,05), для III стадии – r=0,664 (p<0,05), т.е. во всех случаях выявлена сильная положительная связь. При этом в группе сравнения выявлена слабая обратная корреляционная зависимость (r=–0,298). Обратная корреляция у женщин без рака молочной железы, возможно, обусловлена тем, что процессы формирования соединительной ткани не связаны с процессами ангиогенеза, или тем, что постепенный склероз органов, например возрастной, не сопровождается формированием новых сосудов.
При изучении корреляционных связей между стадией РМЖ и объемной плотностью соединительной ткани установлено, что эта связь является прямой и очень сильной: r=0,981 (p<0,05). Подобный уровень корреляционных связей выявлен также отдельно для коркового (r=0,953, p<0,05) и мозгового (r=0,976, p<0,05) вещества. Следовательно, по мере развития опухоли (по мере увеличения стадии болезни) происходит увеличение объемной плотности соединительной ткани как во всем органе в целом, так и отдельно в корковом и мозговом веществе. Причем склеротическая трансформация в этих зонах идет одинаково интенсивно.
Выявлены сильные положительные корреляционные связи между стадией РМЖ и объемной плотностью сосудов в аксиллярных лимфатических узлах – r=0,984 (p<0,05); аналогичные закономерности установлены для коркового вещества (r=0,978, p<0,05) и для мозгового вещества (r=0,965, p<0,05).
Усиление склеротической трансформации лимфатических узлов при прогрессировании опухоли обусловлено, вероятно, более длительным и более выраженным перитуморозным воспалительным процессом, что может способствовать усилению деструктивных процессов и, как следствие, развитию заместительного склероза. Разрастание соединительной ткани по ходу синусной системы лимфатических узлов, а также склеротические изменения сосудистых оболочек способствуют нарушениям обмена и развитию гипоксии в значительных участках лимфоидной паренхимы. В таких условиях возможно усиление продукции различных проангиогенных цитокинов, стимулирующих дифференцировку мультипотентных стромальных клеток в эндотелиоциты, усиление неоангиогенеза для улучшения кровоснабжения органа и ликвидации гипоксии [13, 14]. Возможно также, что продуцируемые клетками опухоли проангиогенные цитокины [15] попадают в аксиллярнные лимфатические узлы и стимулируют в них рост сосудов во всех их структурных отделах, в том числе и в лимфоидных узелках. В результате в регионарных лимфатических узлах сначала появляется небольшая сеть из новообразованных капилляров, которые имеют узкий просвет и тонкую однослойную стенку. Затем в таких сосудах просвет расширяется, и формируются оболочки, в частности адвентициальная. Наружные оболочки рядом расположенных сосудов со временем сливаются, также параллельно расширяются и сливаются соединительнотканные прослойки, сформированные в результате поступления детрита из места развития опухоли. Таким образом, одновременно c ангиогенезом возрастает выраженность склеротических изменений.
Заключение
В аксиллярных лимфатических узлах по мере увеличения стадии РМЖ прогрессивно увеличивается объемная плотность соединительной ткани (на III стадии РМЖ соответственно в 18 и 13 раз относительно группы сравнения и I стадии). Необходимо отметить, что прослойки соединительной ткани на II стадии РМЖ появляются в некоторых наблюдениях даже в центрах размножения лимфоидных фолликулов. Особенно быстро явления склероза прогрессируют в паракортексе и в мозговых синусах, где относительная площадь соединительной ткани возрастает в несколько десятков раз.
По мере возрастания стадии патологического процесса у больных при РМЖ в аксиллярных лимфатических узлах как в целом (на III стадии РМЖ соответственно в 12 и 13 раз относительно группы сравнения и I стадии), так и во всех их зонах отмечено быстрое и значительное увеличение объемной плотности новообразованных сосудов, которые появляются даже в лимфоидных узелках.
В аксиллярных лимфатических узлах пациентов при РМЖ обнаружена сильная положительная корреляционная связь между объемной плотностью сосудов и объемной плотностью соединительной ткани, тогда как в лимфатических узлах женщин без РМЖ эта связь очень слабая и отрицательная. Полученные результаты свидетельствуют о том, что процессы ангиогенеза и склеротической трансформации лимфатических узлов при РМЖ идут параллельно и практически с одинаковой интенсивностью. Не исключено, что эти процессы взаимно потенцируют друг друга.
Между стадией РМЖ и объемной плотностью соединительной ткани, а также между стадией РМЖ и объемной плотностью новообразованных сосудов в аксиллярных лимфатических узлах выявлены сильные положительные корреляционные связи. Полученные результаты позволяют полагать, что в лимфатических узлах без метастазов при РМЖ по мере прогрессирования опухолевого роста усиливается неоангиогенез и происходит значительная склеротическая трансформация. В то же время выявление значительного склероза лимфатического узла не может однозначно расцениваться как симптом наличия злокачественной опухоли в регионе лимфосбора, так как появление соединительной ткани в узле может быть обусловлено многими другими причинами. Однако одновременная значительная интенсификация процесса неоангиогенеза может быть одним из признаков длительное время существующего перитуморозного воспалительного процесса, что, безусловно, необходимо учитывать при оценке тяжести системных проявлений злокачественного процесса и использовании адекватных схем реабилитации пациентов.



