В настоящее время исследования структур нанодиапазона занимают одно из лидирующих мест во всех отраслях науки, в том числе и медицине. Наночастицы применяются как для диагностики, так и для конструирования систем направленной доставки лекарств. Наночастицы могут быть использованы как универсальные средства для таргетной терапии. Синтезировано много различных эффективных таргетных систем на основе наноматериалов, однако не все из них дошли до клинического применения. Их практическое применение во многом ограничено дефицитом данных и сложностью исследования биологических свойств наноматериалов. После введения наночастиц в живой организм мы можем оценивать результаты их воздействия только по внешним косвенным признакам: поведению животного, изменению в анализах крови, посмертных морфологических изменениях в органах и т.д. Существенной проблемой является прижизненное исследование биокинетики и распределения частиц нанодиапазона, так как закономерности их распределения во многом отличаются в зависимости от характера наночастиц, их морфологии, размера, заряда и других свойств, что затрудняет экстраполяцию данных на другие наноматериалы. Кроме того, большинство доступных литературных данных по фармакокинетике наноматериалов базируются на экспериментах ex vivo, что сопровождается гибелью большого количества экспериментальных животных и не согласуется с принципами биоэтики.
Множество современных исследований направлено на поиск новых методов визуализации наночастиц непосредственно в живом организме и в режиме реального времени. При этом, если для визуализации металлических (ферромагнитных) материалов стало стандартом использование рентгеновской и магнитно-резонансной томографии, то органические и полимерные наноструктуры (например, липосомальные везикулы, микрокапсулы из биополимеров и т.д.) по-прежнему сложны для изучения биокинетики in vivo. Большинство современных исследований предлагают использование оптических методов визуализации [1, 2]. Известно, что большинство органических веществ в клетках не поглощают электромагнитное излучение в ближней инфракрасной области, поэтому область 650–1350 нм получила название «окно прозрачности» биологических объектов и может быть использована для визуализации каких-либо маркеров in vivo. В качестве маркеров используют различные вещества – флюоресцентные маркеры, обладающие свойством флюоресценции в ближней ИК-области. С помощью флюоресцентных меток можно изучить распределение меченых белков в организме или получить изображение биомолекул, меченых органелл внутри клетки, рецепторов на поверхности клеток, в том числе опухолевых [1]. Многие флюоресцентные вещества – низкомолекулярные и водорастворимые, поэтому их сложно инкапсулировать, часто происходит необратимая потеря флюорофора в процессе синтеза (утечка) или потеря его активности («выгорание») [2]. Пришивание флюоресцентно-меченых антител к поверхности наночастиц технически дорого, трудоемко и не обеспечивает необходимой концентрации флюоресцентного маркера, а, следовательно, и приемлемого уровня свечения наночастиц в органах и тканях – визуализация возможна только в мазках или срезах под микроскопом [3]. Поэтому для in vivo исследований наиболее перспективной будет разработка флюоресцентного маркера на основе макромолекулы (например, белка).
Целью нашей работы стали оптимизация метода синтеза флюоресцентного маркера на основе бычьего сывороточного альбумина и цианинового 7 и исследование распределения меченых наночастиц в живом организме.
Материалы и методы исследования
В работе использовались краситель цианиновый 7 (Су7) фирмы «Lumiprobe Co» и бычий сывороточный альбумин (BSA) Sigma Aldrich (США). За основу синтеза была взята реакция конъюгации BSA и активированного эфира Су7. Были рассчитаны основные объемы и соотношения реагентов согласно протоколу конъюгации, аналогичному работе [4]. Белок растворяли в фосфатном буфере, а краситель NHS-Су7 – в диметилсульфоксиде (ДМСО). Растворенный краситель приливали к белку, смесь тщательно перемешивали на магнитной мешалке, далее проводилась инкубация в различных условиях в течение 24 ч.
Очистку полученного конъюгата BSA-Су7 осуществляли с помощью диализа с диаметром пор 12–14 кДа. Диализ проводился деионизированной водой при различной температуре и постоянном помешивании. Воду меняли каждые 24 часа до достижения визуально чистого раствора.
Для оптимизации методики исследовано влияние условий синтеза (температуры и pH) на эффективность включения красителя в конъюгат. Для подбора температурного режима нами было синтезировано несколько конъюгатов при заданной температуре. Затем проведена серия экспериментов по подбору оптимального уровня pH для синтеза конъюгата BSA-Су7. Для оценки эффективности включения определяли процент не включившегося в ходе реакции красителя и рассчитывали степень включения. Концентрацию невключившегося красителя определяли в диализующем растворе спектрофотоколориметрически по предварительно построенному калибровочному графику. Процент невкючившегося красителя определяли по формуле: (m – m1)/m х 100%, где m – масса исходная красителя, m1 – масса невключившегося красителя.
После оптимизации методики была исследована кинетика красителя Cy7 в свободной, конъюгированный с белком и липосомальной форме. Липосомы были выбраны в качестве модели частиц нанодиапазона как наиболее изученные и потенциально нетоксичные [5]. Липосомы синтезировали методом «обращения фаз» из лецитина и холестерина на роторном испарителе Laborota 4000 eco (Heidolph, Германия) аналогично работе [6]. Полученные липосомы имели средний размер 292±14 нм, количество Cy 7 cоставляло 98%.
Исследование кинетики выполнено на лабораторных мышах массой 18–22 г. Было выполнено 2 серии экспериментов. В первой серии изучена системная кинетика красителя. Во второй серии сравнивалось его органное распределение методом full body imaging.
Для исследования системной кинетики были сформированы 3 группы животных по 6 особей в каждой. Мышам в хвостовую вену вводили 5 мкг красителя в 0,2 мл изотонического раствора, причем в первой группе использовался свободный Cy7 в виде активированного эфира, во второй – конъюгат BSA-Су7 в эквивалентной дозе красителя, в третьей – суспензия липосом с конъюгатом. Через 5, 15, 30 минут, 1, 3, 6, 12 и 24 часа у мышей отбирали по 20 мкл крови путем скарификации кожи подошвенной поверхности лапок. Кровь вносили в ячейки плоскодонных стрипов для ИФА-анализа с диаметром ячейки 5 мм, и непосредственно после забора проводили регистрацию люминесценции с помощью системы визуализации IVIS Lumina II (Xenogen). Параметры регистрации люминесценции: длина волны возбуждения 650–690 нм, длина волны эмиссии 700–740 нм. Расчет концентрации красителя в крови проводили по предварительно построенному калибровочному графику. Фармакокинетическое моделирование и сопоставление реальных и модельных кривых проводились с помощью программы PKSolver.
Результаты исследования и их обсуждение
Результаты исследования влияния температурного режима на эффективность включения красителя в белок представлены в таблице 1.
Таблица 1
Зависимость степени включения Cy7 от температуры
|
Температура |
+4°C |
+18°C |
+25°C |
+37°C |
|
Конц. красителя, мг/мл |
0,29±0,01 |
0,26±0,03 |
0,22±0,004 |
0,17±0,001 |
|
Степень включения красителя, % |
99 |
90 |
76 |
60 |
Оптимальной для инкубации была температура +4°C. Поэтому дальнейшую инкубацию проводили при данной температуре в холодильнике на магнитной мешалке.
Результаты экспериментов по подбору оптимальных условий pH для синтеза флюоресцентного маркера BSA-Су7 представлены в таблице 2.
Таблица 2
Зависимость степени включения Cy7 от рН
|
рН |
7,0–7,5 |
7,6–8,2 |
8,3–8,4 |
8,5–8,6 |
8,7–9,0 |
|
Конц. красителя, мг/мл |
0,15±0,02 |
0,26±0,03 |
0,29±0,001 |
0,28±0,002 |
0,16,5±0,001 |
|
Степень включения красителя, % |
52 |
90 |
99 |
98 |
61 |
Известно, что реакция активированных эфиров с аминами проявляет существенную зависимость от pH [7]. При низких значениях pH происходит протонирование аминогрупп, в результате чего снижается эффективность реакции. При высоких значениях существенным становится процесс гидролиза активированного эфира. Из таблицы 2 видно, что наибольшая степень включения красителя была при значении pH 8,3–8,6. Выше и ниже данных значений степень включения была значительна ниже. Таким образом, можно сделать вывод, что оптимальным значением pH для модификации является 8,3–8,6.
Исследование кинетики свободного красителя и флюоресцентного маркера
Кинетические константы Cy7 при введении в различных формах представлены в таблице 3.
Таблица 3
Особенности фармакокинетики различных форм Cy7
|
Показатель |
Значения показателей для различных форм препарата |
||
|
Свободный Су7 |
Конъюгат Су7-BSA |
Липосомы с конъюгатом Су7 - BSA |
|
|
Сmax, нг/мл |
139,6 |
137,3 |
385,2 |
|
k, мин -1 |
0,0141 |
0,0083 |
0,0027 |
|
T1/2, мин |
48,94 |
83,13 |
249,34 |
|
Cltot, мл/мин |
2,93 |
3,11 |
1,33 |
|
AUC(0-24), нг/мл*ч |
1565 |
1845 |
3751 |
|
ka , мин -1 |
– |
0,0181 |
0,0097 |
|
kb , мин -1 |
– |
0,0019 |
0,0006 |
|
Т1/2 (a), мин |
– |
38,30 |
71,13 |
|
T1/2 (b), мин |
– |
364,8 |
1150,0 |
Примечание: Сmax – пиковая концентрация, k – константа элиминации,T1/2, – период полувыведения,
Cltot – общий клиренс, AUC(0-180), – площадь под фармакокиненитческой кривой в интервале 0–24 ч.
Мы можем видеть, что пиковые концентрации Cy7 в крови были сопоставимы в первой и второй группах и практически в 3 раза выше в группе с липосомальной формой красителя. Однако скорость элиминации была меньше в случае использования конъюгата с BSA и минимальной в липосомальной форме, что свидетельствует о пролонгировании циркуляции конъюгированной и липосомальной формы красителя по сравнению со свободным Cy7. Длительная циркуляция в крови приводила к значительному повышению АUС 0-24 для Cy7-BSA и липосом на его основе. Фармакокинетика свободного красителя удовлетворительно описывалась однокамерной моделью (R корр=0,996). Кинетика конъюгата Cy7 BSA и его липосомальной формы соответствовали биэкспоненциальной кривой (R корр=0,999 и R корр=0,991 соответственно). От 20 до 45% введенной дозы элиминировалось в течение первой фазы (38 и 70 минут для конъюгата и его липосомальной формы соответственно). Вторая фаза, на которую приходилось от 55 до 80% дозы для конъюгата и его липосомальной формы, характеризовалась периодом полуэлиминации в 6 и 12 часов соответственно. Появление дополнительной «медленной» экспоненты на фармакокинетической кривой свидетельствует о наличии «депо» препарата, скорость освобождения из которого значительно меньше скорости естественной элиминации. В нашем случае в качестве такого депо могут выступать молекулы BSA, с которыми конъюгированы Cy7 и липосомальные везикулы. Хорошая биологическая совместимость и стабильность в крови пролонгируют время их циркуляции и создают в крови пул депонированного красителя. Кроме того, кинетика липосом, не обработанных полиэтиленгликолем, характеризуется их депонированием в органах РЭС (в печени и селезенке), которые в этом случае также выступают в роли депо красителя.
Основной целью второй серии эксперимента было исследование распределения наночастиц (липосом), помеченных флюоресцентным конъюгатом Cy7-BSA in vivo. Оценка органного распределения красителя проведена в трех группах мышей (по 5 особей в каждой) на вышеописанной установке IVIS Lumina II в режиме full body imaging. Под внутрибрюшинным наркозом удаляли волосяной покров, после чего в хвостовую вену вводились исследуемые вещества в дозировке, аналогичной таковой в первой группе (5 мкг/животное). Затем животное помещалось в камеру анализатора, и регистрировали индуцированную люминесценцию всего тела. Параметры регистрации были аналогичны таковым в первой серии. Результаты сравнения люминесценции мышей приведены на рисунке.
Анализируя серию последовательных снимков животного, которому был введен Cy7 в дозе 5 мкг (1-й ряд), мы можем видеть, что краситель Cy7 распределялся во всех органах и тканях. На ранних этапах (30 мин) регистрируется люминесценция печени, на поздних – почек. При введении равной дозы конъюгата (2-й ряд) также наблюдалось свечение печени и почек, однако интенсивность люминесценции была меньше. При этом максимум интенсивности свечения печени был сдвинут в область более позднего времени наблюдения (24 часа), а интенсивность свечения почек была меньшей. Эти данные согласуются с данными, полученными при изучении системной кинетики, и свидетельствуют о том, что при введении конъюгата доля свободной фракции красителя, выводимой почками, была меньше, а время циркуляции в крови пролонгировалось.
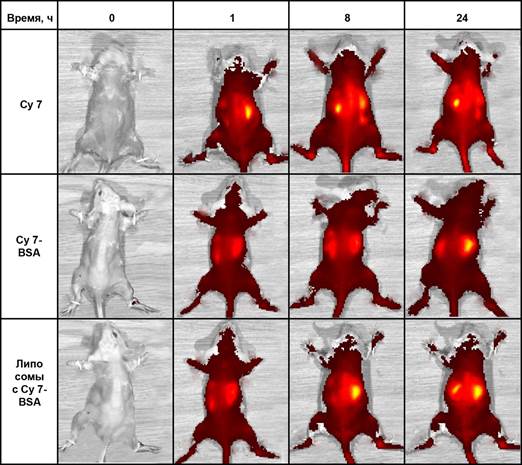
Результаты сравнения люминесценции мышей
При введении липосом на основе конъюгата Cy7-BSA в ранние сроки (30 мин) также наблюдалось уменьшение интенсивности свечения органов, однако к 8-му часу хорошо контрастировалась печень, а к 24 часам отмечалась интенсивная флюоресценция печени и селезенки. Наблюдаемые визуальные изменения согласуются с данными системной кинетики и данными литературы [5, 8]. Как известно, липосомальные везикулы, не защищенные ПЭГ, элиминируются из кровотока фагоцитами и транспортируются в органы РЭС, где подвергаются депонированию и медленному метаболизму. Эти изменения скорее всего объясняют и флюоресценцию области печени и селезенки, и появление длительной второй фазы выведения липосом на основе конъюгата Cy7-BSA. Таким образом, прижизненный анализ органного распределения флюоресценного маркера и липосом, содержащих маркер на основе белка и красителя цианинового 7, позволил выявить особенности фармакокинетики частиц нанодиапазона (липосомы и белковый конъюгат) и показал, что данные достаточно хорошо согласуются с параметрами системной кинетики ex vivo.
Выводы. Для разработки метода визуализации распределения наночастиц в живом организме была использована флюоресцентная метка на основе бычьего сывороточного альбумина и красителя цианинового 7. Опытным путем были подобраны оптимальные значения pH и температуры для конъюгации белка (бычьего сывороточного альбумина) с активированным эфиром цианинового 7. Установлен процент включения красителя в полученном конъюгате. В качестве модели наночастиц были выбраны липосомальные везикулы: получены липосомы из лецитина и холестерина с включением полученного конъюгата Cy7-BSA. Установлены особенности кинетики распределения липосом с флюоресцентным конъюгатом в живом организме методом full body imaging, а также проведено сравнение с кинетикой красителя Cy7 в свободной и конъюгированной с белком форме. На основе сопоставления данных системной кинетики и визуальных данных можно сделать вывод о перспективности применения флюоресцентного маркера на основе бычьего сывороточного альбумина и красителя цианинового 7 для визуализации распределения органических и полимерных наночастиц в живом организме.



