В настоящее время в здравоохранении наметилось изменение стратегии. Внедрение достижений геномики, протеомики, метаболомики и биоинформатики в практическую деятельность врача расширяет представление о патологических процессах и дает клиницисту возможность диагностировать вероятность заболевания на доклиническом этапе и обеспечить профилактические мероприятия для сохранения здоровья.
Наследственные факторы играют большую роль в формировании сердечно-сосудистой патологии. В основе индивидуальных генетических различий в формировании сердечно-сосудистой патологии лежит полиморфизм генов-кандидатов [1]. В патогенезе сердечно-сосудистых заболеваний, в том числе и артериальной гипертензии (АГ), особую роль играют гены ренин-ангиотензиновой системы (РАС) [2].
Генопродуктом гена AGT является ангиотензиноген. Основным местом экспрессии гена являются клетки печени, кроме того, ангиотензиноген синтезируется адипоцитами жировой ткани. В регуляции экспрессии гена принимают участие эстрогены, глюкокортикоиды, тиреоидные гормоны. Превращение ангиотензиногена в ангиотензин-I происходит с помощью протеолитического фермента ренина, который вырабатывается юкстагломерулярными клетками в стенках артериол почечных клубочков. В превращении неактивного ангиотензина-I в вазоактивный пептид ангиотензин-II участвует ангиотензин – превращающий фермент (10% от общего количества факторов), кроме того, выявлен и ряд других альтернативных путей модификации пептида с участием химаз, катапсина G, тонина и других. Ангиотензин-II реализует свой эффект через G-белок сопряженные ангиотензиновые рецепторы [3]. Ангиотензин-II обладает вазопрессорным действием путем снижения уровня вазоактивных дилятаторов (оксида азота) и повышения уровня констрикторов (эндотелинов) [4]. Ген AGТ является высокополиморфным геном, в нем обнаружено более 40 однонуклеотидных замен [5]. Ген AGТ локализован в локусе 1q42 – q43, в том же регионе, что и ген ренина, содержит 5 экзонов [6]. Чаще всего изучались snp, локализованные во 2-м экзоне: замена тимина (Т) на цитозин (С) в 704-м положении (Т704С), приводящая к включению в белок триптофана вместо метионина (М268Т, М235Т, rs5051), и цитозина на тимин в положении 521 (С521Т), приводящая к замене треонина на метионин (Т207М, Т174М, rs4762). Выявлено, что данные однонуклеотидные замены приводят к повышению экспрессии гена AGT и увеличению уровня ангиотензиногена в крови и связаны с формированием артериальной гипертензии и ряда других сердечно-сосудистых патологий [7].
Многочисленные физиологические эффекты ангиотензин-II реализует с помощью четырех мембранных G-белок сопряженных типов рецепторов. Вазоактивный эффект ангиотензина-II реализуется через рецепторы 1-го и 2-го типа. Взаимодействие ангиотензина-II с рецепторами 1-го типа приводит к вазоконстрикции и повышению АД, в то время как активация рецепторов к ангиотензину-I 2-го типа связана с вазодилятацией [8]. Ген сосудистого рецептора 1-го типа к ангиотензиногену II (AGT2R1) локализуется в 3-й хромосоме (3q21_3q25). Учитывая, что изменения структуры гена AGT2R1 могут приводить к изменениям в регуляции сосудистого тонуса, данный ген считают одним из генов-кандидатов, связанных с патологией сердечно-сосудистой системы [9]. В гене выявлено более 10 полиморфизмов, наиболее изученным является А1166С, локализованный в 3´-нетранслируемой области гена. Замена аденина на цитозин в локусе 1166 оказывает влияние на функциональную активность рецептора и связана с развитием гипертонии [10]. Это, вероятно, объясняется тем, что аллель 1166С с помощью микро-РНК-155 способствует повышению уровня экспрессии AGT2R1.
Генетическое разнообразие человека определяется как демографическими, так и биологическими факторами и имеет фундаментальное значение для понимания генетической основы болезней. Кроме того, проживание в неблагоприятных для человека климатогеографических условиях Европейского Севера предъявляет повышенные требования практически ко всем системам организма человека, прежде всего к сердечно-сосудистой системе, что связано с высокими энергозатратами и повышением тонуса периферических сосудов при действии холода [11]. В связи с вышесказанным для формирования здоровьесберегающих программ необходимым является изучение распространенности патологических аллелей генов-кандидатов функционирования сердечно-сосудистой системы в популяции жителей Европейского Севера.
Цель: исследование частоты распространения полиморфизма генов системы РАС и выявление влияния изучаемых полиморфизмов на формирование гемодинамической реакции на дозированную физическую нагрузку молодых, здоровых жителей Европейского Севера.
Материалы и методы исследования. В исследование были включены 195 молодых людей (108 девушек и 87 юношей), идентифицирующих себя как русские. Средний возраст исследуемых составил 19,2 года; 95%-ный доверительный интервал (ДИ) 18,5–19,8. Критерии включения в исследование: постоянное проживание (с момента рождения) обследованных лиц в условиях Европейского Севера Российской Федерации, возраст от 18 до 22 лет, наличие информированного согласия на участие в исследовании. Критериями исключения из исследования являлись наличие у обследуемых острых воспалительных заболеваний, любых хронических заболеваний внутренних органов, в том числе и в стадии стойкой ремиссии, ожирения, прием гормональных контрацептивов, курение. Кроме того, в изучаемую выборку не включались лица, имеющие регулярные (2–3 раза в неделю) физические нагрузки, в связи с тем, что систематические физические нагрузки динамического характера способствуют повышению эндотелийзависимой релаксации сосудов. Все исследования проводились в осенний период в утренние часы при комфортной комнатой температуре.
Проводили молекулярно-генетическое исследование лейкоцитов, выделенных из периферической крови исследуемых. Генотипирование полиморфизма в генах системы РАС осуществляли методом пиросеквенирования с использованием тест-системы «Тоно-скрин» (профиль «Артериальная гипертензия») на секвенаторе «PyroMark Q24» («Qiagen», Германия). Проводили генотипирование следующих полиморфизмов: в гене AGT – C521T и T704C, в гене AGT2R1 – A1666C.
Проводили пробы с дозированной физической нагрузкой (20 приседаний за 30 с) по Мартине–Кушелевскому [12]. Выделяли типы гемодинамической реакции с учетом изменения систолического, диастолического артериального давления и частоты сердечных сокращений (ЧСС) после физической нагрузки, а также с учетом особенностей восстановления гемодинамических показателей после нагрузки. Проба Мартине–Кушелевского позволяет оценить реакцию сердечно-сосудистой системы на нагрузку и выявить предрасположенность к периферической вазоконстрикции, которая в дальнейшем будет способствовать возникновению артериальной гипертензии. Артериальное давление и ЧСС фиксировали на автоматическом цифровом приборе для измерения давления и пульса МТ-40 производства «Meditech» (США).
Статистическую взаимосвязь между количественными данными (тип гемодинамической реакции на физическую нагрузку) и вариантами генотипа по полиморфизмам Т704С и С521Т в гене AGT и A1666C в гене AGT2R1 оценивали при помощи критерия χ2. Данный показатель рассчитывали с использованием онлайн-калькулятора, размещенного на сайте «Медицинская статистика». Критический уровень значимости (р) при проверке статистических гипотез принимали равным 0,05.
Результаты исследования и их обсуждение
Результаты молекулярно-генетического исследования сопоставляли с частотами аллелей и генотипов, представленных в базе частот аллелей в популяциях людей (The Al. lete FREquency Database 2019). Все изученные частоты аллелей и генотипов в Архангельской популяции не отклонялись от закона Харди–Вайнберга.
Анализ аллелей и генотипов изучаемого полиморфизма Т704С в гене AGT показал: частота гомозигот по дикому аллелю (ТТ) составила 0,201, гетерозигот (ТС) – 0,553, гомозигот по мутантному аллелю (СС) – 0,246. Частота дикого аллеля составила 0,496, мутантного – 0,504. Обращают на себя внимание большая частота гетерозигот и высокая частота встречаемости мутантного аллеля. Однако сопоставление наших результатов с данными базы ALFRED (2019) выявило наличие общемировой тенденции к высокому уровню гетерозигот и частоты мутантных аллелей. Наиболее высокие показатели были выявлены у жителей Африки, что авторы связывают с эффектом родоначальника. Наблюдается уменьшение частоты мутантного аллеля в Северной Африке, вероятно, обусловленное смешением с европейским и азиатским населением [13]. Частота гетерозигот в Африке 0,080–0,500, частота мутантных аллелей С 1,0–0,500. В Азии выявлена более низкая частота встречаемости аллеля С. Самый высокий уровень (0,687) показан в работах [14], в то же время эти же авторы выявили самый низкий уровень аллеля С среди жителей Палестины (0,438). Частота гетерозигот колебалась от 0,5 до 0,688. В Европе уровень аллеля С довольно высокий. Самые низкие показатели выявлены у ирландцев (0,250) и датчан. Частота С аллеля колеблется у европейцев от 0,250 до 0,690. Частота гетерозигот – 0,430–0,500. В масштабном исследовании по частоте встречаемости аллеля С у русских показан уровень аллеля С от 0,380 до 0,500, частота гетерозигот 0,380–0,500 [15]. Полученные результаты в популяции жителей Архангельской области по частотам генотипов и аллелей по полиморфизму Т704С в гене AGT согласуются с данными, представленными в базе частот аллелей в популяциях людей для европейских групп, в том числе и популяций русских.
Частоты аллелей и генотипов при анализе полиморфизма С521Т в гене были следующими: частота гомозигот по дикому аллелю составила 0,707, гетерозигот – 0,257, гомозигот по мутантному аллелю – 0,036. Выявлена частота дикого аллеля С – 0,836, мутантного аллеля Т – 0,164. Анализ частот гетерозигот и мутантного аллеля в различных популяциях по базе ALFRED (2019) показал достаточно высокое сходство распространенности данного аллеля в популяциях людей. Так, в популяциях жителей Африки частота гетерозигот колебалась от 0,110 до 0,200, у жителей Азии – от 0,120 до 0,280, у жителей Европы – от 0,040 до 0,380. В популяциях русских гетерозиготы по полиморфизму С521 в гене AGT выявлены с частотой 0,240–0,290. Мутантные аллели Т в африканских популяциях встречались с частотой 0,020–0,120, в популяциях Азии – 0,11–0,170, у европейцев частота мутантных аллелей колебалась от 0,040 до 0,250. В русских популяциях частота мутантного аллеля не отличалась от общеевропейского уровня и составила 0,110–0,170. Таким образом, частоты генотипов и аллелей по полиморфизму С521Т не отличаются от частот, характерных для европейских популяций, и достаточно хорошо сочетаются с частотами гетерозигот и мутантного аллеля в русских популяциях.
Частота гомозигот по дикому аллелю А в Архангельской популяции при анализе полиморфизма A1666C в гене AGT2R1 составила 0,650, гетерозигот – 0,289, гомозигот по мутантному аллелю – 0,059. Частота дикого аллеля А была 0,806, а мутантного аллеля – 0,194. Анализ частот гетерозигот и мутантного аллеля по данному полиморфизму в различных популяциях по базе ALFRED (2019) вызвал определенное затруднение. Это связано с малым количеством публикаций, анализирующих распространенность данного полиморфизма в популяциях людей. Анализ распространенности полиморфизма A1666C в гене AGT2R1 в русских популяциях не представлен. Выявлено, что частота гетерозигот по данному полиморфизму в азиатских популяциях составляет 0,090–0,110, в популяциях Южной и Северной Америки частота гетерозигот колеблется от 0,360 до 0,440, в европейских популяциях (смешанные группы, французы, испанцы) гетерозиготы выявлялись с частотой 0,410–0,460. Мутантные аллели С у жителей Азии выявлялись с частотой 0,060–0,480, в популяциях Северной и Южной Америки – с частотой 0,240–0,320, в европейских популяциях – с частотой 0,290–0,350. Частоты гетерозигот и мутантных аллелей С в Архангельской популяции ниже по сравнению с частотами европейских популяций. Вероятно, более высокая частота диких аллелей в Архангельской популяции может рассматриваться как «цена адаптации» к дискомфортным условиям проживания в условиях Европейского Севера.
Был проведен анализ формирования гемодинамической реакции на физическую нагрузку у молодых людей с разными генотипами по изучаемым полиморфизмам. В качестве дозированной физической нагрузки использовалась проба Мартине–Кушелевского (20 приседаний за 30 с). Оценивалось изменение артериального давления и частоты сердечных сокращений после физической нагрузки. Кроме того, определялась способность сердечно-сосудистой системы к восстановлению после дозированной физической нагрузки. Данная проба была выбрана, так как она отличается простотой, адекватно оценивает гемодинамические показатели у нетренированных лиц и позволяет выделить типы реакции на физическую нагрузку, в том числе гипертонический тип реакции сердечно-сосудистой системы, который является прогностически неблагоприятным фактором в плане формирования вазоконстрикции и артериальной гипертензии. При проведении пробы у молодых людей было выявлено два типа гемодинамической реакции на нагрузку: нормотонический тип и гипертонический тип.
Анализ распределения аллелей и генотипов полиморфных вариантов изучаемых генов выявил следующую особенность: у лиц с гипертоническим типом реакции сердечно-сосудистой системы на дозированную физическую нагрузку чаще встречались гомозиготные генотипы по мутантному аллелю (рисунок).
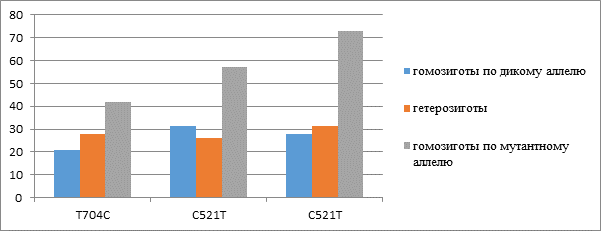
Частота (в %) гипертонической реакции на физическую нагрузку у молодых людей с разными генотипами по генам системы РАС
У исследуемых с полиморфизмом Т704С гена ангиотензиногена (AGT) была выявлена статистически значимая связь между наличием аллеля С в генотипе и вероятностью гипертонической реакции на дозированную физическую нагрузку (χ2=4,216, р=0,041). Наличие аллеля Т по полиморфизму С521Т в гене AGT также сопровождалось повышенной частотой развития гипертонической реакции на нагрузку. Так, у гомозигот с генотипом ТТ гипертоническая реакция выявлялась в 2,3 раза чаще, чем у гетерозигот, и в 1,8 раз чаще, чем у гомозигот по дикому аллелю. Однако статистически значимой взаимосвязи генотипа СС с развитием гипертонической реакции на нагрузку выявлено не было. У гомозигот СС по полиморфизму А1666С гена рецептора 1-го типа к ангиотензину II (AGT2R1) гипертоническая реакция на нагрузку была в 2,3 раза чаще, чем у гетерозигот, и в 2,6 раза чаще, чем у людей с генотипом АА. Была выявлена ассоциация генотипа СС с гипертонической реакцией (χ2=9,176, р=0,003). Учитывая, что в основе гипертонической реакции на физическую нагрузку лежит повышение периферического сопротивления, т.е. спазм артериол, можно сделать вывод, что генотип СС полиморфизма А1666С гена AGT2R1 и аллель С полиморфизма Т704С в гене AGT обусловливают склонность к периферическому вазоспазму и в перспективе к развитию артериальной гипертензии.
Выводы
1. Частота распространения полиморфизма Т704С и С521Т в гене AGT в популяции Архангельской области согласуется с частотой распространения этих полиморфизмов в европейских популяциях, в том числе и в популяциях русских. Частота аллеля С полиморфизма А1666С в гене AGT2R1 ниже, чем в европейских популяциях, что может рассматриваться как «цена адаптации» к дискомфортным условиям проживания на Европейском Севере.
2. Генотип СС полиморфизма А1666С гена AGT2R1 и аллель С полиморфизма Т704С в гене AGT являются генетическими предикторами риска артериальной гипертензии у молодых людей, проживающих на арктических и приарктических территориях.



