В последнее десятилетие произошел бум исследований в сфере применения различных методов регенеративной медицины, направленных на восстановление формы и функции поврежденных тканей. Одним из перспективных терапевтических подходов является использование мезенхимальных стволовых клеток (МСК), выделенных из костного мозга [1, 2]. Ведущими механизмами реализации репаративных, регенеративных и иммуномодулирующих свойств МСК считаются паракринная активность, которая включает секрецию биологически активных пептидов и гормоноподобных веществ; перенос митохондрий путем туннелирования нанотрубок или микровезикул; перенос РНК-содержащих микровезикул [1, 2]. Понимание закономерностей функционирования МСК создает значительные перспективы для применения клеточной терапии, а также для разработки новых клеточных терапевтических средств для регенеративной медицины [3, 4]. Однако в доступной литературе практически отсутствуют данные об использовании МСК в условиях действия экстремальных стресс-факторов на организм. Одним из таких факторов является вынужденная иммобилизация [5–7], которая сопровождает техногенные катастрофы, природные катаклизмы и течение некоторых заболеваний. Известно, что в патологический процесс при действии стресс-факторов вовлекаются почки [8] как одно из ключевых звеньев системы адаптации, что может привести к их повреждению [8, 9]. Таким образом, возникла необходимость изучения динамики метаболических и морфологических изменений в почечной ткани при применении методов клеточной терапии после экстремального воздействия физических факторов.
Цель исследования: изучить динамику изменений гистоморфометрических показателей кортикальных и юкстамедуллярных нефронов при 24-часовом иммобилизационном стрессе после внутривенного введения мезенхимальных стволовых клеток костномозгового происхождения.
Материал и методы исследования. Исследование проведено с использованием 195 самцов беспородных белых крыс, масса которых составляла 200–250 граммов, возраст 3–4 месяца. Для выращивания культуры МСК вымывали питательной средой клетки костного мозга из полостей бедренных и большеберцовых костей крыс. Полученные клетки помещали в культуральные флаконы («CORNING», США) объемом 25 см2, культивировали 14 дней в среде «ИГЛА-МЕМ» с L-глютамином («Биолот», Россия), 10%-ной телячьей эмбриональной сывороткой («Биолот», Россия) и антибиотиками в условиях СО2-инкубатора HF15UV («Heal Force», Китай) со сменой ½ среды каждые 5 суток. Выращенные клеточные культуры экспрессировали типичные маркеры МСК: CD105, CD73, CD44, CD90, CD54. Стресс моделировали однократной 24-часовой иммобилизацией животных в индивидуальных фиксирующих камерах. Выделили три группы животных: № 1 – интактную, № 2 – контрольную (иммобилизация без введения МСК), № 3 – экспериментальную (иммобилизация с однократным внутривенным введением по 5х106 МСК через 1 час после окончания иммобилизации). Животных выводили из эксперимента декапитацией под легким эфирным наркозом на 1-е, 3-и, 7-е, 14-е, 21-е и 30-е сутки реадаптационного периода. Извлекали почки крыс и фиксировали в 10%-ном растворе нейтрального формалина. После стандартной проводки заливали парафиновые блоки, из которых на микротоме МС-2 («Точмедприбор», Украина) изготавливали парафиновые срезы толщиной 4–6 мкм и окрашивали их гематоксилином и эозином. Гистологические препараты исследовали на цифровом морфометрическом комплексе на базе микроскопа Olympus BX 41 с последующей фотосъемкой. Гистоморфометрический анализ осуществляли с помощью компьютерной программы «Image Java». Результаты обрабатывали программой «Statistica 10.0» с использованием критерия Манна–Уитни. Результаты считали достоверными при р<0,05. Данные представлялись в виде медианы и интерквартильного размаха.
Результаты исследования и их обсуждение. В ходе гистологического и гистоморфометрического исследований почек установлено, что вынужденная 24-часовая иммобилизация приводит к значительным изменениям гистоморфометрических показателей как кортикальных, так и юкстамедуллярных нефронов, которые в значительной степени нивелируются внутривенным введением аллогенных МСК в постиммобилизацонном периоде. Наиболее выраженные изменения гистоморфометрических показателей отмечались в 1-е и 3-и сутки после окончания иммобилизации.
Изменения как в кортикальных, так и в юкстамедуллярных нефронах преимущественно характеризовались гипертрофией почечных телец за счет полнокровия сосудистых клубочков (при этом наблюдалось расширение петель сосудистых клубочков, благодаря чему они приобретали «лапчатую» форму), расширением пространства между сосудами клубочка и капсулой нефрона (рис. 1–3). Кроме того, местами отмечались наличие нефронов с разрушенными тельцами и разрушенными капиллярными клубочками, спадение клеток висцеральных листков капсул нефронов. Указанные изменения, вероятно, обусловлены явлениями ишемии, возникающей в ответ на спазм приносящих артериол при централизации кровообращения в ответ на выброс катехоламинов при стрессе. Следует отметить, что вариабельность изменений в юкстамедуллярных нефронах была выше по сравнению с нефронами коркового вещества почек, что можно объяснить их активным участием в перераспределении тока крови в условиях стресса. Также отмечалась дилатация всех видов канальцев нефронов обоих типов (особенно в дистальном сегменте). Одновременно с этим наблюдались и патологические изменения в эпителиоцитах канальцевого аппарата нефронов: признаки гидропической дистрофии и вакуолизации цитоплазмы, очаги колликвационного некроза, отделение клеток почечного эпителия от стенок, скопление клеточного детрита в просветах канальцев. Также местами визуализировались признаки периканаликулярного отека. Кроме указанных изменений, в паренхиме почек крыс, перенесших 24-часовой иммобилизационный стресс, наблюдались выраженное полнокровие и плазматическое пропитывание стенок капилляров сосудистых клубочков, венозное полнокровие капилляров перитубулярной зоны, явления стаза, рассеянные диапедезные и мелкоочаговые кровоизлияния. В динамике все эти изменения постепенно нивелировались, однако в группе животных, пролеченных МСК, это происходило в более ранние сроки (рис. 1–3).
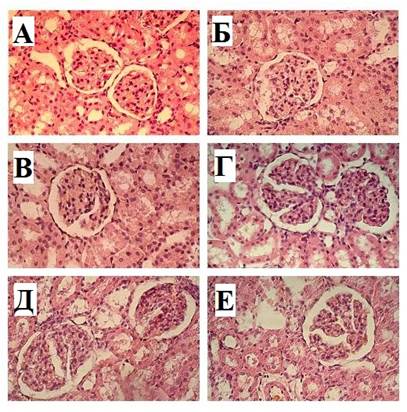
Рис. 1. А. Корковое вещество почки крысы интактной группы. Б. Кортико-медуллярная зона крысы интактной группы. В. Корковое вещество почки крысы контрольной группы на 3-и сутки после иммобилизации. Г. Кортико-медуллярная зона крысы контрольной группы на 3-и сутки после иммобилизации. Д. Корковое вещество крысы опытной группы на 3-и сутки после иммобилизации и введения МСК. Е. Кортико-медуллярная зона крысы опытной группы на 3-и сутки после иммобилизации и введения МСК. Окраска гематоксилин-эозином. Увеличение х200
Согласно данным проведенного гистоморфометрического исследования с 1-х по 30-е сутки наблюдения у животных, перенесших 24-часовую иммобилизацию, отмечалось достоверное увеличение относительно интактных значений общей площади почечного тельца на 44,32% (р<0,001), 53,61% (р<0,001), 52,53% (р<0,001), 42,37% (р<0,001), 26,32% (р<0,001) и 7,96% (р<0,001) соответственно, площади сосудистого клубочка соответственно на 35,74% (р<0,001), 43,32% (р<0,001), 41,93% (р<0,001), 33,58% (р<0,001), 22,27% (р<0,001) и 9,52% (р<0,001), площади капсулы нефрона соответственно на 127,78% (р<0,001), 155,55% (р<0,001), 152,39% (р<0,001), 137,76% (р<0,001), 56,77% (р<0,001) и 5,85% (р<0,01).
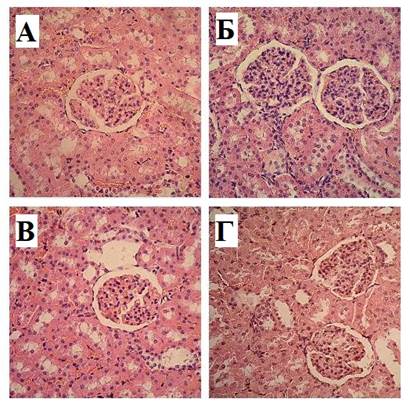
Рис. 2. А. Корковое вещество почки крысы контрольной группы на 14-е сутки после иммобилизации. Б. Кортико-медуллярная зона крысы контрольной группы на 14-е сутки после иммобилизации. В. Корковое вещество крысы опытной группы на 14-е сутки после иммобилизации и введения МСК. Г. Кортико-медуллярная зона крысы опытной группы на 14-е сутки после иммобилизации и введения МСК. Окраска гематоксилин-эозином. Увеличение х200
Наружные диаметры извитых канальцев соответственно увеличились на 14,96% (р<0,001), 21,26% (р<0,001), 19,27% (р<0,001), 15,25% (р<0,001), 7,62% (р<0,001) (для проксимального сегмента) и 34,99% (р<0,001), 44,03% (р<0,001), 39,67% (р<0,001), 28,92% (р<0,001), 14,84% (р<0,001) (для дистального сегмента), достигая к 30-м суткам интактных цифр. В то же время значения высоты эпителиоцитов проксимальных и дистальных извитых канальцев кортикальных нефронов были достоверно ниже показателей крыс интактной группы в 1-е сутки наблюдения соответственно на 11,96% (р<0,001) и 11,98% (р<0,001), на 3-и сутки – на 18,58% (р<0,001) и 20,91% (р<0,001), на 7-е сутки – на 11,17% (р<0,001) и 14,42% (р<0,001), на 14-е сутки – на 9,2% (р<0,001) и 12,54% (р<0,001), на 21-е сутки – на 3,97% (р<0,001) и 5,19% (р<0,001). К 30-м суткам числовые значения изучаемых морфологических структур достигали показателей группы № 1. У животных, получавших инъекции МСК, в начальные сроки наблюдения отмечались сходные изменения гистоморфометричеких параметров кортикальных нефронов, статистически не отличающиеся от показателей группы контроля.
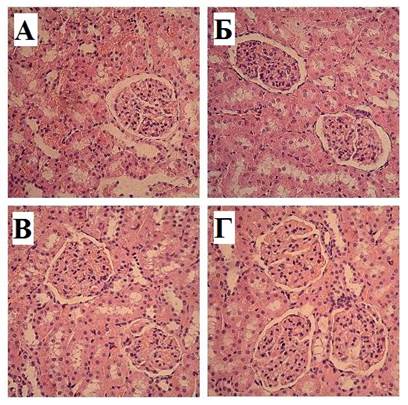
Рис. 3. А. Корковое вещество почки крысы контрольной группы на 30-е сутки после иммобилизации. Б. Кортико-медуллярная зона крысы контрольной группы на 30-е сутки после иммобилизации. В. Корковое вещество крысы опытной группы на 14-е сутки после иммобилизации и введения МСК. Г. Кортико-медуллярная зона крысы опытной группы на 30-е сутки после иммобилизации и введения МСК. Окраска гематоксилин-эозином. Увеличение х200
С 14-х по 30-е сутки эксперимента наблюдались статистически достоверные изменения показателей основных морфологических структур нефронов коркового вещества почек крыс опытной группы относительно контрольных значений. Так, показатели общей площади почечного тельца достоверно снизились на 14-е, 21-е и 30-е сутки наблюдения соответственно на 9,92% (р<0,001), 20,19% (р<0,001) и 7,3% (р<0,001), площади сосудистого клубочка – соответственно на 5,16% (р<0,001), 19,3% (р<0,001), 8,75% (р<0,001), площади капсулы нефрона – на 32,83% (р<0,001), 32,77% (р<0,01) и 5,25% (р<0,001), наружный диаметр проксимальных канальцев – соответственно на 4,12% (р<0,001), 4,22% (р<0,001) и 2,18% (р<0,001), наружный диаметр дистальных извитых канальцев – соответственно на10,73% (р<0,001) и 12,71% (р<0,001), а к 30-м суткам наблюдения статистически не отличался от значений групп № 1 и № 2. Высоты эпителиоцитов проксимальных и дистальных канальцев кортикальных нефронов крыс опытной группы были выше контрольных значений на 14-е сутки соответственно на 3,1% (р<0,001) и 3,09% (р<0,001), на 21-е сутки – соответственно на 4,38% (р<0,001) и 5,06% (р<0,001), на 30-е сутки статистически не отличались от показателей животных интактной и контрольной групп.
При оценке гистоморфометрических показателей структур юкстамедуллярных нефронов было установлено, что после моделирования экспериментального стресса они были максимально выражены на 3-и сутки постиммобилизационного периода как в контрольной, так и в опытной группах. Так, у экспериментальных животных групп № 2 и № 3 в 1-е и 3-и сутки наблюдения значения общей почечного тельца возросли относительно интактных цифр соответственно на 57,26% (р<0,001) и 5,99% (р<0,001), площади сосудистого клубочка – на 43,22% (р<0,001) и 43,87% (р<0,001), площади пространства капсулы нефрона – на 211,64% (р<0,001) и 200,16% (р<0,001), диаметра проксимального извитого канальца – на 26,15% (р<0,001) и 26,56% (р<0,001), диаметра дистального извитого канальца – на 60,57% (р<0,001) и 60,83% (р<0,001). Также отмечалось снижение высоты эпителиальных клеток как в проксимальных (соответственно на 24,09% (р<0,001) и 23,66%, (р<0,001)), так и в дистальных (соответственно на 34,25% (р<0,001) и 34,28%, (р<0,001)) отделах почечных канальцев. При этом в начальные сроки наблюдения между показателями групп № 2 и № 3 какая-либо статистическая разница отсутствовала. Начиная с 7-х суток исследования отмечалась постепенная нормализация изучаемых параметров, однако у животных, пролеченных МСК, темпы их восстановления были более быстрыми по сравнению с группой контроля. Так, на 7-е, 14-е, 21-е и 30-е сутки эксперимента показатели группы животных, получавших клеточную терапию, были достоверно снижены по сравнению с контрольными значениями при оценке общей площади почечного тельца соответственно на 4,84% (р<0,05), 12,56% (р<0,001), 17,22% (р<0,001) и 9,05% (р<0,001), площади сосудистого клубочка – соответственно на 5,26% (р<0,01), 6,5% (р<0,001), 15,6% (р<0,01) и 4,63% (р<0,01), площади капсулы нефрона – на 8,19% (р<0,001), 30,71% (р<0,001), 25,09% (р<0,001) и 30,14% (р<0,001), диаметра наружного просвета проксимального извитого канальца – соответственно на 2,82% (р<0,001), 2,96% (р<0,001), 5,79% (р<0,001) и 1,36% (р<0,001), диаметра наружного просвета дистального извитого канальца – соответственно на 5,06% (р<0,001), 11,76% (р<0,001), 13,45% (р<0,001) и 1,13% (р<0,05). Что касается значений высоты эпителиоцитов канальцев юкстамедуллярных нефронов крыс опытной группы, то с 7-х по 21-е сутки наблюдения они увеличивались относительно цифр группы контроля в проксимальных отделах на 1,43% (р<0,05), 2,92% (р<0,001) и 7,15% (р<0,001), в дистальных отделах – соответственно на 4,33% (р<0,001), 4,88% (р<0,001) и 7,26% (р<0,001), а на 30-е сутки статистически от них не отличались.
Результаты проведенного исследования свидетельствуют о более быстрых темпах восстановления изучаемых параметров морфологических структур почечной ткани при применении мезенхимальных стволовых клеток в условиях моделируемого эксперимента, что, вероятно, обусловлено их паракринными эффектами, направленными на ингибирование апоптоза, поддержку регенерации и стимуляции, пролиферацию и дифференцировку тканеспецифических предшественников [1, 2, 4].
Заключение. Действие вынужденной 24-часовой иммобилизации приводит к гемодинамическим расстройствам в почечной ткани и значительным изменениям морфологических показателей нефронов обоих типов, проявляющихся гипертрофией почечных телец, расширением пространства капсулы Шумлянского–Боумена, дилатацией всех видов канальцев, гидропической дистрофией эпителиоцитов и десквамацией кальциевого эпителия. Явления дилатации были более выражены в дистальных отделах. При этом в юкстамедуллярных нефронах изменения гистоморфометрических параметров были более выражены. Применение аллогенных мезенхимальных стволовых клеток после вынужденной 24-часовой иммобилизации способствовало ускорению процессов восстановления гистоморфометрических показателей у животных опытной группы по сравнению с группой контроля.



